根际促生菌影响植物吸收和转运重金属的研究进展
2015-03-12郭军康董明芳丁永祯冯人伟王瑞刚徐应明
郭军康,董明芳,丁永祯,冯人伟,王瑞刚,徐应明
1. 农业部环境保护科研监测所,中国农业科学院农田重金属污染修复创新团队,天津 300191;2. 农业部环境保护科研监测所,天津 300191;3. 广西大学农学院,广西 南宁 530003
根际促生菌影响植物吸收和转运重金属的研究进展
郭军康1*,董明芳1, 3,丁永祯2,冯人伟1,王瑞刚1,徐应明1
1. 农业部环境保护科研监测所,中国农业科学院农田重金属污染修复创新团队,天津 300191;2. 农业部环境保护科研监测所,天津 300191;3. 广西大学农学院,广西 南宁 530003
摘要:土壤重金属污染对生态环境和人类健康造成严重危害,使得土壤重金属污染修复成为全球关注的研究热点之一。根际土壤中存在着数量和种类丰富的微生物种群,是根际环境中最重要的生物因素。重金属污染土壤中根际微生物与植物根系以及土壤形成特殊根际微环境,影响植物重金吸收、转运过程。根际促生菌通过产生植物生长激素类物质促进植物生长,改变根际微环境中重金属元素生物有效性,增加修复植物重金属吸收量,强化重金属污染土壤植物修复效率。近年来,根际促生菌强化重金属污染土壤植物修复效率相关研究文献数量迅速增加,最新研究成果表明:根际促生菌通过菌体表面活性基团吸附,诱导植物系统抗性(ISR),激活植物抗氧化酶活性,分泌高亲和性铁载体(Siderophores)增加根际铁供给量,竞争性抑制重金属元素的根系吸收,改变植物重金属的吸收、转运及胞内分布过程,抑制重金属元素向植物地上部分转运,同时增加农作物产量。文章对根际促生菌影响植物重金属吸收﹑转运最新研究进展进行综述,提出根际促生菌原位定殖,重金属元素亚细胞分布和重金属吸收、转运分子调控机制等方面的深入研究,将有助于进一步阐明重金属污染土壤植物根际促生菌-植物相互作用机制。通过根际促生菌调控农作物可食部分重金属的累积量,为实现中低污染农田安全生产与修复研究提供新思路。
关键词:植物根际促生菌;重金属;吸收;转运;污染土壤修复
引用格式:郭军康,董明芳,丁永祯,冯人伟,王瑞刚,徐应明. 根际促生菌影响植物吸收和转运重金属的研究进展[J]. 生态环境学报, 2015, 24(7): 1228-1234.
GUO Junkang, DONG Mingfang, DING Yongzhen, FENG Renwei, WANG Ruigang, XU Yingming. Effects of Plant Growth Promoting Rhizobacteria on Plants Heavy Metal Uptake and Transport: A Review [J]. Ecology and Environmental Sciences, 2015, 24(7): 1228-1234.
重金属矿产资源和化石燃料的大规模开发利用,工业“三废”的大量排放以及含重金属农药、化肥的大量使用对生态环境造成了严重污染(Rodríguez et al.,2008;Gomez-Sagasti et al,2012)。2014年4月环境保护部和国土资源部发布了全国土壤污染状况调查公报,调查结果表明,全国土壤总的点位超标率为16.1%,且以重金属为代表的无机污染物为主。土壤重金属污染具有隐蔽性、潜伏性、不可逆性、长期性和危害大的特点,且存在修复时间长,治理成本高等难题,使得土壤重金属的污染修复成为国内外研究的热点和难点。土壤重金属污染已成为影响生态环境、耕地质量、粮食安全、人体健康和社会发展的重要环境不利因素(Mclaughlin et al.,1999;周东美等,2011)。
重金属污染修复经历了客土法、原位物理电动修复法、原位钝化修复等研究与实践过程,上述修复技术具有修复效果好,时间短的优点,但也存在耗费人力、物力和财力巨大,修复成本高,易于引入二次污染,影响土壤生态系统安全等弊端(黄益宗等,2013)。植物修复技术由于其经济、绿色、环境友好,且不引入二次污染等优点逐渐为人们所重视。然而修复植物生长慢、生物量小、对重金属有选择性、周期长等缺点制约了植物修复技术的发展(朱雪竹等,2010)。根际土壤中存在着数量和种类惊人的微生物种群(每克土壤中存在4000~10000种原核微生物,总数约2×109个),它们与植物根系以及土壤形成特殊土壤微环境,是植物根际土壤中最重要的生物因素(Schloss et al.,2006)。研究发现,一些分离自重金属污染土壤,对多种重金属具有较高耐受性的植物根际促生菌能够促进重金属污染土壤修复植物生长,增加修复植物生物量,提高植物修复效率,使得植物-微生物联合修复成为重金属污染土壤生物修复研究热点之一(韦革宏等,2010;Rajkumar et al.,2012;Long et al.,2013)。
值得注意的是,近年来植物根际促生菌调控农作物重金属吸收、转运,降低农作物可食部分重金属累积的研究结果相继被报道(Dary et al.,2010;Sarwar et al.,2010;Schue et al.,2011;De Souza et al.,2012;Wu et al.,2012;王立等,2014)。Ahmad et al.(2014)发现重金属污染条件下,接种植物根际促生菌Klebsiella sp. CIK-502能够增加小麦和玉米生物量,同时显著降低地上部与地下部Cd含量。Guo et al.(2014)接种耐重金属植物根际促生菌(Bradyrhizobium sp. YL-6)能够同时降低Cd污染土壤大豆地下部分与地上部分Cd含量。本文通过综述近期植物根际促生菌调控植物重金属吸收、转运研究进展,有助于进一步认识重金属污染土壤植物根际促生菌-植物相互作用机制,结合我国农田重金属污染特征,为实现中低污染农田安全生产与修复提供新研究思路与理论支持。
1 根际与植物根际促生菌
根际(rhizosphere)是指生物和物理特性受到植物根系影响的、紧密环绕根的土壤区域(Hiltner,1904)。根际是植物-土壤-微生物间相互作用的重要界面,在这一微小的土壤区域内,进行着植物与土壤的绝大部分物质、能量与信息交换,同时为植物正常生长发育提供着最基本的养分供给,被认为是植物-土壤系统中最活跃的部分。在重金属污染农田中,根际既是作物养分输送重要界面,也是重金属元素通过作物吸收-转运-累积-进入食物链的主要渠道(张福锁,2008)。植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是指以定殖或自由附着的方式生活在植物根际的一类细菌总称。它可以通过产生植物生长激素如吲哚乙酸(Indole-3-acetic acid,IAA)、赤霉素(Gibberellins acid,GA)、脱落酸(Abscisic acid,ABA)或细胞分裂素(Cytokinins,CTK)等,分泌1-氨基环丙烷-1-羧酸(ACC)脱氨酶、生物固氮、溶解无机磷酸盐、拮抗植物病源菌入侵等方式促进植物生长(Kloepper et al.,1978)。
2 重金属污染土壤植物根际促生菌多样性
Burr et al.(1978)首先报道了两株对马铃薯具有促生作用的PGPR以来国内外已发现超过20个属的根际细菌具有潜在植物促生能力,常见如伯克霍尔德菌属(Burkholderia)、固氮菌属(Azotobacter)、芽孢杆菌属(Bacillus)、黄单胞菌属(Xanthomonas)、假单胞菌属(Pseudomonas)、节杆菌属(Arthrobacter)、固氮螺菌属(Azospirillum)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、黄杆菌属(Flavobacterium)和慢生型根瘤菌属(Bradyrhizobium)等(De Souza et al.,2015)。孙乐妮等(2009)从Cu耐受型植物海洲香薷(Elsholtzia splendens)根际分离到27株具ACC脱氨酶活性、产吲哚乙酸、分泌较多的铁载体且具有较高Cu耐受性的植物根际促生细菌,进一步分类学研究发现,这些菌株分属于7个菌群,其中具ACC脱氨酶活性菌株分属于变形菌门(Proteobacteria),γ-变形菌纲(Gammaproteobacteria)假单胞菌目(Pseudomonadales),莫拉氏菌科(Moraxellaceae)不动杆菌属(Acinetobacter)和β-变形菌纲(Betaproteobacteria),伯克霍尔德氏菌目(Burkholderiales),产碱菌科(Alcaligenaceae)产碱菌属(Alcaligenes)。栾静(2012)研究发现Cu胁迫下,海洲香薷(E. splendens)根基部1 cm区域内微生物多样性较高,群落结构特征较为接近,且此区域内土壤Cu生物有效性高于非根际区域,对根际和非根际两种土壤微生物多样性采用梯度凝胶电泳(PCR-DGGE)和荧光定量PCR(RT-PCR)特征分析结果表明,变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是海州香蕾根际优势细菌种群,然而重金属胁迫诱导厚壁菌门(Firmicutes)所属芽孢杆菌菌属(Bacillus)种群出现在Cu污染土壤海洲香薷根际。Luo et al.(2011)从Cd超积累植物龙葵不同组织(根、茎、叶)中分别分离得到30株耐重金属植物促生菌,分类学研究表明其分别归属于放线菌门(Actinobacteria)占43%,变形菌门(Proteobacteria)占23%,拟杆菌门(Bacteroidetes)占27%和厚壁菌门(Firmicutes)占7%。通过分析近年来已报道的,分离自重金属污染土壤植物根际促生菌种属分布特征,我们发现:常见植物根际促生菌主要分布于细菌域(Bacteria),厚壁菌门(Firmicutes),芽孢杆菌纲(Bacilli)、变形菌门(Proteobacteria),α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)和γ-变形菌纲(Gammaproteobacteria),放线菌门(Actinobacteria),放线菌纲(Actinobacteria)以及真核域(Eukarya),球囊菌门(Glomeromycota),如表1所示。对于重金属胁迫条件下,植物根际促生菌的分类学研究有助于我们进一步认识重金属胁迫与植物根际促生菌种群多样性及其变化规律,为新的重金属耐性菌株筛选及其缓解宿主植物重金属胁迫机制研究提供分类学与系统发育学指导。
3 植物根际促生菌强化重金属污染土壤植物修复
3.1产生植物生长激素提高修复植物生物量
植物根际促生菌能够通过直接合成植物生长激素等化学物质(如吲哚乙酸(Indole acetic acid,IAA),脱落酸(Abscisic acid,ABA),细胞分裂素(Cytokinin,CTK)和赤霉素(Gibberellin,GA)等)缓解重金属等环境因子胁迫,促进植物生长发育。Guo等(2011)从重金属复合污染土壤分离筛选到一株能够耐受多种重金属(Pb 800 mg·L-1,Cd 1500 mg·L-1,Cu 150 mg·L-1,Zn 2500 mg·L-1),且具有产生植物生长激素(IAA),分泌铁载体(Siderophores)和ACC脱氨酶的伯克氏菌D54 (Burkholderia sp. D54)。重金属复合污染土壤盆栽试验结果表明,接种伯克氏菌D54显著提高了Cd/Zn超积累植物东南景天(Sedum alfredii Hance)生物量及重金属铅累积量。何琳燕等(2011)南京栖霞铅锌银矿区茄科Cd超积累植物龙葵(Solanum nigrum L.)叶片和根及根际土壤分离筛选到5株能够产生吲哚乙酸(IAA)和铁载体且具有Cd抗性芽孢杆菌(Bacillus),其中菌株AR1、AY1、BGJ4能够显著促进油菜(Oilseed rape)幼苗根的伸长。陈生涛等(2014)究发现接种耐Cu植物根际促生菌Rhizobium sp.W33能够显著促进黑麦草根系对Cu的吸收,增加根部Cu累积量,与此同时Rhizobium sp.W33能够提高Cu的富集系数和转移系数,使得黑麦草地上部的Cu含量增加。罗雅(2012)从重金属污染土壤分离筛选到一株Pb和Cd耐性菌株(Ochrobactrum sp. J3),盆栽试验结果表明,接种菌株J3的香根草(Vetiveria zizanioides)生物量是不加菌的2.1倍,其地上部分铅、镉的含量分别是不加菌的2.8和6.0倍。据统计,根际土壤细菌中大约80%具有产生IAA的生理特性。重金属污染条件下,植物根际促生菌可能通过分泌植物生长激素,刺激植物根系生长,增加根系吸收面积,从而提高植物根系重金属吸收效率,增加修复植物重金属累积量(马莹等,2013)。
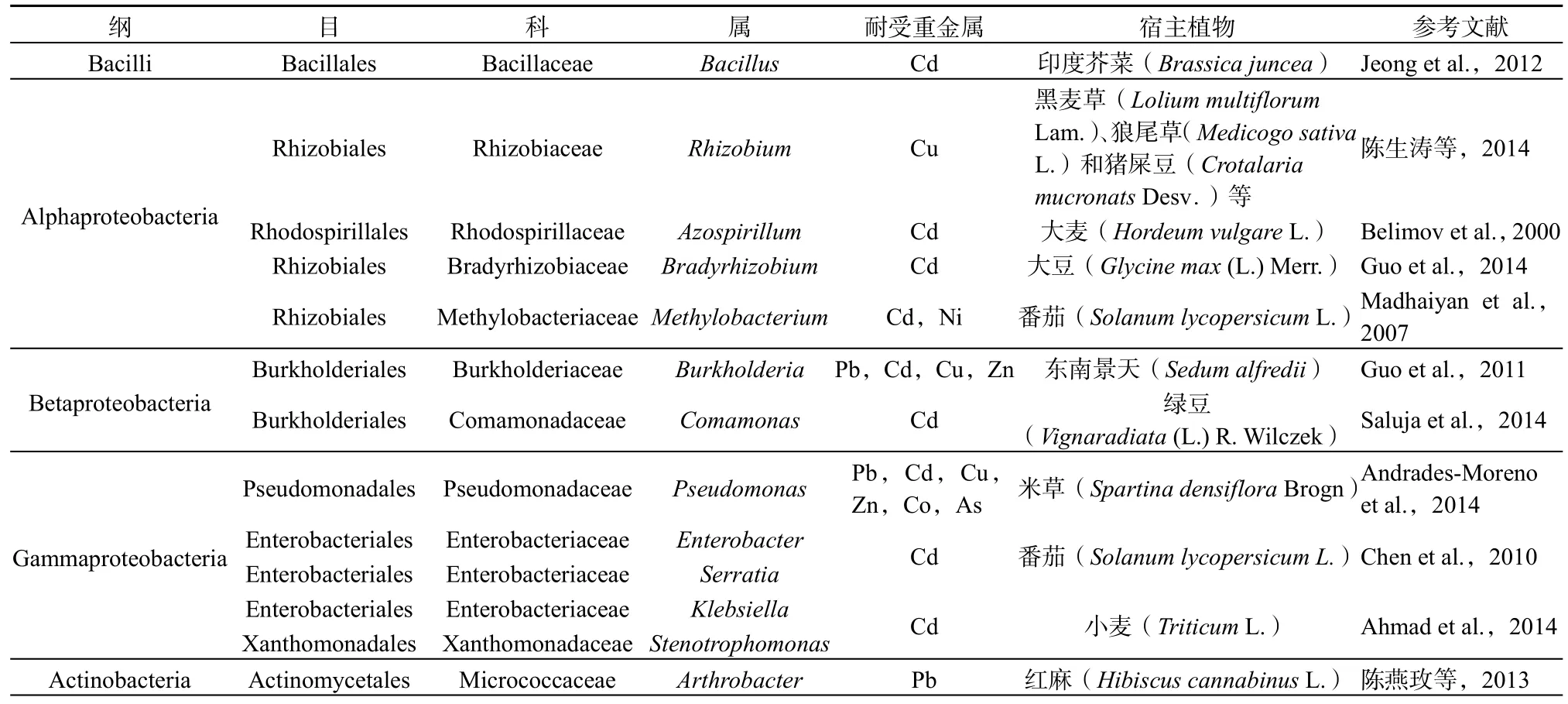
表1 重金属污染土壤常见植物根际促生菌及其多样性Table 1 The most frequently studied PGPR and their phylogenetic classification
3.2分泌ACC脱氨酶缓解修复植物重金属胁迫
乙烯是重要的植物系统防御信号分子之一。重金属等逆境胁迫促使植物体内乙烯浓度急剧升高,抑制植物正常生长发育活动,以应对逆境胁迫可能对植物体造成的损伤。Sheng et al.(2008)从重金属污染土壤生长油菜根系组织中分离到两株对重金属铅有较强耐受性,且具ACC脱氨酶的植物促生菌Pseudomonas fluorescens G10和Microbacterium sp.G16,在铅污染土壤盆栽试验中,接种菌株G10 和G16显著提高了油菜(Brassica napus)生物量和铅积累量。Luo et al.(2011)从Cd超积累植物龙葵不同组织中分离得到18株具有ACC脱氨酶活性植物促生菌,其中四株回接龙葵后能够缓解Cd对宿主植物的毒害,接菌后龙葵地下部分干重增加了55%~143%,地上部分干重增加了64%~100%;地下部分Cd总累积量增加了66%~135%,地上部分Cd总累积量增加了22%~64%。ACC是植物体乙烯合成的前提物质,具有ACC脱氨酶活性的植物根际促生菌能够通过分解ACC为α-丁酮酸(α-ketobutyrate)和氨分子,从而降低植物体内乙烯合成量,缓解重金属等环境胁迫对植物体生长发育的影响,增加修复植物重金属耐受性。
3.3增加根际土壤重金属生物有效性
土壤中重金属元素能够与磷酸盐矿物通过表面离子交换、络合及阳离子共沉淀等方式形成难溶性磷酸盐沉淀(徐超等,2012)。研究发现,一些植物根际促生菌能够通过分泌低分子量有机酸降低土壤溶液pH值或分泌胞外磷酸酶等方式溶解土壤难溶性无机磷酸盐。然而,磷元素被释放的同时与之结合的重金属离子亦被活化,根际土壤重金属离子有效态的增加有利于植物根系对重金属离子的吸收与转运。Jeong et al.(2012)在Cd污染土壤条件下,将具有溶磷作用的一株巨大芽孢杆菌(Bacillus megaterium)接种印度芥菜(Brassica juncea)和苘麻(Abutilon theophrasti),结果表明:接种巨大芽孢杆菌使得供试植物根际土壤可交换态Cd含量显著增加,而印度芥菜和苘麻茎干中Cd累积量分别提高了39%和68%。此外,Prapagdee et al.(2013)究发现,接种耐Cd植物根际促生菌Micrococcus sp. MU1和Klebsiella sp. BAM1能够通过产生植物生长激素(IAA)促进向日葵生长,增加其地下部与地上部生物量。此外,接种耐Cd植物根际促生菌Micrococcus sp. MU1和Klebsiella sp. BAM1能够增加根际土壤水溶态Cd浓度(土壤水溶态Cd浓度分别增加了2.65和2.68倍),提高向日葵根系对于Cd的吸收,从而提高重金属污染土壤植物修复效率。Jiang et al.(2008)从重金属污染土壤分离得到一株具有溶磷等植物促生作用的伯克氏菌(Burkholderia sp. J62),盆栽条件下接种玉米和番茄,结果表明该菌具有较强土壤重金属(Pb 和Cd)活化能力,能够显著提高供试植物根际玉米和番茄土壤可交换态Pb和Cd含量,且供试玉米和番茄Pb、Cd含量与未接菌对照组相比分别升高了38%~192%和5%~191%。另外,接种耐重金属植物根际促生菌(分别归属于Pseudomonas,Proteus,Bacillus,Enterobacter)能够通过活化根际土壤重金属,增加根际重金属生物有效性,促进Cd超积累植物龙葵(S. nigrum L.)Cd累积量(黄文,2011;刘莉华,2013)。
4 植物根际促生菌对作物重金属吸收、转运的抑制作用
在重金属等环境胁迫下,由于植物营养体的不可移动性,使其丧失了类似动物的逃避机制。然而经过漫长的进化过程,植物根系与根际微生物演化出复杂而有效的相互作用关系,来应对各种复杂的生物与非生物胁迫。接种耐重金属植物根际促生菌能够有效提高植物生物量,改变一些修复植物重金属累积量,提高了重金属污染植物修复效率。值得注意的是,近年来一些研究表明,接种植物根际促生菌能够在缓解植物重金属毒害的同时降低农作物重金属累积量。已有研究表明,植物根际促生菌主要通过以下几个方式调控作物重金属累积量。
4.1菌体细胞壁与胞外多糖介导的重金属离子吸附
微生物菌体细胞壁化学组成赋予其带负电核的特性,细胞壁上带负电的活性基团通过静电吸附,离子交换及螯合作用等方式与游离态重金属离子结合,降低金属离子在土壤中的生物有效性。此外,菌体分泌胞外多糖类物质(Exopolysaccharides,EPS)亦被证实能够吸附根际游离态重金属离子,减少根际土壤中重金属的生物有效性。附着于植物根系的植物根际促生菌通过菌体细胞壁和胞外多糖类物质对于游离态重金属离子的吸附作用有助于降低根际有效态重金属离子浓度,缓解重金属对植物的毒害,减少植物根系对于重金属离子的吸收。Schue et al.(2011)研究发现,一株分离自向日葵(Helianthus annuus)根际的根瘤菌菌株(Rhizobium alamii MSΔGT)通过分泌胞外多糖,在宿主植物根系形成一层保护膜,阻控根际游离态Cd2+离子进入植物根系组织。Dary et al.(2010)研究发现接种植物促生菌Bradyrhizobium sp. 750,Pseudomonas sp.和Ochrobactrumcytisi能够缓解重金属对于黄羽扇豆(Lupinus luteus)毒害作用,显著增加黄羽扇豆生物量,并且显著降低植物根系组织重金属(Cd、Pb、Zn和Cu)含量与植物地上部分重金属(Cd和Pb)含量。Guo et al.(2014)研究发现,接种耐Cd植物促生菌(Bradyrhizobium sp. YL-6)能够同时降低生长在Cd污染土壤大豆地下部分与地上部分Cd含量。
4.2诱导植物系统抗性(ISR)降低作物重金属毒害
植物根际促生菌能够通过诱导植物系统抗性(Induced systemic resistance,ISR),上调胁迫响应相关基因表达,增加抗氧化酶活性等方式降低植物重金属毒害(Gopalakrishnan et al.,2014)。植物组织细胞中由于重金属等环境胁迫因子产生的超氧阴离子自由基O-2通过超氧化物歧化酶(Superoxide dismutase,SOD)等抗氧化酶催化作用被转化成H2O2和O2,而在过氧化氢酶(Catalase,CAT)和过氧化物酶(Peroxidase,POD)等作用下H2O2被进一步转化成H2O,从而减少活性氧对植物细胞的伤害。据报道,植物体约有67%的抗氧化酶或蛋白参与重金属解毒过程(Ovečka et al.,2014)。马文丽等(2005)研究发现,接种沼泽红假单胞菌(Rhodopseudomonas palustris)能够通过增加植物内源抗氧化酶活性同时增加同工酶表达,缓解Cd对于黑小麦的胁迫,促进黑小麦幼苗生长。郭凌等(2008)研究发现随着Cd处理浓度和时间的增加,小麦叶片抗氧化酶SOD和CAT活性降低。接种球形红细菌(Rhodobacter sphaeroides)提高叶片抗氧化酶SOD和CAT活性,缓解Cd对小麦幼苗毒害作用。De Souza et al.(2012)在Pb污染土壤中接种VA菌根,球囊菌门(Glomeromycota)幼套球囊霉(Glomusetunicatum)能够促进毛蔓豆(Calopogonium Desv)对养分吸收,从而增加毛蔓豆生物量,但对毛蔓豆地上部Pb吸收没有显著影响。生理生化研究表明,接种幼套球囊霉能够降低质膜脂质的过氧化反应,缓解重金属毒害。王立等(2014)研究发现,Cd污染条件下接种丛枝菌根真菌(Arbuscularmycorrhizal fungi,AMF)摩西球囊霉(Glomusmosseae)和根内球囊霉(Glomusintraradice)使得水稻叶片丙二醛(Malondialdehyde,MDA)含量显著降低,SOD活性和Pro(脯氨酸)的含量显著提高。与此同时降低水稻对Cd的富集系数与转运系数,抑制了Cd向地上部分转运的趋势。此外,Gururani et al.(2013)研究发现,植物根际促生菌(Bacillus pumilus str. DH-11和Bacillus firmusstr. 40)能够上调茄科植物马铃薯体内抗氧化酶(ROS-scavenging enzymes,SOD,和Ascorbateperoxidase,APX)基因转录水平,而植物抗氧化酶活性升高能够有效缓解重金属锌等对马铃薯毒害作用。
4.3铁载体介导的微量元素与重金属离子竞争机制
地壳中存在大量铁元素(含量排名第4位),由于地球富氧环境造成地壳中铁元素主要以不能被生物直接利用的Fe3+形式存在,且土壤中Fe3+附着于土壤颗粒及金属矿物表面形成微小团聚体形态,不利于被生物吸收利用(蒙渊,2011)。作为主要的物质循环推动者,土壤微生物具备了以分泌铁载体(Siderophores)的方式获得生长必需铁元素的能力。铁载体是一类在低铁条件下,主要由微生物胞内产生并分泌到胞外的,对Fe3+具有很强络合作用(络合系数达1020~1030)的小分子量有机物(Castignetti et al.,1986)。铁载体通常分子量在500~1500 Da之间,八面体构型的异羟肟酸或者邻苯二酚衍生物。铁载体包括氧肟酸盐型(Hydroxamicacid)、儿茶酚盐型(Catecholamine)、柠檬酸盐型(Citrie acid)和混合型(Neilands,1995)。缺铁条件下,尽管一些禾本科植物也能够通过合成少量植物铁载体增加根系铁吸收,但是根际铁载体分泌细菌对植物铁吸收具有重要促进作用。研究发现,红三叶和番茄能够通过改变根际微生物群落结构,增加铁载体分泌细菌种群和数量的方式有效应对缺铁胁迫(金崇伟,2008)。植物根际促生菌通过分泌铁载体螯合根际土壤Fe3+元素在植物根系附近富集,并通过根表螯合铁还原酶(Ferric helatereductase,FRO)将Fe3+还原为植物能够利用的Fe2+。还原态铁在分布于根表皮细胞的铁高亲和性载体(Iron response transporter1,IRT1)介导下被转运进入根系养分转运系统,供给叶片等地上部组织器官生长发育所需Fe元素(Kobayashi et al.,2012)。研究表明,植物生长必需金属元素(Fe,Zn,Cu和Mn等)进入植物根系主要通过与根系表皮细胞主动吸收,以及表皮细胞膜特定转运蛋白(铁载体IRT1和锌转运蛋白ZIP)的参与使得金属元素吸收转运具有一定的专一性,有利于植物调控体内金属元素浓度,避免过量金属元素毒害效应(Sebastian et al.,2014)。尽管一些重金属元素(如Cd等)为植物生长非必需元素,然而研究发现Cd与其他植物生长必需元素(如Fe和Zn等)具有相似的性质与结构,能够通过竞争其他金属离子转运通道的方式进入植物体内(Nazar et al.,2012)。Wu et al.(2012)通过研究植物拟南芥吸收Fe元素与Cd相互作用机制发现,添加高浓度Fe能够诱导植物铁吸收转运相关基因(FIT)表达,以增加地上部分的铁含量的方式抑制Cd向地上部分转运。Sinha et al.(2008)研究发现,接种具有铁载体分泌能力的植物根际促生菌Pseudomonas. aeruginosa KUCd1使得西葫芦(Cucurbita pepo)地下部分与地上部分Cd含量分别降低了59.2%和47.4%,使得印度芥菜(Brassica juncea)地下部分与地上部分Cd含量分别降低了52.4%和36.9%。Tank et al. (2009)报道了重金属Ni污染土壤接种分泌铁载体植物根际促生菌(Pseudomonas sp.)能够显著增加鹰嘴豆生物量,同时降低鹰嘴豆Ni含量(与对照比降低50%)。Guo et al.(2014)研究发现Cd污染条件下,接种具有铁载体分泌能力的植物促生菌(Bradyrhizobium sp. YL-6)能够显著增加大豆叶片Fe和Mg元素含量,而显著降低Cd元素含量,与此同时叶片光合色素含量显著增加。这些发现为采用环境友好的植物根际促生菌调控作物重金属吸收转运,降低作物可食部分重金属累积,实现中低污染农田安全生产与修复提供新研究思路与理论支持。
5 展望
众多研究表明植物根际促生菌能够通过其自身代谢活动,产生植物生长激素促进植物生长,增加根际土壤重金属元素生物有效性,提高重金属超积累植物重金属累积量,从而提高污染土壤植物提取修复效率。与此同时,植物根际促生菌通过影响植物细胞生理活动,诱导植物系统抗性(ISR),激活植物抗氧化酶活性,通过分泌高亲和性铁载体的方式增加根际铁供给,竞争性抑制重金属元素的根系吸收转运,影响植物重金属的吸收转运及胞内分布过程,从而降低重金属的植物累积量。重金属胁迫下,植物根际促生菌与宿主植物间相互作用关系研究成果,使我们认识到植物根际促生菌在根际土壤重金属迁移转化过程中所起的重要作用。总结前期研究进展,展望今后一段时期内研究工作,以下几个方面需要给予更多的关注:(1)植物根际促生菌与宿主植物原位定殖特征研究,通过原位探针标记技术深入揭示菌株根际定殖过程,为高效修复菌剂开发与使用提供理论与技术支持;(2)根际促生菌代谢产物种类、结构与性质对宿主植物根系组织重金属元素亚细胞分布的影响有待深入研究;(3)根际促生菌影响植物重金属吸收、转运生理过程与分子调控机制需要进一步阐明。
参考文献:
AHMAD I, AKHTAR M J, ZAHIR Z A, et al. 2014. Cadmium tolerant bacteria induce metal stress tolerance in cereals [J]. Environmental Science and Pollution Research, 21(18): 11054-11065.
ANDRADES-MORENO L, DEL CASTILLO I, PARRA R, et al. 2014. Prospecting metal-resistant plant-growth promoting rhizobacteria for rhizoremediation of metal contaminated estuaries using Spartina densiflora [J]. Environmental Science and Pollution Research, 21(5): 3713-3721.
BELIMOV A A, DIETZ K J. 2000. Effect of associative bacteria on element composition of barley seedlings grown in solution culture at toxic cadmium concentrations [J]. Microbiological Research, 155(2): 113-121.
BURR T S, SCHROTH M N. 1978. Suslow T. Increased potato yield by treatment of seed pieces with specific strains of Pseudomonas fluorescens and P. putida [J]. Phytopathology, 68(9): 1377-1383.
CASTIGNETTI D, SMARRELLI J. 1986. Siderophores, the iron nutrition of plants, and nitrate reductase [J]. FEBS Letters, 209(2): 147-151.
CHEN L, LUO S, XIAO X, et al. 2010. Application of plant growth-promoting endophytes (PGPE) isolated from Solanum nigrum L. for phytoextraction of Cd-polluted soils [J]. Applied Soil Ecology, 46(3): 383-389.
DARY M, CHAMBER-PEREZ M A, PALOMARES A J, et al. 2010. “In situ” phytostabilisation of heavy metal polluted soils using Lupinus luteus inoculated with metal resistant plant-growth promoting rhizobacteria [J]. Journal of Hazardous Materials, 177(1-3): 323-330.
DE SOUZA L A, DE ANDRADE S A L, DE SOUZA S C R, et al. 2012. Arbuscular mycorrhiza confers Pb tolerance in Calopogonium mucunoides [J]. Acta Physiologiae Plantarum, 34(2): 523-531.
DE SOUZA R, MEYER J, SCHOENFELD R, et al. 2015. Characterization of plant growth-promoting bacteria associated with rice cropped in iron-stressed soils [J]. Annals of Microbiology, 65(2): 951-964.
GOMEZ-SAGASTI M T, ALKORTA I, BECERRIL J M, et al. 2012. Microbial Monitoring of the Recovery of Soil Quality During Heavy Metal Phytoremediation [J]. Water Air and Soil Pollution, 223(6): 3249-3262.
GOPALAKRISHNAN S, SATHYA A,VIJAYABHARATHI R. 2014. Plant growth promoting rhizobia: challenges and opportunities [J]. 3 Biotech, DOI 10.1007/s13205-014-0241-x.
GUO J, CHI J. 2014. Effect of Cd-tolerant plant growth-promoting rhizobium on plant growth and Cd uptake by Lolium multiflorum Lam. and Glycine max (L.) Merr. in Cd-contaminated soil [J]. Plant and Soil, 375(1-2): 205-214.
GUO J, TANG S, JU X, et al. 2011. Effects of inoculation of a plant growth promoting rhizobacterium Burkholderia sp. D54 on plant growth and metal uptake by a hyperaccumulator Sedum alfredii hance grown on multiple metal contaminated soil [J]. World Journal of Microbiology and Biotechnology, 27(12): 2835-2844.
GURURANI M A, UPADHYAYA C P, BASKAR V, et al. 2013. Plant Growth-Promoting Rhizobacteria Enhance Abiotic Stress Tolerance in Solanum tuberosum Through Inducing Changes in the Expression of ROS-Scavenging Enzymes and Improved Photosynthetic Performance [J]. Journal of Plant Growth Regulation, 32(2): 245-258.
HILTNER L. 1904. Uberneueerfahrungen und probleme auf demgebiete der bodenbakteriologie [J]. Arbeiten der Deutschen Landwirtschaft Gesellschaft, 98: 59-78.
JEONG S, MOON, H S, NAM K, et al. 2012. Application of phosphate-solubilizing bacteria for enhancing bioavailability and phytoextraction of cadmium (Cd) from polluted soil [J]. Chemosphere, 88(2): 204-210.
JIANG C Y, SHENG X F, QIAN M, et al. 2008. Isolation and characterization of a heavy metal-resistant Burkholderia sp. from heavy metal-contaminated paddy field soil and its potential in promoting plant growth and heavy metal accumulation in metal-polluted soil [J]. Chemosphere, 72(2): 157-164.
KLOEPPER J W, SCHROTH M N. 1978. Plant growth-promoting rhizobacteria on radishes [C] // Proc. of the 4th Internat. Conf. on Plant Pathogenic Bacter (Station de PathologieVegetale et Phytobacteriologie, INRA, Angers, France), 2: 879-882.
KOBAYASHI T, NISHIZAWA N K. 2012. Iron uptake, translocation, and regulation in higher plants [J]. Annual Review of Plant Biology, 63: 131-152.
LONG X X, CHEN X M, WONG J W C, et al. 2013. Feasibility of enhanced phytoextraction of Zn contaminated soil with Zn mobilizing and plant growth promoting endophytic bacteria [J]. Transactions of Nonferrous Metals Society of China, 23(8): 2389-2396.
LUO S L, CHEN L, CHEN J L, et al. 2011. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulator Solanum nigrum L. and their potential use for phytoremediation [J]. Chemosphere, 85(7): 1130-1138.
MADHAIYAN M, POONGUZHALI S, TONGMIN S. 2007. Metal tolerating methylotrophic bacteria reduces nickel and cadmium toxicity and promotes plant growth of tomato (Lycopersicon esculentum L.) [J]. Chemosphere, 69(2): 220-228.
MCLAUGHLIN M J, PARKER D R, CLARKE J M. 1999. Metals and micronutrients-food safety issues [J]. Field Crop Research, 60(1-2): 143-163.
NAZAR R, IQBAL N, MASOOD A, et al. 2012. Cadmium toxicity in plants and role of mineral nutrients in its alleviation [J]. American Journal of Plant Sciences, 3(10): 1476-1489.
NEILANDS J B. 1995. Siderophores: Structure and Function of Microbial Iron Transport Compounds [J]. Journal of Biological Chemistry, 270(45): 26723-26726.
OVEČKA M, TAKÁČ T. 2014. Managing heavy metal toxicity stress in plants: Biological and biotechnological tools [J]. Biotechnology Advance, 32(1): 73-86.
PRAPAGDEE B, CHANPRASERT M, MONGKOLSUK S. 2013. Bioaugmentation with cadmium-resistant plant growth-promoting rhizobacteria to assist cadmium phytoextraction by Helianthus annuus [J]. Chemosphere, 92(6): 659-66.
RAJKUMAR M, SANDHYA S, PRASAD M N V, et al. 2012. Perspectives of plant-associated microbes in heavy metal phytoremediation [J]. Biotechnology Advance, 30(6): 1562-1574.
RODRÍGUEZ J A, NANOS N, GRAU J M, et al. 2008. Multiscale analysis of heavy metal contents in Spanish agricultural topsoils [J]. Chemosphere, 70(6): 1085-1096.
SALUJA B, SHARMA V, 2014. Cadmium resistance mechanism in acidophilic and alkalophilic bacterial isolates and their application in bioremediation of metal-contaminated soil [J]. Soil and Sediment Contamination, 23(1): 1-17.
SARWAR N, SAIFULLAH, MALHI S S, et al. 2010. Role of mineral nutrition in minimizing cadmium accumulation by plants [J]. Journal of Food Agriculture and Environment, 90(6): 925-937.
SCHLOSS P D, HANDELSMAN J. 2006. Toward a census of bacteria in soil [J]. PLOS Computational Biology, 2(7): 786-793.
SCHUE M, FEKETE A, ORTET P, et al. 2011. Modulation of metabolism and switching to biofilm prevail over exopolysaccharide production in the response of Rhizobium alamii to cadmium [J]. PLoS ONE, 6(11): e26771.
SEBASTIAN A, PRASAD M N V. 2014. Cadmium minimization in rice: A
review [J]. Agronomy for Sustainable Development, 34(1): 155-173.
SHENG X F, XIA J J, JIANG C Y, et al. 2008. Characterization of heavy metal-resistant endophytic bacteria from rape (Brassica napus) roots and their potential in promoting the growth and lead accumulation of rape [J]. Environmental Pollution, 156(3): 1164-1170.
SINHA S, MUKHERJEE S K. 2008. Cadmium-induced siderophore production by a high Cd-resistant bacterial strain relieved Cd toxicity in plants through root colonization [J]. Current Microbiol, 56(1): 55-60.
TANK N, SARAF M. 2009. Enhancement of plant growth and decontamination of nickel-spiked soil using PGPR [J]. Journal of Basic Microbiology, 49(2): 195-204.
WU H, CHEN C, DU J, et al. 2012. Co-overexpression FIT with AtbHLH38
or AtbHLH39 in Arabidopsis enhanced cadmium tolerance via increased cadmium sequestration in roots and improved ironhomeostasis of shoots [J]. Plant Physiology, 158(2): 790-800.
ZHANG H H, TANG M, CHEN H, et al. 2010. Effect of inoculation with AM fungi on lead uptake, translocation and stress alleviation of Zea mays L. seedlings planting in soil with increasing lead concentrations [J]. European Journal of Soil Biology, 46(18): 306-311.
陈生涛, 何琳燕, 李娅, 等. 2014. Rhizobium sp.W33 对不同植物吸收铜和根际分泌物的影响[J]. 环境科学学报, 34(8): 2077-2084.
陈燕玫, 柏珺, 杨煜曦, 等. 2013. 植物根际促生菌辅助红麻修复铅污染土壤. 农业环境科学学报, 32(11): 2159-2167.
郭凌, 张肇铭, 芦冬涛. 2008. 球形红细菌对镉胁迫下小麦幼苗几项生理生化指标的影响[J]. 农业环境科学学报, 28(1): 40-45.
何琳燕, 李娅, 刘涛, 等. 2011. 龙葵根际和内生Cd抗性细菌的筛选及其生物学特性[J]. 生态与农村环境学报, 27(6): 83-88.
黄文. 2011. 产表面活性剂根际菌协同龙葵修复镉污染土壤[J]. 环境科学与技术, 34(10): 48-52.
黄益宗, 郝晓伟, 雷鸣, 等. 2013. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 32(3): 409-417.
金崇伟. 2008. 机理Ⅰ植物缺铁响应机制和信号调控途径[D]. 浙江大学.
刘莉华. 2013. 龙葵与微生物联合修复Cd污染土壤研究[D]. 南昌航空大学.
栾静. 2012. 重金属胁迫下海州香薷根际微域细菌群落结构和特异基因表达研究[D]. 浙江大学: 38-60.
罗雅. 2012. 耐性细菌强化香根草修复铅镉污染土壤的研究[D]. 广西大学: 28-35.
马文丽, 张荷玲, 杨素萍. 2005. 光合细菌对Cd2+胁迫下黑小麦幼苗生长及抗氧化酶的影响[J]. 农业环境科学学报, 24(6): 1059-1064.
马莹, 骆永明, 滕应. 2013. 根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 50(5): 1021-1031.
蒙渊. 2011. 产铁载体和ACC脱氨酶的氢氧化细菌筛选及促生作用研究[D]. 西北大学.
孙乐妮, 何琳燕, 张艳峰, 等. 2009. 海州香薷(Elsholtzia splendens)根际铜抗性细菌的筛选及生物多样性[J]. 微生物学报, 49(10): 1360-1366.
王立, 安广楠, 马放, 等. 2014. AMF对镉污染条件下水稻抗逆性及根际固定性的影响[J]. 农业环境科学学报, 33(10): 1882-1889.
韦革宏, 马占强. 2010. 根瘤菌-豆科植物共生体系在重金属污染地修复中的地位、应用及潜力[J]. 微生物学报, 50(11): 1421-1430.
徐超, 陈炳睿, 吕高明, 等. 2012. 硅酸盐和磷酸盐矿物对土壤重金属化学固定的研究进展[J]. 环境科学与管理, 37(5): 164-168.
张福锁. 2008. 根际生态学[M]. 北京: 中国农业大学出版社: 1-341.
周东美, 汪鹏. 2011. 基于细胞膜表面电势探讨Ca与毒性离子在植物根膜表面的相互作用[J]. 中国科学: 化学, 41(7): 1190-1197.
朱雪竹, 倪雪, 高彦征. 2010. 植物内生细菌在植物修复重金属污染土壤中的应用[J]. 生态学杂志, 29(10): 2035-2041.
Effects of Plant Growth Promoting Rhizobacteria on Plants Heavy Metal Uptake and Transport: A Review
GUO Junkang1*, DONG Mingfang1, 3, DING Yongzhen2, FENG Renwei1, WANG Ruigang1, XU Yingming1
1. Innovation Team of Remediation for Heavy Metal Contaminated Farmland of Chinese Academic of Agricultural Sciences, Institute of Agro-Environmental Protection, Ministry of Agriculture, Tianjin 300191, China; 2. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China; 3. Department of Agriculture, Guangxi University, Nanning 530003, China
Abstract:Given that soil pollution heavy metals is a major threat to ecological environment and human well-being. The remediation of heavy metals polluted soils is a hot topic of global concern being vigorously studied these days. This paper presents a review of the current research of the plant growth promoting rhizobacteria (PGPR), which are known to play a particular vital role in rhizosphere heavy metals uptake and translocation of plants. The rhizosphere soil harbored a wide variety of microorganisms that are key factors dominating the rhizosphere environment. As known, the rhizosphere provides a complex and dynamic microenvironment where microorganism in metal contaminated soils, in association with the surroundings of plant roots and rhizosphere soil. The PGPG have been shown to possess several characteristics that can alter heavy metal bioavailability, through releasing of plant growth hormones, and thus accentuating heavy metals uptake in plants, eventually resulting in the improvement of phytoremediation efficiency for heavy metal contaminated soil. To date, there has been a boom in numbers of studies that focus on the reinforcement of phytoremediation efficiency involved in the heavy metals tolerant PGPR. Latest studies show that the PGPG could enhance agricultural yields with preventing the upward transport of metal ions to the above ground parts of plants or crops via several mechanism such as, accelerating the metal absorption onto cell rhizobacteria cell wall active and functional groups, inducing plant systemic resistance (ISR), triggering the antioxidant enzymes activity, secreting high affinity iron carrier termed Siderophores into rhizosphere, competitively inhibiting the heavy metal uptake by roots, and modifying the processes of absorption, transportation and intracellular distribution of metal ions. This review provides new progresses about the mechanisms possessed by PGPR that ameliorate heavy metal stress of plants and how the Cd accumulation reduced by the inoculants. Furthermore, the studies of PGPR highlight suit colonization, subcellular distribution and the molecular mechanism of heavy metal uptake and transportation will help to clarify the PGPR-plant interaction mechanism. The conclusion of this review highlight a new insight into the exploration of PGPR on heavy metal contaminated soil crops safety production and remediation.
Key words:plant growth promoting rhizobacteria (PGPR); heavy metal; uptake; transportation; soil contamination remediation
收稿日期:2015-03-24
作者简介:郭军康(1980年生),男,助理研究员,博士,主要从事重金属污染植物-微生物联合修复研究。E-mail: frankerry@163.com
基金项目:中央级公益性科研院所基本科研业务费专项资金(农业部环境保护科研监测所);国家自然科学基金项目(41001191;41473115);天津市自然科学基金项目(12JCYBJC14900)
中图分类号:X17
文献标志码:A
文章编号:1674-5906(2015)07-1228-07
DOI:10.16258/j.cnki.1674-5906.2015.07.023
