不同类型河滨湿地甲烷和二氧化碳排放初步研究
2015-03-12沙晨燕谭娟王卿王敏
沙晨燕,谭娟,王卿,王敏
上海市环境科学研究院,上海 200233
不同类型河滨湿地甲烷和二氧化碳排放初步研究
沙晨燕,谭娟,王卿,王敏*
上海市环境科学研究院,上海 200233
摘要:湿地生态系统在全球碳循环中起着重要作用。湿地在低氧环境中促进碳累积的同时产出温室气体——甲烷(CH4)和二氧化碳(CO2),湿地的碳源和碳汇功能近来成为全球气候变化研究关注的重点问题。对于保护和修复湿地等生态工程措施与湿地温室气体排放量之间的关系还不明确。运用了静态箱-气相色谱法,对Olentangy河湿地研究中心的4种不同类型河滨湿地(人工种植人工湿地、自然演替人工湿地、半人工湿地和自然湿地)甲烷(CH4)和二氧化碳(CO2)排放时空规律进行了研究,探讨了湿地土壤温度、水文条件等环境因子对CH4、CO2排放的影响。结果表明,不同类型河滨湿地的CH4和CO2排放量具有显著的时空异质性,甲烷排放速率(中值)为:自然湿地(CH4-C 0.33~85.7 mg·m-2·h-1)>人工湿地(CH4-C 0.02~20.5 mg·m-2·h-1)>半人工湿地(CH4-C -0.04~0.09 mg·m-2·h-1)。CO2排放通量的中值(平均值)分别为9.8(19.2)、13.5 (20.6)、24.7(36.0)和33.7(40.3)CO2-C mg·m-2·h-1。在湿地1、湿地2和河道边湿地中的CH4排放量与土壤温度显著性相关,相关系数分别为0.88、0.86和0.85;湿地1、湿地2和牛轭湖湿地CO2通量与土壤温度相关性显著,相关系数分别为0.63、0.54和0.67。土壤含水率与甲烷排放量具有一定的相关性;与二氧化碳排放通量具有显著负相关性。土壤碳含量与其相应的CH4和CO2排放量之间关联度都较高。在同一区域淡水河滨湿地中,自然湿地的CH4和CO2排放通量均大于恢复湿地,CH4和CO2排放的空间异质性是由于洪水冲击频率、土壤状况、地下水位及净初级生产力等因素决定的。
关键词:CH4排放;CO2排放;河滨湿地
引用格式:沙晨燕,谭娟,王卿,王敏. 不同类型河滨湿地甲烷和二氧化碳排放初步研究[J]. 生态环境学报, 2015, 24(7): 1182-1190.
SHA Chenyan, TAN Juan, WANG Qing, WANG Min. Methane and Carbon Dioxide Emissions from Different Types of Riparian Wetland [J]. Ecology and Environmental Sciences, 2015, 24(7): 1182-1190.
碳是全球气候变化的重要影响因素之一,大气圈中主要以CO2和CH4的形式存在。其中,作为主要温室气体的甲烷对全球气候变暖的贡献率达到了20%~39%(IPCC,2007)。大气中的CH4含量已从工业革命前(1750年)的0.72 μmol·mol-1上升到了2012年的1.82 μmol·mol-1,提高到约2.5倍(IPCC,2014)。CO2浓度从工业革命前的280×10-6增加到现在的393×10-6(IPCC,2014)。
湿地在低氧环境中促进碳累积的同时产出温室气体——CH4和CO2,湿地的碳源和碳汇功能近来成为全球气候变化研究关注的重点问题。河滨湿地有着较高的初级生产力,从而固定和储存了大量的碳,在全球气候变化中有着特殊的地位和作用(Mander et al.,2008)。随着人类活动加剧,自然河滨湿地遭到破坏,从而导致土壤通透性、温度、氧化还原电位等理化性质的改变,造成了河滨湿地成为碳排放的热点(Zhang et al.,2005;Mitsch et al.,2013)。因此,新建和修复河滨湿地的建造与管理中,在考虑保护恢复湿地的生态系统服务功能同时,也应考虑如何减小温室气体排放(Whiting et al.,2001)。
CH4和CO2的排放通量具有较高的时空异质性,量化其排放量十分困难(Morin et al.,2014;Nahlik et al.,2011)。已有研究报道了河滨湿地(Altor et al.,2006,2008;Wang et al.,2006;Itoh et al.,2007;Wilcock et al.,2008)和污水处理的人工湿地(Teiter et al.,2005;Wang et al.,2008)的CH4和CO2排放情况。然而,对于保护和修复湿地等生态工程措施与湿地温室气体排放量之间的关系尚不明确。本文以河滨地区不同类型的自然、半人工和人工河滨湿地为研究对象,尝试在不同的水文模式和植被生长状况下,研究不同湿地类型的CH4和CO2的时空排放规律及对比,探讨影响CH4和CO2排放量的主要因子及其可能的调控途径,并以此提出了针对湿地碳排放的河滨恢复湿地建造与管理建议和措施。
1 材料与方法
1.1样点设计
1.1.1研究区域概况
研究区域位于美国俄亥俄州哥伦布市Olentangy河湿地研究中心(ORWRP)(40.021°N,83.017°E)。占地20 hm2的ORWRP包括了4种不同类型的湿地:人工种植植被的肾形淡水草泽(湿地1)、自然生长植被的肾形淡水草泽(湿地2)、河流分岔半人工牛轭湖(牛轭湖)、自然河道旁低洼湿地(河道旁湿地)和高地(作为控制对照样点)(表1)。4类湿地在微地形地貌、植被类型及水文状况上都有所不同。人工草泽、半人工牛轭湖和自然河道旁湿地水文情况的波动都反映了Olentangy河河水水位季节性的涨落。在生长季节,4种不同类型湿地的水位下降,并在8月份达到最低值,之后再次上涨,并且在冬季和春季的时候水位达到最高。其中,牛轭湖在5月份之后几乎干涸,仅仅有少量的水塘散落在其中。
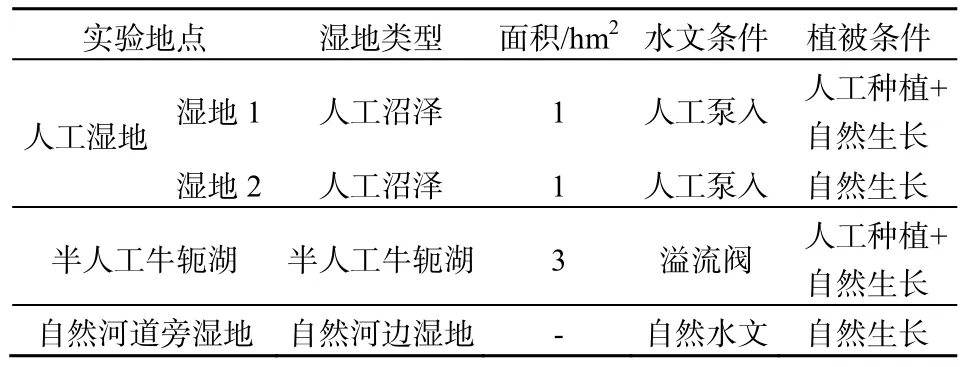
表1 Olentangy河湿地研究中心不同类型湿地的性质Table1 Introduction of different types of wetland in Olentangy River Wetland Research Park
1.1.2实验设计
ORWRP采样点的位置是依据水文条件和湿地类型的不同而选取的。采样点选择纵向(入口、中部至出口)和横向(深水区至浅水区)分布。其中深水区为常年淹没区域,浅水区是干湿交错区域,高地常年处于干燥状态,本文将高地作为控制对照点。研究区域中共设置有27个采样点:其中实验湿地1和湿地2中有14个采样点,每个湿地各7个;牛轭湖湿地中有7个;河道边湿地中有6个(图1)。采样期为2008年11月至2009年10月。
1.2气样采集及分析
1.2.1气样采集
采用静态箱进行气体采样:在干湿交错地带使用永久性气体采集箱,明水面即淹没区则使用浮力气体采集箱。
永久性气体采集箱:采样箱分顶箱和底座,箱体用底面积0.15 m2的长方体塑料箱体(56 L)。为了释放箱体中采样时的压力,顶部附有2 m长的聚乙烯出气软管,直径为1.6 mm。同时,在出气软管旁边装有丁基胶塞供采样使用。底座高20 cm,为避免土壤扰动对试验的影响,底座长期埋入试验地,一般埋入深度为10 cm。试验开始时,使用聚乙烯泡沫密封条连接两箱,使其气路密封。
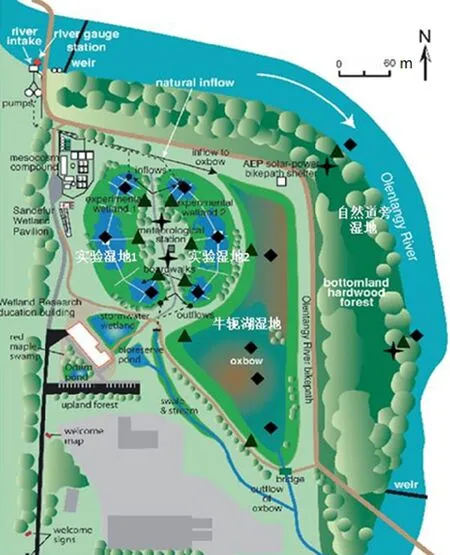
图1 占地20 hm2 Olentangy河湿地研究中心(ORWRP)实验区域实验湿地1,湿地2,半人工牛轭湖和自然道旁湿地黑色标记代表CH4采样点在实验区的分布。各湿地的水流自北向南。其中菱形代表了深水区的采样点,三角形代表了浅水区的采样点,而十字星代表了高地(控制点)的采样点Fig. 1 Gas- sampling chamber sites (circles) in experimental wetlands 1 and 2, oxbow and riverside sites at the 20 hm2Olentangy River Wetland Research Park (ORWRP), with water moving from north to south. Diamond shape marks correspond to open water zone, triangle shape marks correspond to transition zone, cross shape marks correspond to upland locations
浮力气体采集箱:同样的采样箱体使用于浮力箱上(56 L,底部面积为0.21 m2),底部四周边缘使用浮力泡沫塑料,并且使用防水密封胶带进行防水处理。
2008年11月至2009年10月,每月月初进行采样。为减少采样时间所造成的偏差,所有的采样时间起始于早上9点,至11点完成。用20 mL聚乙烯医用注射器,经过三通阀连接针头,通过采样箱顶部的丁基胶塞取样。在气箱关闭后进行采样,一共持续25 min,每隔5 min进样一次,分别在0 min (T0)、5 min(T1)、10 min(T2)、15 min(T3)、20 min(T4)和25 min(T5)时进行。气体样本用注射器取出后,转移入10 mL真空采样瓶保存。气样置于4 ℃的冷藏室内储存,28 d之内用气相色谱仪分析气体浓度。
1.2.2气样分析
使用Schimadzu 14A(日本岛津公司)气相色谱仪(GC)分析CH4浓度。采用温度传导探头和火焰离子检测器,聚苯乙烯型色谱固定相Q色谱柱进行样品分离,色谱柱采用长度为1.8 m,载气为高纯氦气,流速为25 mL·min-1。炉箱和检测器TCD 和FID的工作温度分别为40 ℃、40 ℃,200 ℃和150 ℃。
GC得到的结果需要转化成ppm为单位,使用理想气体定律进行校正:
m=c×(P×M/R×T)
其中,m为单位质量量下气体浓度(CH4g·m-3),c为单位体积下气体体积分数(×10-6),P为采样点的大气压,M为被测气体的摩尔质量(g·mol-1),R为宇宙气体恒量(82.0575(atm-cm3)/(mol-K)),T为每个采样箱内气体的绝对温度。
气体通量使用以下公式进行校正:
Fme=[V×(dm/dt)×1000/A]×12/16
其中,Fme为气体排放速率(CH4-C mg·m-2·h-1和CO2-C mg·m-2·h-1),V为气箱体积(m3),A为采样箱箱底表面积(m2),dm/dt为在一定时间内气体浓度随时间变化斜率(CH4g·m-3·h-1和CO2g·m-3·h-1)。
1.3环境因子测定
1.3.1温度测定
测量空气温度,5 cm和15 cm土壤温度,水体温度和采样箱内温度。
1.3.2土壤采样及分析
每个样地随机取3个表层土壤样品,现场称鲜质量后,在105 ℃条件下烘干24 h并称干质量,利用干质量和鲜质量求出土壤含水率。所有的土壤样品的分析测试,使用标准方法在爱沙尼亚大学生命科学学院的植物生物化学实验室进行测量(APHA,1989)。使用干式燃烧法(Dc)对土壤碳含量进行分析,分析仪器为Vario EL Ⅲ操作仪。土壤中的凯氏N测量使用Tecator分析仪。
1.3.3水文条件测定
每日对实验湿地出口处的水位标杆读数。标杆水位月平均值与每次采样时所记录的水位高度有显著相关性(r2>0.8,P<0.006),实验使用的采样点的水位为采样箱旁边的水位高度。
1.4数据分析
经检验CH4和CO2排放量数据不符合正态分布特征,因此,本文使用非参数统计方法。使用Kruskal-Wallis和Mann-Whitney法比较不同季节下,不同水位条件下,不同类型湿地中CH4、CO2的排放通量。所有的CH4、CO2排放量的数据运用平均值和中值。水文和净初级生产力等环境数据的对比使用T-tests进行相关分析(SPSS 16.0)。所有的显著性差异小于0.05。

图2 ORWRP中各类型湿地的CH4排放量(CH4-C mg·m-2·h-1)中值为实线,平均值为虚线;圆点代表极大值和极小值;灰色箱体代表四分位间距Fig. 2 Median (—) and mean (---) annual methane emissions (CH4-C mg·m-2·h-1) for (a) growing season from five different wetland and upland sites at the ORWRP; (b) non-growing season from five sites at the ORWRP. Boxes indicate 25% percentiles and bars indicate 75% percentiles; dots indicate outliers
2 结果
2.1生长季节及非生长季节的CH4和CO2排放通量
2.1.1生长季节及非生长季节的CH4排放通量
在生长季节,河道边湿地、湿地1、湿地2、牛轭湖和高地的CH4排放量之间有显著性差异(P<0.001)(图2a)。河道边湿地中CH4排放量的中值和平均值分别为CH4-C 69.8 mg·m-2·h-1和CH4-C 93.6 mg·m-2·h-1。湿地2的CH4排放量大于湿地1,但是并无显著差异(P>0.05)。湿地1和2的中值(平均值)为CH4-C 1.0(13.5)mg·m-2·h-1和 CH4-C 3.4 (21.5)mg·m-2·h-1。牛轭湖CH4的排放量仅为CH4-C 0.03(0.15)mg·m-2·h-1。高地的CH4吸收量为CH4-C 0.06(0.06)mg·m-2·h-1。
在非生长季节,CH4的排放通量较生长季节显著降低(P<0.001),但其空间排放模式相似(图2b)。河道边湿地中仍然排放出最多的CH4气体,中值(平均值)为4.5(22.1)CH4-C mg·m-2·h-1,与湿地1和湿地2的CH4排放相比较并无显著性差异(P>0.05)。牛轭湖和高地的CH4排放量差异性不显著(P>0.05),其中值(平均值)分别为CH4-C 0.02 (0.01)mg·m-2·h-1和CH4-C -0.04(0.02)mg·m-2·h-1。
2.1.2生长季节及非生长季节的CO2排放通量
在生长季节,河道边湿地、湿地1、湿地2、牛轭湖和高地的CO2排放量之间有显著性差异(P<0.001)(图3a)。河道边湿地中的CO2排放量的平均值和中值分别为CO2-C 45.1 mg·m-2·h-1和CO2-C 37.7 mg·m-2·h-1。湿地2的CH4排放量大于湿地1,但是并没有显著差异(P>0.05)。湿地1和2的平均值(中值)为CO2-C 28.2(22.3)mg·m-2·h-1和CO2-C 30.7(27.3)mg·m-2·h-1。牛轭湖的CO2排放量为CO2-C 63.0(47.9)mg·m-2·h-1。高地的CO2排放量最高,为CO2-C 187.5(153.5)mg·m-2·h-1。CO2排放通量的排序为牛轭湖湿地>自然河滨湿地>人工实验湿地。
在非生长季节,CO2的排放通量较生长季节显著降低(P<0.001)(图3b)。河道边湿地中CO2排放通量的平均值(中值)为CO2-C 35.2(34.0)mg·m-2·h-1。然而与湿地1和湿地2 CO2排放相比较,仍无显著性差异(P>0.05)。人工实验湿地和自然河道边湿地的CO2排放量差异性不显著(P>0.05),CO2排放通量的平均值(中值)分别为CO2-C 10.0 (6.4)mg·m-2·h-1和CO2-C 10.6(7.7)mg·m-2·h-1。牛轭湖的CO2排放通量的平均值(中值)相对其它类型湿地较高,为CO2-C 63.0(47.9)mg·m-2·h-1(P<0.005)。与生长季节相同,控制点高地的CO2排放量最高,为CO2-C 86.7(67.9)mg·m-2·h-1。在非生长季节CO2的排放通量排序为自然河滨湿地>牛轭湖湿地>人工实验湿地。

图3 ORWRP中各类型湿地的CO2排放量(CO2-C mg·m-2·h-1)中值为实线,平均值为虚线;圆点代表极大值和极小值;灰色箱体代表四分位间距Fig. 3 Median (—) and mean (---) annual carbon dioxide emissions (mg CO2-C·m-2·h-1) for (a) growing season from five different wetland and upland sites at the ORWRP; (b) non-growing season from five sites at the ORWRP. Boxes indicate 25% percentiles and bars indicate 75% percentiles; dots indicate outliers
2.2不同类型湿地中CH4和CO2排放通量及其相应的环境因子
土壤温度在不同类型湿地之间并无显著性差异(P>0.05),湿地1、湿地2、牛轭湖和河道边湿地的土壤温度分别为(16.3±1.5)、(15.4±1.5)、(16.8±1.1)和(17.7±1.6) ℃,河道边湿地的土壤温度最高,而湿地2的土壤温度最低,这可能是由于湿地2植被覆盖较密,具有遮荫效果。空气温度在不同类型湿地间同样无显著差异(P>0.05),并且空气温度和土壤温度有着显著相关性(P<0.001)。对于全年而言,河道边湿地的CH4排放通量是4类湿地中最高的,其次是实验湿地1、湿地2、牛轭湖湿地。其中河滨自然湿地、人工湿地和半人工湿地的CH4排放通量中值的范围分别为CH4-C 0.33~85.7 mg·m-2·h-1,CH4-C 0.02~20.5 mg·m-2·h-1和CH4-C -0.04~0.09 mg·m-2·h-1(P<0.001)。相比而言,不同湿地类型的CO2排放通量差异没有CH4排放通量异质性高。其中,自然湿地、半人工湿地、人工湿地1和湿地2的CO2排放通量中值的范围分别为CO2-C 18.8~78.8 mg·m-2·h-1、CO2-C -12.8~132.9 mg·m-2·h-1、CO2-C -13.3~44.1 mg·m-2·h-1和CO2-C -8.9~51.6 mg·m-2·h-1(P<0.001)(表2)。
在人工实验湿地中,湿地的水位和水文波动频率影响了CH4排放速率,深水区中CH4排放量的中值(平均值)显著高于交错区的CH4排放量(P<0.001),分别为4.7(59.9)mg·m-2·h-1和0.09(1.17)mg·m-2·h-1。对于牛轭湖来说,深水区和交错区CH4排放量差异不显著(P>0.05),排放量总体比较低,分别为CH4-C 0.03(0.06)mg·m-2·h-1和0.03(0.12)mg·m-2·h-1。河道边的深水区和交错区的CH4排放量分别为34.1(64.9)mg·m-2·h-1和CH4-C 10.4(51.3)mg·m-2·h-1,交错区的CH4排放量仅仅为深水区的30.5%。人工实验湿地、自然河道旁及牛轭湖湿地中由于常年积水深水区的采样点的水位高度显著高于干湿交错区(P<0.001),因此湿地的水位也影响了CO2排放速率。在人工实验湿地中,交错区的CO2排放量的中值(平均值)显著高于深水区中的CO2排放量(P<0.001),分别为CO2-C 41.8(53.7)mg·m-2·h-1和CO2-C -2.2(-10.6)mg·m-2·h-1。工牛轭湖湿地CO2的不同水位条件的排放模式与人工湿地相同(P<0.001),分别为CO2-C 15.5(20.9)mg·m-2·h-1和CO2-C 38.7(63.1)mg·m-2·h-1。自然河滨湿地交错区的CO2排放量的中值(平均值)同样也显著高于深水区中的CO2排放量(P<0.001)。河道边湿地的交错区和深水区的CO2排放量分别为CO2-C 16.6 (15.2)mg·m-2·h-1和CO2-C 53.4(70.2)mg·m-2·h-1。
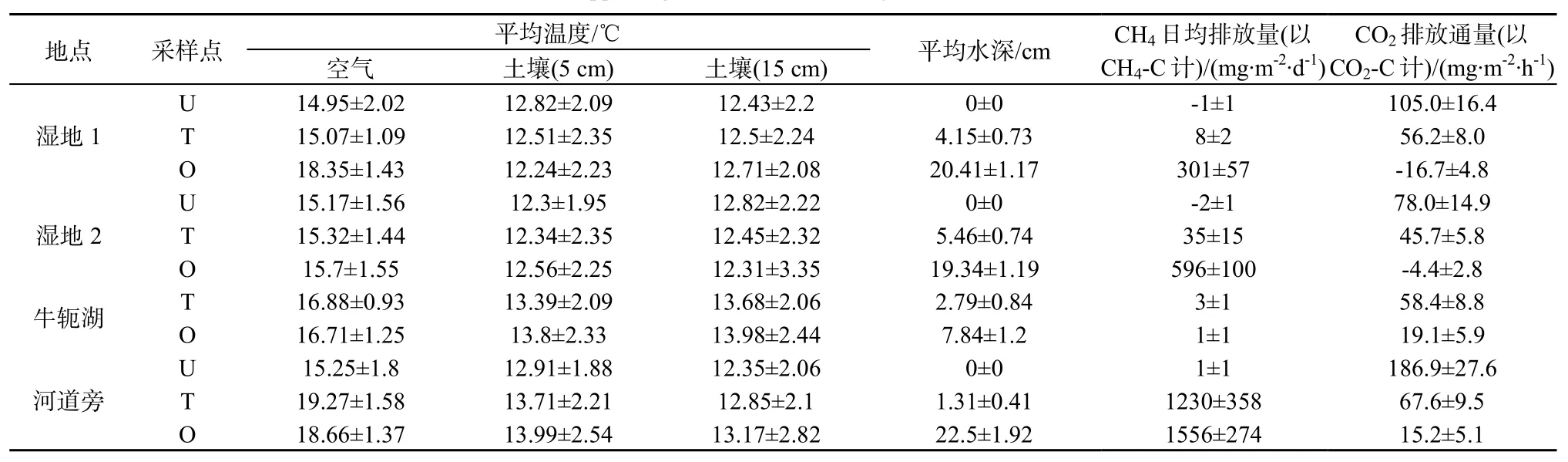
表2 湿地1、湿地2、牛轭湖和河道旁CH4和CO2排放量及其环境因子数据Table 2 Methane and carbon dioxide emissions and supporting environmental data by four wetland sites(Wetland 1, Wetland 2, Oxbow and Riverside)
2.2.1土壤含水率与CH4和CO2排放通量的相关性
4种不同类型湿地的土壤含水率为:湿地1和湿地2>河道边湿地>牛轭湖湿地。不同水文条件区域中土壤含水率为:深水区>交错区>高地。并且,可以从本实验的土壤含水率及CH4排放量的相关性中发现,土壤含水率的相关系数虽然不高,但是有一定的相关性(r2=0.39)。实验的土壤含水率及CO2排放量的相关性中发现,土壤含水率与不同类型湿地中CO2通量具有一定的相关性(r2=0.72),但其成反比相关,即土壤含水率越高,CO2释放量越少。
2.2.2土壤温度与CH4和CO2排放通量的相关性
土壤温度在4类湿地中无显著性差异。在生长季节和非生长季节,土壤的平均温度分别为(19.6±3.1)和(6.4±4.9) ℃。在湿地1、湿地2和河道边湿地,CH4排放量与土壤温度显著性相关,相关系数分别为r2=0.88,r2=0.86和r2=0.85(图4)。不过在牛轭湖地区,CH4排放与土壤温度没有显著相关性。在湿地1、湿地2和牛轭湖湿地,CO2排放量与土壤温度有一定相关性,相关系数分别为r2=0.63,r2=0.54和r2=0.67(图5)。不过在自然河道边区域,CO2排放与土壤温度没有显著相关性。

3 讨论
3.1河滨湿地碳排放通量
3.1.1不同类型河滨湿地CH4排放通量的差异
湿地生态系统中CH4排放量的差异可能是由于环境因子的空间异质性,例如沉积物结构、大型植被分布、营养物质供给和土壤供养程度等(Herbst et al.,2013)。本研究中,Olentangy河河道低洼湿地和不同类型的河滨补偿湿地有着非常高的CH4排放空间异质性。相关文献也有相似的研究结果,在若尔盖高原湿地生长季节,CH4排放有较大的空间变异,湖滨湿地CH4平均排放量为CH4-C 11.95 mg·m-2·h-1,其次为宽谷湿地,排放量为CH4-C 2.12 mg·m-2·h-1;河岸湿地表现为CH4吸收,其吸收量为CH4-C 0.007 mg·m-2·h-1(陈槐等,2008)。Hirota et al. (2004)在青藏高原的不同优势种湿地中的研究显示了以眼子菜属(Potamogeton spp.)为优势种的湿地CH4排放通量为33.1 mg·m-2·d-1,藨草(Scirpus spp.)湿地CH4通量为99.5 mg·m-2·d-1,苔草(Carex spp.)湿地CH4通量为196 mg·m-2·d-1。在日本的一个处理废水的人工湿地中,CH4排放数据也显示了较大的时空差异,为CH40~16.76 g·m-2·d-1(Wang et al.,2008);在爱沙尼亚的两种不同类型的废水处理微型人工湿地,即水平式潜流人工湿地(HSSF)和垂直式潜流人工湿地(VSSF)中,CH4的排放量分别为CH4-C 31~12100 μg·m-2·h-1和CH4-C 950~5750 μg·m-2·h-1(Mander et al.,2005)。而且上述提到的地理特征与其地表水位也密切相关。在德国西南部的研究发现湖滨湿地CH4排放是宽谷湿地的5.5倍,其地表水位要比宽谷湿地高出10 cm左右(Sommer et al.,2002)。在丹麦北方湖泊湖岸边的明水区,随着水文的波动,CH4排放量为CH420~50 g·m-2·y-1(Kankaala et al.,2004)。Olentangy河河滨淡水湿地CH4排放量是从CH4-C 68~379 g·m-2·y-1,这个范围也与其它的淡水湿地相一致。在内蒙古有机草泽中,其CH4排放通量非常高,为CH4189~663 g·m-2·y-1(Wang et al.,2006)。Whiting et al.(2001)报道弗吉尼亚州和福罗里达州湿地的CH4排放通量分别为CH4-C 62和107 g·m-2·y-1。在亚马逊河洪泛平原中,水位较低时,CH4的排放量为CH425 g·m-2·y-1;而水位较高时,CH4的排放量为CH467 g·m-2·y-1(Richey et al.,1990)。在本实验俄亥俄州中部的实验湿地中,我们也监测到了相似的深水区CH4排放量较高,而边缘区CH4排放量较少这样的模式。
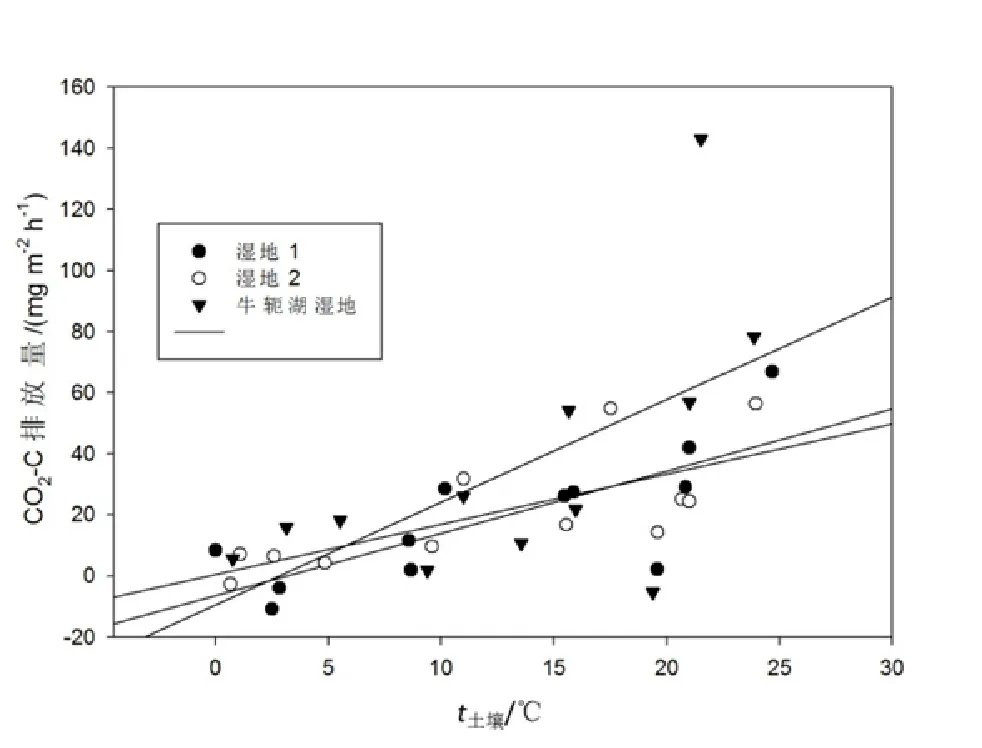
图5 实验湿地1和湿地2CO2排放量(CO2-C mg·m-2·h-1)与土壤温度的关系Fig. 5 Relationships between methane flux rates and mean soil temperature for two experimental wetlands (wetland 1 and 2) and riverside site at Olentangy River Wetland Research Park
3.1.2不同类型河滨湿地CO2排放通量的差异
湿地生态系统的CO2通量具有极强的时空变异性。在时间尺度上不仅有明显的季节变化,而且在一天之内的波动幅度也很剧烈。土壤CO2通量的异质性与诸多因子相关。不同群落类型的植被组成、气象条件和土壤环境因子的不一致性可导致土壤CO2通量的不同。本研究中所测得的CO2排放速率情况如下:自然湿地、半人工湿地、人工湿地1和湿地2的CO2排放通量中值的范围分别为CO2-C 13.1~53.5 mg·m-2·h-1、CO2-C -0.7~132.9 mg·m-2·h-1、CO2-C -13.3~44.1 mg·m-2·h-1和CO2-C -8.9~51.6 mg·m-2·h-1。由于本研究中不同类型的湿地处于同一区域中,因此气候状况和土壤温度基本相同,可能是由于不同的水位条件以及植物分布的不同而影响了不同类型湿地中CO2排放差异。有关研究也有相似的观点,郝庆菊等(2004)从8月中旬至10月对三江平原上3种不同类型湿地进行CO2排放的观测,CO2排放速率表现为小叶樟草甸(CO2384.9 mg·m-2·h-1)>恢复湿地(CO2384.9 mg·m-2·h-1)>漂筏苔草沼泽(CO2117.6 mg·m-2·h-1),并认为水文条件以及由水文环境引起的土壤温度是影响不同类型湿地土壤CO2呼吸速率差异的重要因素。Teiter et al.(2005)分别对河滨缓冲带上的水平式潜流人工湿地(HSSF)和垂直式潜流人工湿地(VSSF)的CO2排放速率进行了测量,并得出了HSSF的CO2排放速率(CO2140~291 mg·m-2·h-1)大于VSSF(CO261~140 mg·m-2·h-1),认为可能是由于这两种人工湿地中不同的植物配置导致了CO2排放通量的差异。
3.2环境因子对CH4排放量的影响
3.2.1水文对CH4排放量的影响
水文过程调节了电子受体和供体之间的运动状态,并在湿地的地球生物化学循环中起到重要的作用(Mitsch et al.,2007)。在湿地1和湿地2中深水区比起交错区的CH4排放量更高,这是由于深水区中土壤含氧量的减少,导致在缺氧和土壤还原的条件下,产CH4菌活性增强,CH4排放量增大(Kumaraswamy et al.,2001)。对于牛轭湖湿地,在深水区和交错区中CH4排放量没有显著性差异,这可能是由于牛轭湖中独特的季节性水文渐变情况。冬季和春季较高的水位及其洪水冲击频率导致深水区和交错区的水深显著不同,但是较低的土壤温度使得两个区域CH4排放量都较小(Yu et al.,2008)。当夏季和秋季温度升高,蒸发量加大的时候,地表水位退去,导致深水区和交错区有着相似的水位条件,并且由于季节性的干旱,深水区和交错区仍然没有较大的CH4排放量的差异。在河道边低洼湿地,尽管交错区的CH4排放量低于深水区,但是差异性不显著。交错区中,相对于同一地区其它类型湿地较高的CH4排放量,可能部分由于水文作用下土壤中净有机碳的输入,部分由于地下水加上地表径流的作用,将营养物质输入到Olentangy河的边缘地带(Striegl et al.,1998;Fahey et al.,2005)。本实验结果得出的土壤含水率与CH4排放量有一定的相关性。徐华等(2008)对我国水稻田CH4产生的培养实验发现,在同样的培养温度下,CH4的产生率随着水分含量的增加而增加。在江苏无锡安镇和江西鹰潭的水稻土壤,当水分条件从田间持水量的20%~35%增加到田间持水量的107%时,CH4产生率分别提高了约9倍和5倍。
3.2.2土壤温度对CH4排放量的影响
温度在CH4产生和排放中起着非常重要的作用,土壤温度不仅直接影响土壤微生物的活动,而且对土壤中CH4的输送也有明显影响(丁维新等,2003)。湿地类型不同,温度对土壤CH4排放的影响也不同。在永久积水或季节性积水湿地中,例如本文中的河道边和实验湿地1、2,地表长期保持过湿状态,因而土壤为厌氧环境,有利于CH4的生成,CH4的产生过程对温度非常敏感。然而对于牛轭湖湿地来说,在温度较高的季节,地表无积水但保持较为湿润的状态,因而这种环境有利于CH4的氧化吸收,水文的作用掩盖了温度对CH4排放的影响。相比之下,CH4消耗作用对温度较不敏感(宋长春等,2003)。
本文的研究中,5月至9月温度相对较高的时期,CH4排放量也是最高的。湿地1、湿地2和河道边湿地显示了相似的CH4排放季节动态变化,夏季CH4排放量分别比冬季高了18倍、23倍和18倍。牛轭湖的CH4排放季节波动较小。CH4排放所显示出的季节波动与之前在同一湿地(Altor et al.,2006,2008)和其它淡水生态系统的研究结果相符(Koch et al.,2007;Chen et al.,2008)。产CH4菌的活动能力经研究随着温度、电子接收能力、营养盐供应或者几个因素的综合效应的变化而不同(Stadmark et al.,2005),并且这些环境因子的性质随着季节而波动(Bubier et al.,2005)。本研究中湿地1、湿地2和河道边湿地的土壤Q10值通过方程式计算分别为1.25、1.25和1.06(Reichman et al.,1986)。Q10值符合Arrehenius方程中不同水饱和土壤环境下的较低数值区域(Chapman et al.,1996)。CH4排放量与沉积物中温度显著性相关已经在文献中详细阐述过(Koch et al.,2007;Chen et al.,2008;Koh et al.,2009)。相对较高的夏季温度不仅能够提高产CH4菌的活动能力,而且由于快速的氧气消耗而影响到氧化菌的活动能力,因此温度升高可提高CH4排放量(Ding et al.,2004)。Kankaala et al. (2004)报道过随着季节的不同,CH4的排放与植被生物量密切相关。夏季时,较高的植被生物量影响到CH4的排放,因为植物由于根部腐烂和分泌物所产生的有机物质对产CH4菌来说可作为营养基质(Rinnan et al.,2003)。而且植物也可作为CH4从土壤向大气中排放的导管(Wassmann et al.,2000)。一般认为,CH4氧化和CH4产生的最佳温度是25 ℃(Dunfield et al.,1993)。低温限制CH4产生的主要原因是降低了产H2细菌的活性而不是因为对产CH4菌的影响(Conrad et al.,2002)。Saarnio et al. (1998)认为,低温限制了根系分泌物等的分解,从而抑制了CH4的产生和排放。
3.3环境因子对CO2排放量的影响
3.3.1土壤温度对CO2通量的影响
研究区域不同类型河滨湿地CO2通量在生长季节明显高于非生长季节(P<0.001)。从土壤中释放的CO2的85%~90%来源于土壤微生物的生命活动,约15%来源于植物根的呼吸(郝庆菊等,2004),并且其呼吸强度与温度密切相关。因此,温度的升高可促进土壤中储存的大量碳的分解,土壤呼吸在水位较低情况下随着温度升高而有显著的升高,高水位地带却抑制微生物活性(Moore et al.,1989)。本文相关分析表明,CO2通量的季节变化受到了土壤温度的影响,二者呈正相关关系(图5),湿地1、湿地2和牛轭湖湿地CO2通量与土壤温度相关性显著,相关系数分别为0.63、0.54和0.67。有可能是因为湿地植物多为浅根系,其根系主要分布在土壤上层,凋落物的分解主要在此层进行。这与王德宣等(2008)对诺尔盖高原地区的研究结果一致。三江平原湿地土壤CO2排放速率与土壤温度关系密切,几乎所有的土壤温度与土壤CO2排放速率均为显著相关,并且绝大部分都达到了极显著水平(郝庆菊等,2004)。
3.3.2水分对CO2通量的影响
在本研究中,牛轭湖湿地由于夏季长期暴露于空气中,土壤通透性较好,而且相比于河道边自然湿地地势较高。有研究认为,较低的水位和较干的土壤状况会增加有机质的分解,可能提高CO2通量。Freeman et al.(2002)也指出CO2通量与水位高度有显著的负相关(r2=0.921)。本文中的牛轭湖湿地年平均水位在Olentangy河河滨不同类型湿地中最低(表2)。从理论上讲,这样的恢复湿地应比水位高的河道边自然湿地更有利于CO2的产生和排放,但测定结果CO2排放速率的中值(平均值)低于自然河道边湿地,原因可能与恢复湿地土壤有机质及土壤营养元素的含量较低有关。而对于两个肾形人工湿地来说,其CO2排放速率分别为CO2-C 9.8 (19.2)mg·m-2·h-1和13.5(20.6)mg·m-2·h-1,CO2排放量显著小于自然河道旁湿地和半人工湿地,可能是由于在生长季节人工湿地深水区的藻类进行光合作用,导致在深水区对CO2有吸收作用;另一种原因可能是人工湿地相对于自然湿地较低的土壤碳含量而导致排放量减少。Koh et al.(2009)对3种不同类型湿地进行了CO2排放的研究,在干地的CO2排放通量为CO2180~908 mg·m-2·h-1,为季节性积水湿地的3~4倍,而在永久性积水地区的CO2排放量为CO267~472 mg·m-2·h-1。
4 结论
本文研究显示在同一河滨区域中,自然河流要比人工和半人工河滨恢复湿地排放更多的CH4和CO2。不同类型湿地CH4和CO2排放的空间异质性是由于洪水冲击频率,底物中有机碳含量,地下水位及净初级生产力等环境因素所决定的。在恢复湿地的管理方面,可以通过设计种植不同种类植物的配置,既可使河滨新建实验湿地1和湿地2增加物种多样性,又可以有效地减少CH4和CO2排放;河道分岔半人工牛轭湖的CH4释放量整年保持较低状态,并且其在冰融期、洪泛期都在净化水质,成为营养物质吸收库(Fink et al.,2007;Mitsch et al.,2008),这说明了建造生态系统适合的水文条件在湿地的重建和修复项目中是关键因子之一;通过设计具有既长又浅型状和湿-干-湿交替水文条件的人工湿地,不仅可应用于其它的河流冲积平原的修复,也可在不同的气候和水文条件下检测其生态服务功能。
参考文献:
ALTOR A E, MITSCH W J. 2006. Methane flux from created riparian marshes: Relationship to intermittent versus continuous inundation and emergent macrophytes [J]. Ecological Engineering, 28(3): 224-234.
ALTOR A E, MITSCH W J. 2008. Pulsing hydrology, methane emissions, and carbon dioxide fluxes in created marshes: a 2-year ecosystem study [J]. Wetlands, 28(2): 423-438.
APHA. 1989. Standard Methods for the Examination of Water and Waste Water [M]. 17th Edition, American Public Health Organization: Washington D.C.
BUBIER J, MOORE T, SAVAGE K, et al. 2005. A comparison of methane flux in a boreal landscape between a dry and a wet year [J]. Global Biogeochemical Cycles, 19(1): 1023-1023.
CHAPMAN S J, THURLOW M. 1996. The influence of climate on CO2and CH4emissions from organic soils [J]. Agricultural and Forest Meterorology, 79(4): 205-217.
CHEN H, YAO S, WU N, et al. 2008. Determinants influencing seasonal variations of methane emissions from alpine wetlands in Zoige plateau and their implications [J]. Journal of Geophysical Research, 113: D12303.
CONRAD R. 2002. Control of microbial methane production in wetland rice fields [J]. Nutrient Cycling in Agroecosystems, 64(1-2): 59-69.
DING W X, CAI Z C, TSURUTA H. 2004. Cultivation, nitrogen fertilization, and set-aside effects on methane uptake in a drained marsh soil in Northeast China [J]. Global Change Biology, 10(10): 1801-1809.
DUNFIELD P, KNOWLES R, DUMONT R, et al. 1993. Methane production and consumption in temperate and subarctic peat soils: Response to temperature and pH [J]. Soil Biology and Biochemistry, 25(3): 321-326.
FAHEY T J, SICCAMA T G, DRISCOLL C T. 2005. The biogeochemistry of carbon at Hubbard Brook [J]. Biogeochemistry, 75(1): 109-76.
FINK D F, MITSCH W J. 2007. Hydrology and nutrient biogeochemistry in a created river diversion oxbow wetland [J]. Ecological Engineering, 30(2): 93-102.
FREEMAN C, NEVISON GB, KANG H, et a1. 2002. Contrasted effects of simulated drought on the production and oxidation of methane in a mid—Wales wetland [J]. Soil Biology and Biochemistry, 34(1): 61-67. HERBST M, FRIBORG T, SCHELDE K, et al. 2013. Climate and site management as driving factors for the atmospheric greenhouse gas exchange of a restored wetland [J]. Biogeosciences, 10(1): 39-52.
HIROTA M, TANG Y, HU Q. 2004. Methane emissions from different vegetation zones in a Qinghai-Tibetan Plateau wetland [J]. Soil Biology and Biochemistry, 36(5): 737-748.
IPCC (Intergovernmental Panel on Climate Change. 2014. Climate Change 2014: The Physical Science Basis. Contribution of Working Group to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [R]//Solomon S, Qin D, Manning M, et al. Cambridge, UK: Cambridge University Press,
Itoh M, OHTE N, KOBA K, et al. 2007. Hydrologic effects on methane dynamics in riparian wetlands in a temperate forest catchment [J]. Journal of Geophysical Research, 112, G01019.
KANKAALA P, OJALA A, KÄKI T. 2004. Temporal and spatial variation in methane emissions from a flooded transgression shore of a boreal lake [J]. Biogeochemistry, 68(3): 297-311.
KOCH O, TSCHERKO D, KANDELER E. 2007. Seasonal and diurnal net methane emissions from organic soils of the Eastern Alps, Austria: Effects of soil temperature, water balance, and plant biomass [J]. Arctic, Antarctic, and Alpine Research, 39(3): 438-448.
KOH H, OCHS C A, YU K. 2009. Hydrologic gradient and vegetation controls on CH4and CO2fluxes in a spring-fed forested wetland [J]. Hydrobiologia, 630(1): 271-286.
KUMARASWAMY T, RAMAKRISHNAN B, SETHUNATHAN N. 2001. Methane production and oxidation in an anoxic rice soil as influenced by inorganic redox species [J]. Journal of Environmental Quality, 30(6): 2195-2201.
MANDER Ü, HAYAKAWA Y, KUUSEMETS V. 2005. Purification processes, ecological functions, planning and design of riparian buffer zones in agricultural watersheds [J]. Ecological Engineering, 24(5): 421-432.
MANDER Ü, SHIRMOHAMMADI A. 2008. Transport and retention of pollutants from different production systems [J]. Boreal Environment Research, 13: 177-184.
MITSCH W J, GOSSELINK J G. 2007. Wetlands [M]. 4th ed. New York, NY, USA: John Wiley & Sons, Inc.
MITSCH W J, TEJADA J, NAHLIK A M, et al. 2008. Tropical wetlands for climate change research, water quality management and conservation education on a university campus in Costa Rica [J]. Ecological Engineering, 34(4): 276-288.
MITSCH W J, BERNAL B, NAHLIK A M, et al. 2013. Wetlands, carbon, and climate change [J]. Landscape Ecology, 28(4): 583-597.
MOORE T R, KNOWLES R. 1989. The influence of water table levels on methane and carbon dioxide emissions from peatland soils [J]. Canadian Journal of Soil Science, 69(1): 33-38.
MORIN T H, BOHRER G, NAOR-AZRIELI L, et al. 2014. The seasonal and diurnal dynamics of methane flux at a created urban wetland [J]. Ecological Engineering, 72: 74-83.
NAHLIK A M, MITSCH W J. 2011. Methane emissions from tropical freshwater wetlands located in different climatic zones in Costa Rica [J]. Global Change Biology 17(3): 1321-1334.
REICHMAN R, ROLSTONB D E. 1986. Design and performance of a dynamic gas flux chamber [J]. Journal of Environmental Quality, 31:1774-1781.
RICHEY J E, HEDGES J I, DEVOL A H, et al. 1990. Biogeochemistry of carbon in the Amazon River [J]. Limnology and Oceanography, 35(2): 352-371.
RINNAN R, IMPIÖ M, SILVOLA J, et al. 2003. Carbon dioxide and methane fluxes in boreal peatland microcosms with different vegetation cover—effects of ozone or ultraviolet-B exposure [J]. Oecologia, 137(3): 475-483.
SAARNIO S, ALM J, MARTIKAINEN PJ, et al. 1998. Effects of raised CO2on potential CH4production and oxidation in and CH4emission from a boreal mire [J]. Journal of Ecology, 86(2): 261-268.
SOMMER M, FIEDLER S. 2002. Methane emissions from wetland soils in southwest Germany [M] // Broll G, Merbach W, Pfeiffer E M. Wetlands in Central Europe: Soil Organisms. Soil Ecological Processes and Trace Gas Emissions. Springer: Heidelberg, 2002.
STADMARK J, LEONARDSON L. 2005. Emissions of greenhouse gases from ponds constructed for nitrogen removal [J]. Ecological Engineering, 25(5): 542-551.
STRIEGL R G, MICHMERHUIZEN C M. 1998. Hydrologic influence on methane and carbon dioxide dynamics at two north-central Minnesota lakes [J]. Limnology & Oceanography, 43: 1519-1529.
TEITER S, MANDER Ü. 2005. Emission of N2O, N2, CH4, and CO2from constructed wetlands for wastewater treatment and from riparian buffer zones [J]. Ecological Engineering, 25(5): 528-541.
WANG Y, INAMORI R, KONG H. 2008. Influence of plant species and wastewater strength on constructed wetland methane emissions and associated microbial populations [J]. Ecological Engineering, 32(1): 22-29.
WANG Z P, HAN G X, LI L H. 2006. Methane emission patches in riparian marshes of the inner Mongolia [J]. Atmospheric Environment, 40(28): 5528-5532.
WASSMANN R, AULAKH M S. 2000. The role of rice plants in regulating mechanisms of methane missions [J]. Biology and Fertility of Soils, 31(1): 20-29.
WHITING G J, CHANTON J P. 2001. Greenhouse carbon balance of wetlands: Methane emission versus Carbon sequestration. Tellus. Series B [J]. Chemical and Physical Meteorology, 53(5): 521-528.
YU K, FAULKNER S P, BALDWIN M J. 2008. Effect of hydrological conditions on nitrous oxide, methane, and carbon dioxide dynamics in a bottomland hardwood forest and its implication for soil carbon sequestration [J]. Global Change Biology, 14(4): 798-812.
ZHANG LI, MITSCH W J. 2005. Modelling hydrological processes in created freshwater wetlands: an integrated system approach [J]. Environmental Modelling & Software, 20(7): 935-946.
陈槐, 高永恒, 姚守平, 等. 2008. 若尔盖高原湿地甲烷排放的时空异质性[J]. 生态学报, 28(7): 3425-3437.
丁维新, 蔡祖聪. 2003. 温度对CH4产生和氧化的影响[J]. 应用生态学报, 14(4): 604-608.
郝庆菊, 王跃思, 宋长春, 等. 2004. 三江平原湿地土壤CO2和CH4排放的初步研究[J]. 农业环境科学学报, 23(5): 846-851.
宋长春, 阎白兴, 王跃思, 等. 2003. 三江平原沼泽湿地CO2和CH4通量及影响因子[J]. 科学通报, 48(23): 2473-2477.
王德宣, 宋长春, 王毅勇, 等. 2008. 若尔盖高原沼泽湿地与草地二氧化碳通量的比较[J]. 应用生态学报, 19(2): 285-289.
徐华, 蔡祖聪, 八木一行. 2008. 水稻土CH4产生潜力及其影响因素[J].土壤学报, 45(1): 98-104.
Methane and Carbon Dioxide Emissions from Different Types of Riparian Wetland
SHA Chenyan, TAN Juan, WANG Qing, WANG Min*
Shanghai Academy of Environmental Sciences, Shanghai 200233, China
Abstract:Wetlands are important ecosystems involved in global carbon cycle. Wetlands are both producers and consumers of the greenhouse gases. Controlling methane (CH4) and carbon dioxide (CO2) emissions from temperate zone wetlands created and restored for habitat replacement and water quality improvement is important. A field research by the method of static chamber-gas chromatography was conducted on the spatiotemporal pattern of methane (CH4) and carbon dioxide (CO2) from four riparian wetlands (planted and naturally colonizing experimental freshwater marshes, a river division oxbow, and the edge of a river) in the Wilma H. Schiermeier Olentangy River Wetland Research Park in Columbus, Ohio, USA, with the effects of soil temperature, hydrological condition on CH4and CO2emission approached. At ORWRP, CH4and CO2emissions varied remarkably in both temporal and spatial terms. The range of median value methane emissions: riverside (CH4-C 0.33~85.7 mg·m-2·h-1) > wetland 1 and wetland 2 (CH4-C 0.02~20.5 mg·m-2·h-1) > oxbow (CH4-C -0.04~0.09 mg·m-2·h-1); The median (average) values of CO2emission rates for wetland 1, wetland 2, oxbow and riverside were 9.8(19.2), 13.5(20.6), 24.7 (36.0) and 33.7(40.3) mg CO2-C·m-2·h-1respectively. Soil temperature had a significant relationship with CH4emissions in wetland 1 (r2=0.88), wetland 2 (r2=0.86) and riverside (r2=0.85), while the relationship was not significant between CH4emissions and soil temperature in oxbow site. Soil temperature had a significant relationship with CO2emissions in wetland 1(r2=0.63), wetland 2 (r2=0.54) and oxbow (r2=0.67) as well. There was a negative relationship between CO2emissions and soil water content in different types of wetlands (r2=0.72). Nature wetlands have the higher CH4and CO2emission rates than created wetlands in river riparian zone here. Overall, our results showed that the edge of a river in a bottomland hardwood forest had the much higher CH4and CO2emissions than did created river diversion marshes. The spatial variation of the different types of riverine wetlands is caused by a combination of flood frequency, sediment organic carbon content, groundwater fluxes, and wetland productivity.
Key words:methane emissions; carbon dioxide emissions; riparian wetland
收稿日期:2015-03-18
作者简介:沙晨燕(1983年生),女,工程师,博士,主要从事湿地碳循环工作。E-mail: shacy@saes.sh.cn
基金项目:国家自然科学青年基金项目(31100404)
中图分类号:X16
文献标志码:A
文章编号:1674-5906(2015)07-1182-09
DOI:10.16258/j.cnki.1674-5906.2015.07.016
