钙对花生幼苗生长、活性氧积累和光抑制程度的影响
2015-03-11孟静静孟庆伟万书波李新国
王 芳,杨 莎,郭 峰,孟静静,孟庆伟,万书波,李新国,*
1 山东农业大学生命科学学院,泰安 271018 2 山东省农业科学院生物技术研究中心和山东省作物遗传改良与生态生理重点实验室,济南 250100
钙对花生幼苗生长、活性氧积累和光抑制程度的影响
王芳1,2,杨莎2,郭峰2,孟静静2,孟庆伟1,万书波2,李新国2,*
1 山东农业大学生命科学学院,泰安 271018 2 山东省农业科学院生物技术研究中心和山东省作物遗传改良与生态生理重点实验室,济南250100
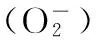
花生; 钙; 高温强光; 光抑制; 活性氧
花生是我国重要的油料作物和经济作物,在油料作物中的种植面积仅次于油菜,居第二位。钙是植物生长必须的营养元素之一,大部分的钙被认为与膜和大分子有关[1],也有大量证据表明它还参与植物不同的抗逆途径[2]。花生是喜钙作物,缺钙容易引起花生荚果空秕,花生产量降低[3]。我国北方6至9月份是花生荚果发育的重要时期,高温和强光往往会引起花生叶片光抑制,影响了花生光合产物的积累,进而影响荚果的发育,尤其是在其它环境胁迫条件(如干旱等)下,光合作用的光饱和点会明显降低,中午的强光高温更容易引起植物的光抑制,因此研究钙离子(Ca2+)参与花生抗高温强光的机制,对花生生产具有重要的理论指导意义。
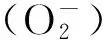
1 材料与方法
1.1材料与设计
以花生品种花育22为试验材料,首先挑选饱满均匀的花生种子在30℃湿润的条件下催芽1 d,然后挑选发芽一致的种子,播种于直径为25 cm 、高15 cm的花盆中,培养基质为用纯净水洗净的石英砂,每盆一株,每9个花盆置于一个托盘中,分别将改良的Hoagland 营养液(Ca2+用Ca(NO3)2进行配置,并用NH4NO3平衡氮元素)浇于托盘中(试验过程中全部托盘大小一致),使水分从盆底部侵润石英砂。Ca2+浓度分为0 mmol/L(CK)、6 mmol/L(C6)和12 mmol/L(C12)3个处理,每个处理3次重复,各处理同时浇相应浓度营养液且用量相同以保持石英砂不干燥。培养室内光照强度为300 μmol m-2s-1,昼/夜温度为26℃/23℃,湿度60%,光照/黑暗周期为14 h/10 h。培养至20 d左右,每种处理均选取生长一致的花生幼苗为材料。
高温强光胁迫处理时,将倒三叶叶片悬浮于42 ℃与培养溶液浓度一致的溶液上,上方罩有带有隔热水槽,对其进行强光处理,光照强度为1200 μmol m-2s-1。
8:00—9:00进行样品取样,将植株按地上部、根、叶片等器官分开制备成待测样品。
1.2测定方法
1.2.1Ca2+含量的测定
选取植株的倒三叶和整个根系放在105 ℃烘箱内烘干,然后转到80 ℃烘箱内烘至恒重,用原子能吸收法测定根系和叶片中钙离子的含量,不同Ca2+浓度处理植株的根和叶中,Ca2+含量均出现明显不同(表1)。
表1不同Ca2+浓度培养的花生植株中根系和叶片的Ca2+含量
Table 1The content of Ca2+in peanut roots and leaves cultivated with different Ca2+concentration

Ca2+浓度/(mmol/L)Ca2+concentrationCa2+在不同组织中的相对含量/%RelativecontentofCa2+indifferenttissues根Root叶Leaf01.01±0.02c0.22±0.03c61.27±0.02b0.31±0.02b121.35±0.03a0.47±0.06a
数据为3 次重复的平均值与标准方差,不同的小写字母表示在0.05水平上差异显著
1.2.2叶绿素荧光测定
根据Qin等[9]的方法用便携式荧光仪(FMS2, Hansatech, 英国)测定PSⅡ最大光化学效率(Fv/Fm),处理之前材料暗适应2 h以上,每个处理选取15个叶片作为重复,胁迫过程中测定时暗适应5 min后进行测定。
Fv/Fm=(Fm-Fo)/Fm
式中,Fo为初始荧光,Fm为最大荧光,Fv为可变荧光。
光化学猝灭(qP)通过以下公式进行计算:
qP= (Fm′ -Fs)/(Fm-Fo′)
式中,Fm′光适应条件下的最大荧光,Fs是稳态荧光,Fo′是光适应条件下的初始荧光[9]。
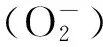
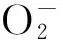
1.2.4酶活性的测定
总酶液的提取按Cho和Park[14]的方法。超氧化物歧化本酶(SOD)酶活性的测定参见Beyer和Fridovich[15]的方法,过氧化氢酶(CAT)活性的测定参见Aebi[16]的方法,抗坏血酸过氧化物酶(APX)酶活性的测定参见Nakano和Asada[17]的方法。
1.3数据处理与方法
采用sigmaplot10.0 和 SPSS18.0进行统计分析和做图,并进行方差分析。
2 结果与分析
2.1Ca2+对花生幼苗生长的影响
不同Ca2+浓度培养明显影响了花生幼苗的生长。CK植株生长明显偏差(表2),CK、C6和C12的株高、植株鲜重、植株干重依次升高。C6和C12的株高与CK相比均达极显著差异,分别增加了11.6%和18.7%,但C6与C12的株高相比差异不显著;C6和C12的植株鲜重分别比CK增加了33.4%和58.7%,达极显著差异,根冠比分别降低了2.9%和17.6%;C6和C12的地上部干重和根系干重与CK相比均差异显著,但C6和C12之间根系干重差异不显著。C6的根冠比与CK无差异,而C12的根冠比明显低于CK,达显著差异。
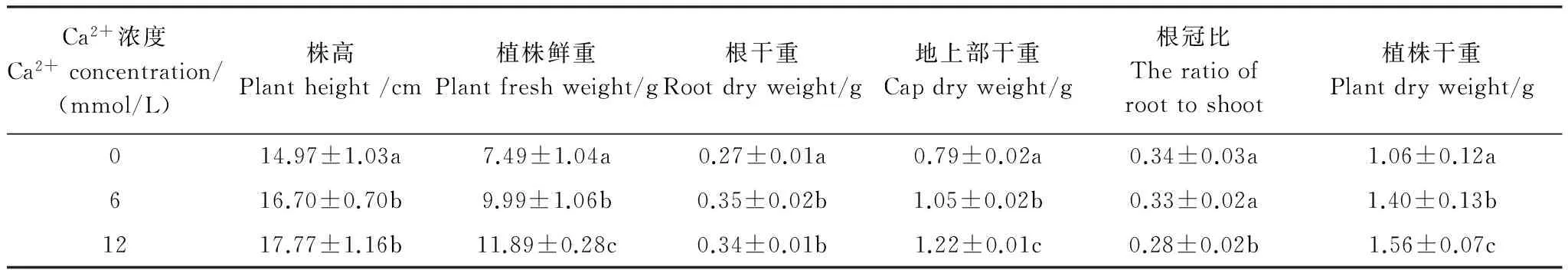
表2 Ca2+对花生幼苗生长的影响Table 2 Effects of Ca2+ on peanut seedlings′ growth
数据为3 次重复的平均值与标准方差,不同的小写字母表示在0.05水平上差异显著
2.2Ca2+对花生根系和叶片的ROS积累的影响
培养室环境条件下,不同Ca2+浓度对花生幼苗植株的根系活力影响显著,C6和C12的根系活力分别比CK提高了26.0% 和90.4%,同时二者根系SOD酶活性比CK分别提高了31.2%和78.6%(图1)。

图1 非胁迫条件下,不同Ca2+浓度培养的花生幼苗植株的根系活力和根系超氧化物歧化酶(SOD)酶活性Fig.1 Effects of different Ca2+ concentrations on root activity and root Superoxide dismutase (SOD) activity of peanut seedlings under non-stress conditions mean ± SD,n=3

图2 非胁迫条件下,不同Ca2+浓度培养的花生幼苗植株的根系和叶片的ROS积累情况Fig.2 Effects of different Ca2+ concentrations on the accumulation of ROS in roots and leaves under non-stress conditions
2.3高温强光胁迫下Ca2+对花生幼苗叶片的保护作用
2.3.1Ca2+对花生叶片光抑制程度的影响
Fv/Fm可以作为衡量PSⅡ光抑制程度的指标。如图3所示,高温(42℃)强光(1200 μmol m-2s-1)胁迫下,CK、C6和C12叶片的Fv/Fm均明显下降,三者的下降幅度分别为30.0%、23.5%和23.1%。1-qP反映PSⅡ反应中心的关闭程度和光化学反应能力,1-qP越高,说明PSⅡ反应中心的开放程度越低,光化学反应能力下降。在整个高温强光胁迫过程中C6和C12叶片的1-qP与CK相比始终处于较低水平(图3)。

图3 高温(42℃)强光(1200 μmol m-2 s-1)胁迫下,Ca2+对叶片的光抑制和PSⅡ初级电子受体(QA)的还原程度的影响Fig.3 Effects of Ca2+ on photoinhibition and QA reduction in peanut leaves under high temperature (42℃) and high irradiance (1200 μmol m-2 s-1)
2.3.2Ca2+对花生叶片的ROS积累及活性氧清除酶活性的影响
高温强光胁迫下,CK、C6和C12叶片的活性氧清除酶活性均出现升高,C6和C12的SOD、APX和CAT酶活性明显高于CK(图5),胁迫5 h后,CK、C6和C12的SOD酶活性分别为116.57、129.57 U/g鲜重和129.63 U/g鲜重,APX酶活性分别为22.60、27.00 ΔA290/min g鲜重和29.80ΔA290/min g鲜重,CAT酶活性分别为48.38、53.70 ΔA240/min g鲜重和55.80 ΔA240/min g鲜重。这表明Ca2+提高了花生幼苗植株中活性氧清除酶活性。
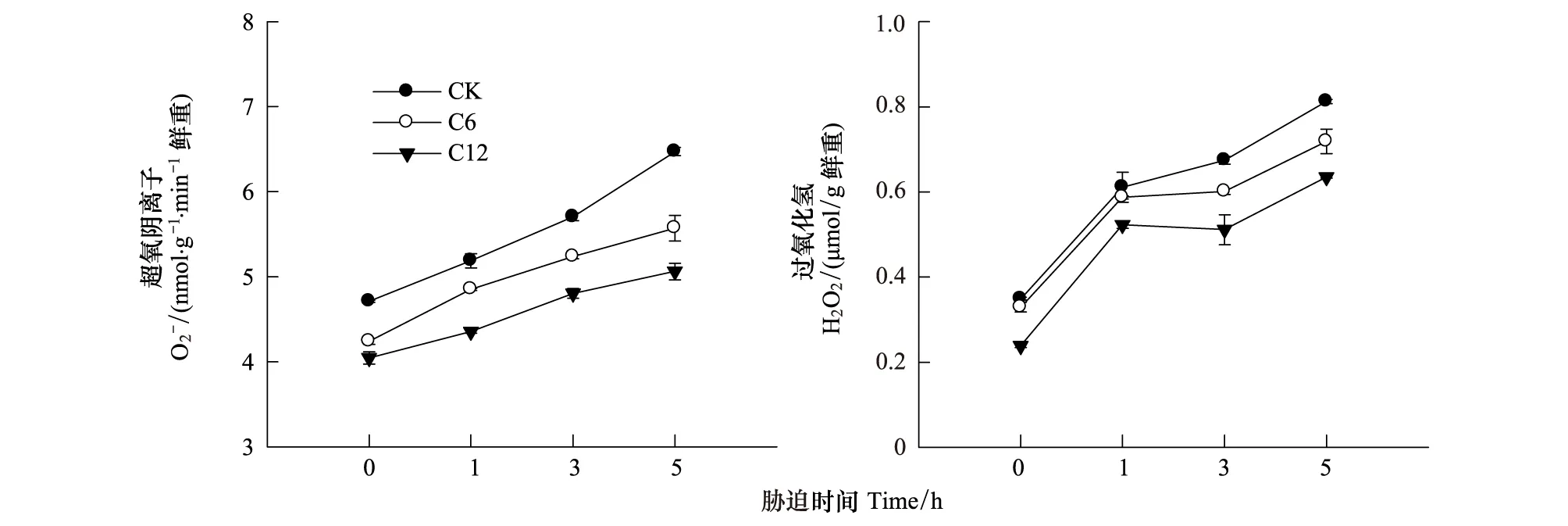
图4 高温(42℃)强光(1200 μmol m-2 s-1)胁迫下, Ca2+对花生叶片中的产生速率与H2O2的含量的影响Fig.4 Effects of Ca2+ on production rate and content in peanut leaves under high temperature (42℃) and high irradiance (1200 μmol m-2 s-1) mean ± SD,n=3

图5 高温(42℃)强光(1200 μmol m-2 s-1)胁迫下,Ca2+对花生叶片中超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和过氧化物酶(CAT)酶活性的变化Fig.5 Effects of Ca2+ on activity of superoxide dismutase (SOD)、ascorbate peroxidase (APX) and catalase (CAT) in peanut leaves under high temperature (42℃) and high irradiance (1200 μmol m-2 s-1)mean ± SD,n=3
2.3.3Ca2+对叶片渗透调节物质的含量与膜脂过氧化的影响
随着处理时间的延长,保护性物质呈现逐渐增加的趋势(图6),高温胁迫后与胁迫前相比,CK、C6和C12可溶性糖的含量分别增加了25.80%、51.50%和66.67%,Pro含量分别增加了262.93%、517.22%和565.27%。这表明Ca2+会促进高温强光胁迫下花生叶片渗透调节物质的积累。
花生叶片中AsA含量始终以C12最高,CK最低,且在高温强光胁迫下,AsA含量在CK、C6和C12幼苗叶片中均整体呈现增加趋势。正常培养条件下,C6和C12的AsA含量分别比CK高11.1%和19.8%,胁迫后C6和C12的AsA含量则分别比CK高8.8%和10.3%,(图6)。表明Ca2+有利于提高高温强光胁迫下AsA的含量。
MDA是植物受到逆境胁迫时膜脂过氧化作用的最终产物,其含量的高低反映ROS对植物细胞膜伤害的程度。正常培养条件下,C6和C12幼苗叶片的MDA 含量明显低于CK叶片,而在高温强光胁迫后,CK、C6和C12幼苗叶片的MDA 含量均出现明显升高,但仍以CK的MDA 含量最高,其次是C6,C12的最低(图6),表明高温强光胁迫下,花生Ca2+对花生叶片膜系统起到了明显保护作用,而这种保护作用可能与叶片活性氧的有效清除有关(图4)。

图6 高温(42℃)强光(1200 μmol m-2 s-1)胁迫下,Ca2+对花生叶片中可溶性糖、脯氨酸(Pro)、抗坏血酸(AsA)和丙二醛(MDA)含量的变化Fig.6 Effects of Ca2+ on the content of soluble sugar, proline (Pro), ascorbate acid (AsA) and malonaldehyde (MDA) in peanut leaves under high temperature (42℃) and high irradiance (1200 μmol m-2 s-1)mean ± SD,n=3
3 讨论
Ca2+对植物生长的影响是多方面的,它参与植物大部分的代谢途径。施Ca2+会明显促进花生幼苗的生长,花生植株长势明显增强,植株的干重和鲜重都明显增加,而且12 mmol/L Ca2+浓度似乎对花生幼苗的生长更有利(表2)。
在本研究中,Ca2+促进花生幼苗生长原因与施Ca2+抑制ROS的过量积累密切相关。ROS是生物体维持正常生命活动所必须的,植物在进行呼吸作用和光合电子传递时体内也会产生ROS,但是如果ROS产生与清除过程的平衡被打破,ROS会大量积累,而ROS具有很高的氧化活性,会对植物体造成伤害[18]。非胁迫条件下,Ca2+促进花生幼苗的生长与施Ca2+提高了ROS的清除能力有关,根系和叶片SOD酶活性显著提高,有效地降低了活性氧积累所引起的伤害(图2),从而使花生根系保持较高的活力(图1)。
另外,即使在高温强光胁迫条件下,施Ca2+也会抑制花生幼苗叶片ROS的积累(图4,图5)。逆境条件下,植物的光合作用光饱和点会明显降低,光能利用效率下降,造成光能过剩,从而使PSI和PSⅡ的ROS产生加速。为避免光氧化胁迫,叶绿体通过多种酶促反应和抗氧化剂清除活性氧[4]。ROS的大量积累一方面会直接氧化破坏PSⅡ而加重光抑制,另一方面通过抑制光破坏的PSⅡ的修复而加速光抑制过程[19]。前期的研究表明高温强光容易引起花生叶片的光抑制,且PSⅡ反应中心的受体侧易受到影响,而对花生叶片光系统造成严重破坏的主要原因与能量耗散途径受抑有关[20]。研究表明,高温强光胁迫下Ca2+提高了花生叶片的ROS清除能力,对PSⅡ反应中心起到了有效的保护作用,使PSⅡ反应中心保持较大的开放程度,而且12 mmol/L Ca2+浓度对花生幼苗叶片光化学活性的提高比6 mmol/L Ca2+浓度更有效(图3)。
除ROS清除系统外,植物还拥有多种低抗外界胁迫的保护机制,渗透调节就是其中的一个。Pro和可溶性糖是植物体内重要的渗透调节物质,当植物受到环境胁迫时Pro和可溶性糖的含量增加可以提高植物的抗逆境能力。Ca2+有效提高了花生幼苗的重要保护性物质可溶性糖、Pro和AsA的含量(图6),从而在一定程度上对生物膜起到了保护作用,降低了生物膜的膜脂过氧化水平(图6)。AsA既是叶黄素循环中VDE酶必不可少的底物[21],也是植物组织中清除活性氧的重要物质[4]。Xu等[21]的研究表明,外源AsA能够增强了叶黄素循环的运转,提高水稻叶片光合机构对低温和强光所诱导光抑制的抗性[20],而Ca2+很可能通过提高AsA的含量增强了叶黄素循环,促进了因高温强光引起的过剩能量的耗散。另外,Ca2+有效提高花生重要渗透调节物质的含量表明Ca2+不但可以调控光合作用机构的稳定性和ROS清除酶活性,也能直接或间接调控渗透调节物质的合成。
Ca2+作为大量元素,其对植物体生长的影响主要集中于两个方面:一方面Ca2+参与生物膜的形成并与膜的稳定性有关[1]。本研究中采用的6 mmol/L Ca2+浓度远高于Hoagland溶液的4 mmol/L Ca2+浓度,6 mmol/L浓度不会影响花生的正常生长,但在此浓度下花生生长和抗逆境的能力明显低于12 mmol/L Ca2+浓度,这表明Ca2+对花生幼苗生长的影响不仅仅局限于参与生物膜的形成和其稳定性方面;另一方面Ca2+提高植物的适应能力主要是通过Ca2+依赖的信号转导途径激活下游基因表达或者是激活一系列的生化反应来实现的[2]。植物已知钙感受器/介质具有显著多样性和丰富性,包括许多所谓的CaM-like蛋白[22],这些蛋白家族成员定位于过氧化物酶体和线粒体,叶绿体也拥有许多CaM的潜在靶位[23]。已经表明植物的CaM可通过与过氧化氢酶结合以提高该酶的氧化活性[24]。因此,Ca2+依赖的信号转导途径可能是调控花生生长和抗逆性的一个重要途径,而Ca2+信号转导途径是如何进行调控的需要研究。
[1]Brand J J, Becker D W. Evidence for direct roles of calcium in photosynthesis. Journal of Bioenergetics and Biomembranes, 1984, 16(4): 239- 249.
[2]Zhu X J, Yang J S, Liang Y C, Lou Y S, Yang X Y. Effects of exogenous calcium on photosynthesis and its related physiological characteristics of rice seedlings under salt stress. Scientia Agricultura Sinica, 2004, 37(10): 1497- 1503.
[3]周恩生, 陈家驹, 王飞, 王煌平, 陈惠成, 何盈. 钙胁迫下花生荚果微区特征及植株生理生化反应变化. 福建农业学报, 2008, 23(3):318- 321.
[4]Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant Physiology, 2006, 141(2): 391- 396.
[5]Clapham D E. Calcium signaling. Cell, 2007, 131(6): 1047- 1058.
[6]Dodd A N, Kudla J, Sanders D. The language of calcium signaling. Annual Review of Plant Biology, 2010, 61(1): 593- 620.
[7]Tan W, Meng Q W, Brestic M, Olsovska K, Yang X H. Photosynthesis is improved by exogenous calcium in heat-stressed tobacco plants. Journal of Plant Physiology, 2011, 168(17): 2063- 2071.
[8]张海平, 单世华, 蔡来龙, 官德义, 李毓, 庄伟建. 钙对花生植株生长和叶片活性氧防御系统的影响. 中国油料作物学报, 2004, 26(3): 33- 36.
[9]Qin L Q, Li L, Bi C, Zhang Y L, Wan S B, Meng J J, Meng Q W, Li X G. Damaging mechanisms of chilling- and salt stress toArachishypogaeaL. leaves. Photosynthetica, 2011, 49(1): 37- 42.
[10]Thakur M, Sharma A D. Salt-stress-induced proline accumulation in germinating embryos: Evidence suggesting a role of proline in seed germination. Journal of Arid Environments, 2005, 62(3): 517- 523.
[11]林颖, 吴毓敏, 吴雯, 田庚元. 天然产物中的糖含量测定方法正确性的研究. 天然产物研究与开发, 1996, 8(3): 5- 9.
[12]Kampfenkel K, Van Montagu M, Inzé D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue. Analytical Biochemistry, 1995, 225(1): 165- 167.
[13]李新国, 毕玉平, 赵世杰, 孟庆伟, 何启伟, 邹琦. 短时低温胁迫对甜椒叶绿体超微结构和光系统的影响. 中国农业科学, 2005, 38(6): 1226- 1231.
[14]Cho U H, Park J O. Mercury-induced oxidative stress in tomato seedlings. Plant Science, 2000, 156(1): 1- 9.
[15]Beyer W F Jr, Fridovich I. Assaying for superoxide dismutase activity: some large consequences of minor changes in conditions. Analytical Biochemistry, 1987, 161(2): 559- 566.
[16]Aebi H. Catalaseinvitro. Methods in Enzymology, 1984, 105: 121- 126.
[17]Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant and Cell Physiology, 1981, 22(5): 867-880.
[18]Mittler R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, 2002, 7(9): 405- 410.
[19]Nishiyama Y, Allakhverdiev S I, Murata N. A new paradigm for the action of reactive oxygen species in the photoinhibition of photosystem Ⅱ. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2006, 1757(7): 742- 749.
[20]秦立琴, 张悦丽, 郭峰, 万书波, 孟庆伟, 李新国. 强光下高温与干旱胁迫对花生光系统的伤害机制. 生态学报, 2011, 31(7): 1835- 1843.
[21]Xu C C, Lin R C, Li L B, Kuang T Y. Increase in resistance to low temperature photoinhibition following ascorbate feeding is attributable to an enhanced xanthophyll cycle activity in rice (OryzasativaL.) leaves. Photosynthetica, 2000, 38(2): 221- 226.
[22]Bussemer J, Vothknecht U C, Chigri F. Calcium regulation in endosymbiotic organelles of plants. Plant Signaling & Behavior, 2009, 4(9): 805-808.
[23]Chigri F, Flosdorff S, Pilz S, Kölle E, Dolze E, Gietl C, Vothknecht U C. TheArabidopsiscalmodulin-like proteins AtCML30 and AtCML3 are targeted to mitochondria and peroxisomes, respectively. Plant Molecular Biology, 2012, 78(3): 211- 222.
[24]Yang T, Poovaiah B W. Hydrogen peroxide homeostasis: Activation of plant catalase by calcium/calmodulin. Proceedings of the National Academy of Sciences of the United States, 2002, 99(6): 4097- 4102.
Effects of calcium on peanut (ArachisHypogaeaL.) seedling growth,accumulation of reactive oxygen species and photoinhibition
WANG Fang1,2, YANG Sha2, GUO Feng2, MENG Jingjing2, MENG Qingwei1, WAN Shubo2, LI Xinguo2,*
1CollegeofLifeScience,ShandongAgriculturalUniversity,Tai′an,Shandong271018,China2BiotechnologyResearchCenterofShandongAcademyofAgriculturalSciences;ShandongProvincialKeyLaboratoryofCropGeneticImprovement,EcologyandPhysiology,Ji′nan250100,China

peanut; calcium; high temperature and high irradiance; photoinhibition; reactive oxygen species.
山东省自然科学基金项目(ZR2009DZ007, ZR2011CQ042); 山东省自主创新成果转化重大专项(2012ZHZXIA0418- 4); 现代农业产业技术体系建设专项资金资助(CARS- 14)
2013- 05- 07;
日期:2014- 04- 17
10.5846/stxb201305070965
*通讯作者Corresponding author.E-mail: lixinguo@tom.com
王芳,杨莎,郭峰,孟静静,孟庆伟,万书波,李新国.钙对花生幼苗生长、活性氧积累和光抑制程度的影响.生态学报,2015,35(5):1496- 1504.
Wang F, Yang S, Guo F, Meng J J, Meng Q W, Wan S B, Li X G.Effects of calcium on peanut (ArachisHypogaeaL.) seedling growth, accumulation of reactive oxygen species and photoinhibition.Acta Ecologica Sinica,2015,35(5):1496- 1504.
