栖息地环境对种群营养生态位的影响
——以黄颡鱼为例
2015-03-11沙永翠张培育苏国欢
沙永翠,张培育,张 欢,苏国欢,徐 军
1 中国科学院水生生物研究所,武汉 430072 2 中国科学院大学,北京 108000
栖息地环境对种群营养生态位的影响
——以黄颡鱼为例
沙永翠1,2,张培育1,2,张 欢1,2,苏国欢1,2,徐 军1,*
1 中国科学院水生生物研究所,武汉 430072 2 中国科学院大学,北京 108000
生态位是生态学研究的基础,目前关于环境指标是否直接影响营养生态位的分析研究很少。以高营养级鱼类黄颡鱼为研究对象,利用稳定同位素分析和相关分析,在太湖贡湖湾研究了氨氮、亚硝酸盐氮、硝酸盐氮、总氮、溶解性总氮、溶解性正磷酸盐、总磷、溶解性总磷、叶绿素等多个栖息地水环境因子对鱼类种群营养生态位的影响。结果表明,栖息地水环境对黄颡鱼总营养生态位影响不大,但部分栖息地水环境因子对分项营养生态位(包括浮游、底栖与肉食性)有影响。研究得知,栖息地水环境因子中氨氮、硝酸盐氮、总氮、溶解性总氮及溶解性总磷与浮游食性营养生态位显著正相关,氨氮、硝酸盐氮、总氮、溶解性总氮及溶解性总磷与肉食性营养生态位显著负相关,而底栖食性则主要受溶解性总磷的影响,与其显著正相关。水环境因子的季节变化影响水体中饵料资源的分布,进而影响鱼类的食物组成。
栖息地环境; 营养生态位; 浮游食性; 底栖食性; 食鱼食性
生态位是生态学研究的基础,本质上是指物种在特定尺度下在特定生态环境中的职能地位[1]。Hutchinson提出生态位的多维超体积模型,定义其为由所有环境变量所决定的物种可以生存和繁殖的多维空间[2]。动物对食物资源的利用,一方面表现其自身的营养需求特征;另一方面也反映其在生态系统中所处的营养层和功能,即营养生态位[3- 5]。营养生态位是指动物对其食物资源能够实际和潜在占据、利用或适应的部分[3]。研究营养生态位对理解生态系统中的食物网结构、资源利用及营养相互作用是极为重要的[6]。
食性分析是营养生态位研究的基础,主要有直接观察法、利用法、胃含物分析法、粪便显微分析法、粪便DNA分析技术等[4]。在鱼类生态学中,胃含物分析法是研究鱼类食性的标准方法[7],通过对食物组成进行定性、定量研究,探讨鱼类的摄食习性及能量来源,评估鱼类在生态系统中的地位和功能,根据食物组成确定营养生态位的宽度[8]。由于胃含物分析法对易消化食物难以判别,对于某些食物组成的重量无法精确更正,所以引入稳定同位素示踪法来分析判断食物来源[8],经常运用稳定同位素研究营养生态位,所以运用混合模型将同位素比值转换成不同同位素来源的食性比例[9],使稳定同位素技术确定的营养生态位更具普遍性。
理论上物种占据的生态位会受到许多因子的影响,其中生物因子包括食物密度及多样性、种群大小、竞争及捕食关系[10- 12]。营养生态位描述食物网中消费者的营养位置,食物的可利用性、可获得性以及生物间相互作用都会影响营养生态位的大小[6]。受食物资源可利用性限制,自由生活的动物在挑选食物时,不仅受食物资源的分布和适口性的影响,而且受物种之间的相互作用关系,尤其是物种间的竞争作用影响[13]。但是目前栖息地环境因子对营养生态位是否有直接作用的研究较少。
本文以太湖贡湖湾高营养级鱼类黄颡鱼的营养生态位为例,分析了包括氨氮、亚硝酸盐氮、硝酸盐氮、总氮、溶解性总氮、溶解性正磷酸盐、总磷、溶解性总磷、叶绿素等栖息地环境因子对其营养生态位的影响。分析黄颡鱼的营养生态位,对了解其种群结构、营养格局及稳定性具有重要意义。
1 材料与方法
1.1 研究对象与样品采集
黄颡鱼Pelteobagrusfulvidraco属鲇形目Siluriformes鲿科 Bagridae,多在静水或江河缓流中活动,营底栖生活,为偏肉食性的杂食性鱼类,多以鱼虾类、甲壳类(枝角类和桡足类)、水生昆虫、螺类和水蚯蚓等为主要食物[14]。
采样地点位于太湖东北部的贡湖湾(31°25′N,120°18′E),随机设立3个采样点,采用GPRS定位。采样时间为2005年4月至11月,每月中旬定期采集1次。用自制的拖网(宽3 m,网目7.0 mm)采样,每次采样时于每个采样点用拖网拖3次,每次5 min[15- 17],捕获的鱼类样品低温储存,并计数和称重。水样用5L可移动的酸洗聚氯乙烯瓶装采样器采集,采取水体表层和底层的混合水样。
1.2 稳定同位素分析
分析所用仪器为Carlo Erba NA2500元素分析仪和Delta Plus同位素质谱仪,将所测样品(Sample)的同位素比值与相应的标准物质(Standard)的同位素比值作比较,得样品的稳定性同位素比率[18],碳氮同位素比值以δ形式表示,定义为:
δX(‰) = [(Rsample/Rstandard)-1]×1000
式中,X是13C或15N;Rsample为所测得的同位素比值,碳同位素是13C/12C,氮同位素是15N/14N;Rstandard为标准物质的同位素比值,碳氮稳定同位素测定的标准物质分别为VPDB和N2[19];δ值用于衡量样品中重同位素的含量,其越小表示样品重同位素(13C或15N)含量越低,越大表示样品重同位素(13C或15N)含量越高。样品δ13C和δ15N重复测量的标准误差均小于0.3 ‰。
1.3 环境指标的测定
水化指标中,测定总磷时需要使用氧化剂K2S2O8和NaOH对水样进行消解(正磷酸盐的测定不需要消解,使用钼酸盐比色法测定),消解后使用钼酸盐比色法测定。水样在过硫酸钾氧化后,使用紫外分光光度法(220 nm处比色)测定总氮。测定氨氮的方法为纳氏比色法,硝酸盐氮、亚硝酸盐氮分别使用酚二磺酸光度法和N-(1-萘基)-乙二胺光度法测定。叶绿素a以分光光度计法测定。上述所有方法均基本依据国家水质监测实验标准方法进行[20]。
1.4 营养生态位的测定
GE Hutchinson认为生态位是空间中一个抽象的n维点集,其坐标轴代表环境变量[9],稳定同位素引入后,以δ13C-δ15N为坐标,在δ空间获得二维点集。Layman提出以包含δ13C-δ15N二维空间的凸多边形总面积TA(图1)表示营养生态位结构的度量指标[21]。总面积TA通过R 2.15.1软件的SIAR软件包计算。
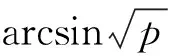
1.5 线性相关分析
在进行相关分析前,首先对14种指标分别进行Shapiro Wilk正态性检验,当概率P≥0.05时,认为该指标服从正态分布。然后将实验室测得的9种环境指标氨氮(NH4-N)、亚硝酸盐氮(NO2-N)、硝酸盐氮(NO3-N)、总氮(TN)、溶解性总氮(TDN)、溶解性正磷酸盐(PO4-P)、总磷(TP)、溶解性总磷(TDP)、叶绿素a(Chlra)与计算所得的营养生态位指标总面积(TA)、总体积(TV)以及浮游食性、底栖食性和食鱼食性分别进行线性相关分析。数据分析均采用SPSS 16.0软件。
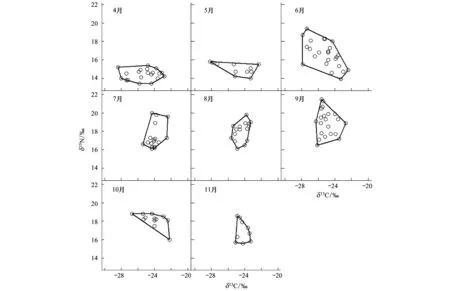
图1 二维营养生态位的季节变化Fig.1 Seasonal change of the 2-dimensional trophic niches
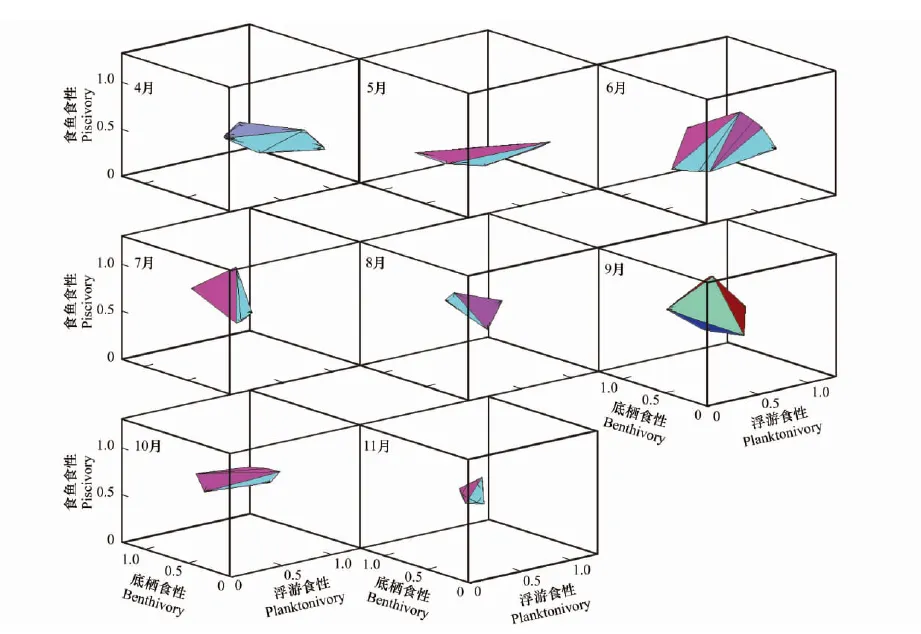
图2 三维营养生态位的季节变化Fig.2 Seasonal change of the 3-dimensional trophic niches
2 结果
2.1 营养生态位
通过4至11月8个月的调查共获得133尾黄颡鱼,各月份的稳定同位素δ13C、δ15N值及各月份采得的黄颡鱼个体数如下表所示(表1)。各月份的生态位总面积(图1)、生态位总体积(图2)以及3种食性比例浮游食性、底栖食性和食鱼食性的结果见表1,将不同季节(以4、5月代表春季,6、7、8月代表夏季,9、10、11月代表秋季)的营养生态位进行比较,发现夏季的平均生态位总面积最高,其次为春季,秋季较小。各月份中,6月份的生态位总面积最大,其次为9月份,11月份最小。平均生态位总体积以夏季最高,其次为秋季,春季较小,各月份的生态位总体积以6月份最大,其次为9月份,11月份最小。
在春季,浮游食性和底栖食性有较高的比例,其中4月份浮游食性的比例最高(59.3%),底栖食性的比例在5月份达到最大(45.9%)。食鱼食性比例在春季较小,其中5月份比例最小(8.8%),5月份以后,食鱼食性比例快速上升,在秋季10月份达到最大(53.2%),而浮游食性和底栖食性比例均呈下降趋势。7月份以后,食鱼食性的比例均高于浮游食性和底栖食性。
表1 4月至11月8个月份的稳定同位素δ13C、δ15N平均值,以及通过混合模型计算所得3种食性比例的平均值(括号内均为标准差)
Table 1 The values (mean and SD) ofδ13C orδ15N and three dietary proportions-Planktonivory, Benthivory and Piscivory which were measured by the mixing models
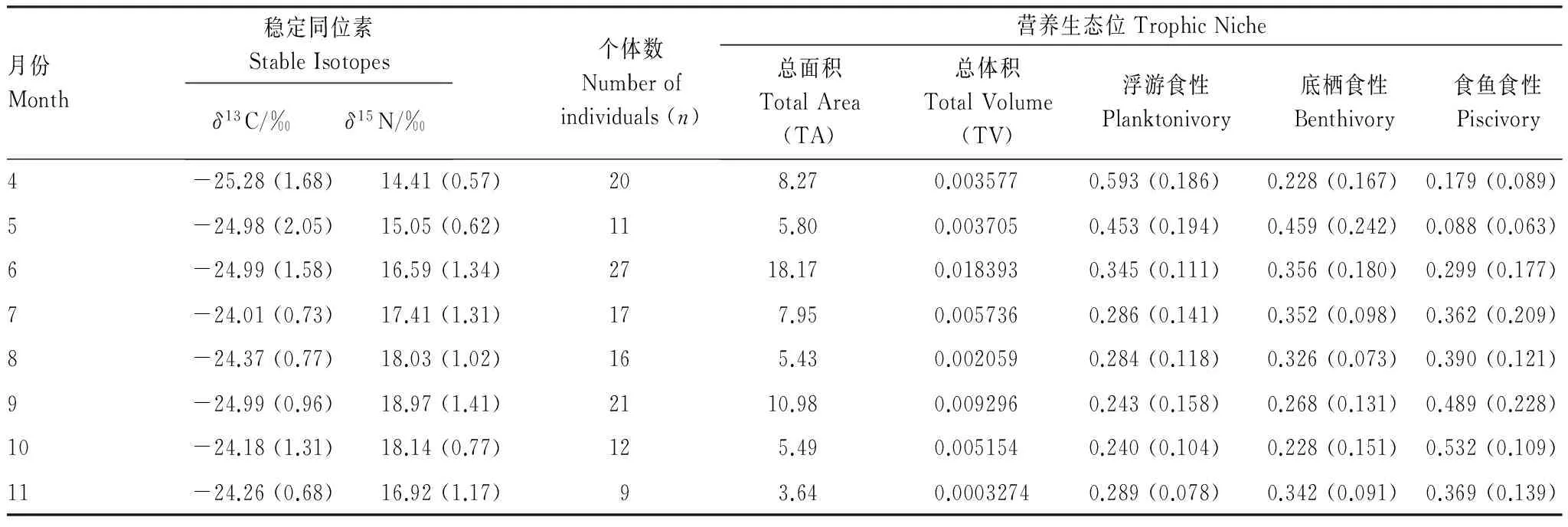
月份Month稳定同位素StableIsotopesδ13C/‰δ15N/‰个体数Numberofindividuals(n)营养生态位TrophicNiche总面积TotalArea(TA)总体积TotalVolume(TV)浮游食性Planktonivory底栖食性Benthivory食鱼食性Piscivory4-25.28(1.68)14.41(0.57)208.270.0035770.593(0.186)0.228(0.167)0.179(0.089)5-24.98(2.05)15.05(0.62)115.800.0037050.453(0.194)0.459(0.242)0.088(0.063)6-24.99(1.58)16.59(1.34)2718.170.0183930.345(0.111)0.356(0.180)0.299(0.177)7-24.01(0.73)17.41(1.31)177.950.0057360.286(0.141)0.352(0.098)0.362(0.209)8-24.37(0.77)18.03(1.02)165.430.0020590.284(0.118)0.326(0.073)0.390(0.121)9-24.99(0.96)18.97(1.41)2110.980.0092960.243(0.158)0.268(0.131)0.489(0.228)10-24.18(1.31)18.14(0.77)125.490.0051540.240(0.104)0.228(0.151)0.532(0.109)11-24.26(0.68)16.92(1.17)93.640.00032740.289(0.078)0.342(0.091)0.369(0.139)
2.2 环境指标
太湖贡湖湾4—11月8个月份的9种水质指标如下表所示(表2),结果表明春季水体中氮、磷含量较高,其中总氮、溶解性总氮、溶解性正磷酸盐(PO4-P)在4月份最高,分别为4.1504、3.1900、0.0024 mg/L,硝酸盐氮(NO3-N)、氨氮(NH4-N)、总磷、溶解性总磷在5月份最高,分别为2.1420 mg/L 、0.9971、0.2482、0.0413 mg/L,而亚硝酸盐氮(NO2-N)在夏季7月份达到最高(为0.0432 mg/L)后,至8月份迅速下降,9月份降至最低,为0.0051 mg/L。5—6月,水体中氮、磷含量均有明显下降。夏季,水体中四种形式的氮含量持续下降,总氮、溶解性总氮、硝酸盐氮(NO3-N)在秋初9月份降至最低,分别为0.4010 mg/L、0.1681 mg/L、0.2366 mg/L,氨氮(NH4-N)在10月份最低,为0.0668 mg/L;3种形式的磷含量则相对平稳。8月份以后,溶解性总磷逐渐下降,至10月份最低,为0.0194 mg/L,而溶解性正磷酸盐(PO4-P)、总磷则先上升后下降,分别在10月份、11月份降至最低,分别为0.0004、0.0086 mg/L。水体中叶绿素a(Chlra)含量变动范围为5.05—47.56 μg/L,最高值和最低值均出现在秋季,其中9月份最高,11月份最低。
2.3 线性相关分析
应用SPSS 16.0软件对5种营养生态位指标总面积、总体积、浮游食性、底栖食性和食鱼食性以及9种环境指标氨氮(NH4-N)、亚硝酸盐氮(NO2-N)、硝酸盐氮(NO3-N)、总氮、溶解性总氮、溶解性正磷酸盐(PO4-P)、总磷、溶解性总磷、叶绿素a(Chlra)进行Shapiro Wilk正态性检验,结果显示浮游食性以及氨氮(NH4-N)检验概率P<0.05,不服从正态分布,其他12种指标检验概率P≥0.05,服从正态分布。服从正态分布的指标选用Pearson相关系数,反之选用Spearman相关系数。

表2 太湖贡湖湾4—11月不同月份的环境指标Table 2 The environmental variables of different months from April to November in Gonghu Bay, Lake Taihu China
线性相关分析结果如下表所示(表3),由表中可以看出,总面积、总体积与9种环境指标均没有相关关系;浮游食性与硝酸盐氮(NO3-N)、总氮、溶解性总氮、溶解性总磷相关性极显著(P<0.01),相关系数分别为0.905、0.929、0.964、0.901,与氨氮(NH4-N)相关性显著(P<0.05),相关系数为0.810,与其他指标相关性不显著;底栖食性与溶解性总磷相关性显著(P<0.05),相关系数为0.775,与其他指标相关性不显著;食鱼食性与硝酸盐氮(NO3-N)、总氮、溶解性总氮、溶解性总磷相关性极显著(P<0.01),相关系数分别为-0.893、-0.854、-0.976、-0.913,与氨氮(NH4-N)相关性显著(P<0.05),相关系数为-0.762,与其他指标相关性不显著。

表3 营养生态位指标与环境变量的线性相关分析结果Table 3 The results of linear correlation analysis between trophic niche and environment variables
3 讨论
本研究定量分析了太湖贡湖湾2005年4—11月份9种环境变量指标对高营养级鱼类黄颡鱼营养生态位的影响,研究表明,9种环境指标对营养生态位总面积、总体积影响不显著,说明营养生态位主要受食物资源的丰富性、可利用性及生物间相互作用的影响。
栖息地水环境对黄颡鱼总营养生态位影响不大,但3种分项营养生态位(浮游、底栖与肉食性)可能受部分环境因子的影响。通过相关分析得知,太湖贡湖湾环境变量指标对3种食性比例有较显著影响,其中浮游食性与不同形式的氮(NH4-N、NO3-N、TN、TDN)及溶解性总磷显著正相关,食鱼食性与不同形式的氮(NH4-N、NO3-N、TN、TDN)及溶解性总磷显著负相关,而底栖食性则主要受溶解性总磷的影响,这主要与饵料资源供应的季节变化有关[24]。鱼类食性随环境变化而变化,在不同环境条件下,鱼类食物组成有所不同。
贡湖湾是太湖东北部一个较大的湖湾,本研究期间为沉水植物控制的草型湖区,随着日趋严重的水体富营养化,贡湖湾北部大片水草区的沉水植物群落在2006年基本消失,只剩下零星的马来眼子菜[25]。春季水体中N、P营养盐浓度较高(平均总氮为4.0159 mg/L,平均总磷为0.1893 mg/L),藻类大量繁殖,其中蓝藻中的微囊藻为绝对优势种,这为浮游动物提供了丰富的食物来源,同时藻类大量死亡后,使分解细菌大量生长,也为浮游动物提供了食物[26],此时黄颡鱼大量摄食枝角类、桡足类等浮游动物,浮游食性比例最高,这与浮游食性与水体中的含氮量及溶解性总磷显著正相关的结果相吻合。而春季黄颡鱼的食鱼食性比例最小,这可能与藻类的大量繁殖造成水体溶解氧过饱和有关。溶解氧的过饱和或水中溶解氧过少,都对水生动物有害,造成鱼类的大量死亡[27]。
水化分析结果显示,5月份以后,水体中氮、磷含量均呈下降趋势(夏季平均总氮为1.8295 mg/L,平均总磷为0.0871 mg/L;秋季平均总氮为1.6111 mg/L,平均总磷为0.0619 mg/L),原因可能有两个:(1)高密度藻类繁殖生长过程中大量消耗水体中氮磷等营养物质,而浮游植物的生物量与水体中可利用的营养物质及循环有关,一般随营养物质的增加而增加[28- 29],所以春季后黄颡鱼的浮游食性比例明显下降。(2)水生植物进入生长季,氨氮、硝态氮是植物吸收的主要形式[30],导致水体中总氮等指标下降。繁茂的水生植物提高了空间的异质性,给各种生物提供了避难所和摄食场所,饵料生物资源丰富[24]。大型底栖动物是水生态系统的一个重要生态类群,在淡水湖泊和河流中其优势类群主要包括水栖寡毛类、软体动物和水生昆虫等[31]。底栖动物对环境条件反应敏感,在生物环境中,沉水植物是影响底栖动物的重要因素,一般水草丰富的湖泊底栖动物的种类数和丰度就高[32- 35]。底栖鱼类与大型底栖动物主要通过食物链和食物网表现一种食与被食的食物关系。大型底栖动物中的软体动物、水生昆虫和寡毛类是湖泊中底栖鱼类重要的饵料基础,其生物量的大小,将决定着以此为食的底栖鱼类生产量的大小[36]。底栖动物数量的不断增加,促使以其为食的底栖鱼类产量上升,饵料鱼类生物量的增加,通过上行效应影响黄颡鱼食物组成,所以随着水体中N、P营养盐浓度的下降,水环境质量上升,水生生物群落的结构趋于复杂化,同时高营养级鱼类黄颡鱼食鱼食性比例也随之不断增加。
总的来说,水体环境要素对高营养级鱼类总的营养生态位影响不大,但是由于水环境因子的季节变化,影响水体中饵料资源的丰度和分布,通过上行效应控制较高营养阶层的种群结构,进而影响高营养级鱼类的食物组成。
[1] 张光明, 谢寿昌. 生态位概念演变与展望. 生态学杂志, 1997, 16(6): 46- 51.
[2] Hutchinson G E. Concluding remarks: Cold spring harbor symposium. Quantitative Biology, 1957, 22: 415- 427.
[3] 康乐,陈永林. 草原蝗虫营养生态位的研究. 昆虫学报, 1994, 37(2): 178- 189.
[4] 李熠. 完达山东部地区暴雪前后马鹿和狍营养生态位的比较研究 [D]. 哈尔滨: 东北林业大学, 2008.
[5] 殷宝法, 淮虎银, 张镱锂, 周乐, 魏万红. 可可西里地区藏羚羊、藏原羚和藏野驴的营养生态位. 应用生态学报, 2007, 18(4): 766- 770.
[6] Chen G, Wu Z H, Gu B H, Liu D Y, Li X, Wang Y. Isotopic niche overlap of two planktivorous fish in southern China. Limnology, 2011, 12(2): 151- 155.
[7] Hyslop E J. Stomach contents analysis—a review of methods and their application. Journal of Fish Biology, 1980, 17(4): 411- 429.
[8] 袁刚. 洞庭湖四种黄颡鱼种群结构与营养生态位研究 [D]. 武汉: 中国科学院水生生物研究所, 2010.
[9] Newsome S D, Martinez del Rio C, Bearhop S, Phillips D L. A niche for isotopic ecology. Frontiers in Ecology and the Environment, 2007, 5(8): 429- 436.
[10] Bearhop S, Adams C E, Waldron S, Fuller R A, MacLeod H. Determining trophic niche width: a novel approach using stable isotope analysis. Journal of Animal Ecology, 2004, 73(5): 1007- 1012.
[11] Fox B J. Niche parameters and species richness. Ecology, 1981, 62(6): 1415- 1425.
[12] Van Valen L. Morphological variation and width of ecological niche.The American Naturalist, 1965, 99(908): 377- 390.
[13] 孙鸿烈, 郑度. 青藏高原形成演化与发展. 广州: 广东科技出版社, 1998.
[14] 王武, 刘杰, 陈立婧, 孔优佳, 花少鹏, 邬振祥, 栾天. 滆湖杂食性鱼类食物生态位的研究. 水利渔业, 2006, 26(4): 39- 40, 42- 42.
[15] 温周瑞, 谢平, 徐军. 太湖秀丽白虾繁殖生物学研究. 长江大学学报: 自然科学版, 2012, 9(4): 23- 27, 40- 40.
[16] 温周瑞, 谢平, 徐军. 太湖日本沼虾繁殖生物学研究. 苏州大学学报: 自然科学版, 2012, 28(4): 79- 87.
[17] 温周瑞, 张大文, 谢平, 徐军. 太湖日本沼虾、秀丽白虾现存量的周年动态研究——以梅梁湾、贡湖湾为例. 长江流域资源与环境, 2011, 20(9): 1035- 1039.
[18] 徐军. 应用碳、氮稳定性同位素探讨淡水湖泊的食物网结构和营养级关系 [D]. 武汉: 中国科学院水生生物研究所, 2005.
[19] 张欢, 谢平, 吴功果, 张欢, 张培育, 徐军. 日本沼虾和秀丽白虾的营养生态位. 环境科学研究, 2013, 26(1): 22- 26.
[20] 国家环境保护总局. 水和废水监测分析方法. 北京: 中国环境科学出版社, 2002.
[21] Layman C A, Arrington D A, Montaa C G, Post D M. Can stable isotope ratios provide for community-wide measures of trophic structure? Ecology, 2007, 88(1): 42- 48.
[22] Xu J, Wen Z R, Gong Z J, Zhang M, Xie P, Hansson L A. Seasonal trophic niche shift and cascading effect of a generalist predator fish. PloS One, 2012, 7(12): e49691.
[23] Cornwell W K, Schwilk D W, Ackerly D D. A trait-based test for habitat filtering: Convex hull volume. Ecology, 2006, 87(6): 1465- 1471.
[24] 叶佳林. 太湖梅梁湾沿岸带鱼类组成和摄食生态研究 [D]. 武汉: 华中农业大学, 2006.
[25] 朱广伟. 太湖富营养化现状及原因分析. 湖泊科学, 2008, 20(1): 21- 26.
[26] 成芳. 太湖水体富营养化与水生生物群落结构的研究 [D]. 苏州: 苏州大学, 2010.
[27] 王美杰. 水体富营养化的危害及防治措施. 科技信息, 2012, (10): 60- 60.
[28] Kilham P, Hecky R E. Comparative ecology of marine and freshwater phytoplankton. Limnology and Oceanography, 1988, 33(4): 776- 795.
[29] 刘建康. 东湖生态学研究 (一). 北京: 科学出版社, 1990: 184- 189.
[30] 吴晓磊. 人工湿地废水处理机理. 环境科学, 1995, 16(3): 83-86, 96- 96.
[31] 龚志军, 谢平, 唐汇涓, 王士达. 水体富营养化对大型底栖动物群落结构及多样性的影响. 水生生物学报, 2001, 25(3): 210- 216.
[32] Dvorak J, Best E P H. Macro-invertebrate communities associated with the macrophytes of Lake Vechten: structural and functional relationships. Hydrobiologia, 1982, 95(1): 115- 126.
[33] Rabe F W, Gibson F. The effect of macrophyte removal on the distribution of selected invertebrates in a littoral environment. Journal of Freshwater Ecology, 1984, 2(4): 359- 371.
[34] Gong Z J, Xie P, Wang S D. Macrozoobenthos in 2 shallow, mesotrophic Chinese lakes with contrasting sources of primary production. Journal of the North American Benthological Society, 2000, 19(4): 709- 724.
[35] 谢志才, 马凯, 叶麟, 陈静, 蔡庆华. 保安湖大型底栖动物结构与分布格局研究. 水生生物学报, 2007, 31(2): 174- 183.
[36] 杨明生. 武汉市南湖大型底栖动物群落结构与生态功能的研究 [D]. 武汉: 华中农业大学, 2009.
Impacts of habitat environment on trophic niches of a local population: a case study of yellow catfish
SHA Yongcui1,2, ZHANG Peiyu1,2, ZHANG Huan1,2, SU Guohuan1,2, XU Jun1,*
1InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan430072,China2UniversityofChineseAcademyofSciences,Beijing108000,China
Ecological niche is fundamental to study ecology which characterizes the relational position of a species within an ecosystem and comprises species habitat requirements as well as its functional role. It was first proposed by naturalist Joseph Grinnell in 1917 who emphasized the response of species to multitude of environmental requirements. Elton described the niche as “the status of an animal in its community” who stressed the impact of species on the environment. GE Hutchinson defined the ecological niche as a multidimensional space with environmental variables as axes that species could survive and reproduce. The niche concept has undergone many changes after Hutchinson′s original formalization, but all alternative contemporary definitions retain the formalization of the niche as a multidimensional space. The trophic niches describing about the spectrum of consumers within the food webs and the trophic position has proven more tractable than other niche dimensions and often use dietary diversity to assess niche width. Stable isotopes especially carbon and nitrogen which are tightly linked to their diet are widely used to quantify the trophic niche. Resource richness, availability and interactions between organisms are among the factors that influence animals′ trophic niches, but recently, the investigation concerning the impacts of habitat environment on trophic niches is very limited.In the present study, we used the convex hull occupied by all species in δ13C versus δ15N bi-plot space to represent the total extent of trophic diversity within a food web. In order to make the metrics of the isotopic niche comparable, we converted the stable isotope ratios to diet proportions using mixing models. Using stable isotope analysis and correlation analysis, we calculated the total trophic niche widths and correlation coefficients between the habitat environmental factors such as ammonia nitrogen, nitrite nitrogen, nitrate nitrogen, total nitrogen, dissolved total nitrogen, soluble reactive phosphatesalt, total phosphorus, dissolved total phosphorus, chlorophyll a and the trophic niches of high trophic position fish yellow catfish respectively. The results show that the total trophic niches of yellow catfish reach maximum value in June and down to minimum value in November. Meanwhile, the percentage of planktonivory and benthivory is relatively high in spring but changes to a high percentage of piscivory later in the season. The correlation analysis indicates that there are no direct correlations between environmental factors and trophic niches, but some of environment factors can influence the subentry trophic niche (planktonivory, benthivory and piscivory). The ammonia nitrogen, nitrate nitrogen, total nitrogen, dissolved total nitrogen and dissolved total phosphorus perform a significant positive correlation to planktonivory while ammonia nitrogen, nitrate nitrogen, total nitrogen, dissolved total nitrogen and dissolved total phosphorus show a significant negative correlation to piscivory. However, benthivory is mainly affected by dissolved total phosphorus and is significantly and positively correlated with it.In conclusion, the total trophic niches of yellow catfish are mainly affected by food resources abundance, availability and interspecific or intraspecific interactions but the impact of habitat environment on three subentry trophic niches is significant. Seasonal changes of water environmental factors influence the distribution of fish bait in water body and then affect the dietary composition of fish.
habitat environment; trophic niche; planktonivory; benthivory; piscivory
国家自然科学基金(31170439, 31370473)
2013- 05- 12;
日期:2014- 04- 17
10.5846/stxb201305121024
*通讯作者Corresponding author.E-mail: xujun@ihb.ac.cn
沙永翠,张培育,张欢,苏国欢,徐军.栖息地环境对种群营养生态位的影响——以黄颡鱼为例.生态学报,2015,35(5):1321- 1328.
Sha Y C, Zhang P Y, Zhang H, Su G H, Xu J.Impacts of habitat environment on trophic niches of a local population: a case study of yellow catfish.Acta Ecologica Sinica,2015,35(5):1321- 1328.
