垂体腺瘤组织中NF-κB、MMP-9、MICA的表达变化及意义
2015-03-11陈正常映薇李珍珠孙其凯王清波李泽福滨州医学院附属医院山东滨州56600滨州医学院烟台校区
陈正,常映薇,李珍珠,孙其凯,王清波,李泽福(滨州医学院附属医院,山东滨州56600;滨州医学院烟台校区)
·论著·
垂体腺瘤组织中NF-κB、MMP-9、MICA的表达变化及意义
陈正1,常映薇2,李珍珠1,孙其凯1,王清波1,李泽福1(1滨州医学院附属医院,山东滨州256600;2滨州医学院烟台校区)
摘要:目的观察垂体腺瘤组织中NF-κB、基质金属蛋白酶9(MMP-9)、MHC-Ⅰ类链分子相关抗原A(MICA)的表达变化,并探讨其意义。方法采用免疫组化法对垂体腺瘤组织和正常脑组织中的NF-κB蛋白、MMP-9蛋白及MICA蛋白进行检测;采用qRT-PCR法对垂体腺瘤组织及正常脑组织中的NF-κB mRNA、MMP-9 mRNA、MICA mRNA进行检测。结果 垂体腺瘤与正常脑组织中NF-κB蛋白阳性表达率分别为100%(40/40)、30%(6/20),MMP-9蛋白阳性表达率分别为100%(40/40)、15%(3/20),MICA蛋白阳性表达率分别为100%(40/40)、0;两组比较,P均<0.01。垂体腺瘤与正常脑组织中NF-κB mRNA相对表达量分别为13.045±6.200、2.040±2.067,MMP-9 mRNA相对表达量分别为28.770±7.661、2.369±1.460,MICA mRNA相对表达量分别为231.817±41.046、5.062±3.849;两组比较,P均<0.05。NF-κB蛋白与MICA蛋白、MMP-9蛋白表达均呈正相关(r分别为0.368、0.345,P均<0.05)。结论NF-κB、MMP-9及MICA在垂体腺瘤组织中高表达,NF-κB可能通过促进MMP-9及MICA表达而促进垂体腺瘤发生、发展。
关键词:垂体瘤;MHC-Ⅰ类链分子相关抗原A;基质金属蛋白酶9;核转录因子-κB
垂体腺瘤来源于上皮肿瘤,其发生发展与机体的免疫状态密切相关,是一个涉及多基因、多阶段的复杂变化过程。NF-κB是重要的一种核转录因子,作为信号传导途径的中枢,参与炎症、免疫、细胞增殖及凋亡等多种过程的基因调控[1],可上调包括MHC-Ⅰ类链分子相关抗原A (MICA)、基质金属蛋白酶-9(MMP-9)等在内的多种蛋白表达。MICA作为非经典HLAⅠ类分子, 在多数上皮性肿瘤细胞表面表达[2],MICA蛋白在体内有两种存在形式,即位于细胞膜表面的膜型MICA蛋白(mMICA)和被分泌入肿瘤微环境及血液中的分泌型MICA蛋白(sMICA)[3]。sMICA可由基质金属蛋白酶(MMPs)水解mMICA产生[4]。mMICA与NKG2D结合可介导免疫系统对肿瘤细胞产生细胞毒作用,而sMICA与NKG2D结合可抑制NKG2D在NK细胞的表达,不仅降低了NK细胞的细胞毒活性,还导致NK细胞分泌细胞因子的能力降低,从而使肿瘤发生免疫逃逸[5]。MMP-9是MMPs家族的一种重要明胶酶,是降解细胞外基质的关键酶[6],同时MMP-9参与MICA-NKG2D的肿瘤免疫逃逸过程。本研究观察了垂体腺瘤组织中NF-κB、MMP-9、MICA的表达变化,并探讨其意义。现将结果报告如下。
1资料与方法
1.1临床资料2011年6月~2013年12月滨州医学院附属医院神经外科收治的垂体腺瘤患者40例(观察组),男24例、女16例,年龄25~78岁。患者均无免疫相关性疾病,术前未使用免疫抑制类药物。均经病理检查确诊。组织学类型为泌乳素型垂体腺瘤。40例患者均接受手术切除并留取肿瘤组织。另取10例高血压脑水肿患者因脑出血需颅内减压手术的正常脑组织作为对照组。该研究征得滨州医学院附属医院伦理委员会同意。
1.2NF-κB、MMP-9、MICA蛋白检测方法采用免疫组化法。兔抗人NF-κB(Cell Signaling),兔抗人MICA(abcam),兔抗人MMP-9(abcam),羊抗兔二抗(武汉博士德公司)。RNA提取试剂,逆转录酶,dNTP,Taq DNA聚合酶(TAKARA公司)。所有标本用10%甲醛固定,石蜡包埋,4 μm厚连续切片,经常规脱蜡至水后,室温下,3%过氧化氢灭活内源性过氧化物酶10 min,蒸馏水洗3次,0.01 mol/L柠檬酸钠(pH 6.0)抗原修复液微波修复抗原,冷却至室温,PBS洗2次。滴加5%BSA封闭液,室温20 min,然后滴加兔抗人NF-κB抗体(1∶800),MICA(1∶100),4 ℃过夜。按兔IgG免疫组化试剂盒SABC即用型滴加生物素化山羊抗兔IgG,37 ℃、30 min,PBS洗3次。滴加SABC,37 ℃、20 min,PBS洗4次。最后DAB显色,苏木精轻度复染,脱水,透明,封片。显微镜下观察。用已知阳性片作为阳性对照,PBS 代替一抗作为阴性对照。MICA蛋白染色阳性信号位于胞膜和胞质,NF-κB蛋白定位于胞质和胞核,MMP-9蛋白主要定位于细胞质。免疫组化染色分级标准以阳性细胞的百分比和着色强度评分:无着色为0分,淡黄色为1分,棕黄色或褐黄色为2分。阳性细胞百分比评分:阳性细胞<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。两个分值相加为免疫组化染色的最终评分,并按下述标准分级:0分为阴性(-),2分为弱阳性(+),3~4分为中度阳性(++),5分为强阳性(+++),+、++、+++判为阳性。
1.3NF-κB、MMP-9、MICA mRNA检测方法采用qRT-PCR法。按TRIzol试剂说明书提取组织中的总RNA。cDNA合成逆转录反应体系10 μL。NF-κB(p65)引物扩增产物110 bp,上游引物5′-ACCCCTCCCTACGCAGAC-3′,下游引物5′-TTTCTCCTCAATCCGGTGAC-3′;MICA引物扩增产物98 bp,上游引物:5′-AACCCTGACTGCACAGATCC-3′,下游引物:5′-ATCTTCCCTTTTGCACCTCC-3′;MMP-9引物扩增产物166 bp,上游引物5′-ACGGCAGAGAGCATTGTGTA-3′,下游引物5′-CCTGTAGCGTAAGAGCCAGAG-3′;β-actin引物扩增产物135 bp,上游引物:5′-CCAACTGGGACGACAT-3′,下游引物:5′-TCTGGGTCATCTTCTCG-3′(上海生工)。进行荧光定量PCR反应,反应体系20 μL,两步法PCR扩增标准程序:95 ℃预变性30 s。PCR反应:95 ℃、5 s,60 ℃、20 s,融解曲线分析。以β-actin为内参照,计算NF-κB、MMP-9、MICA mRNA相对表达量。
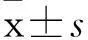
2结果
2.1两组NF-κB蛋白、MMP-9蛋白、MICA蛋白表达比较NF-κB(p65)蛋白主要表达于细胞的胞质,少量的细胞会有核染色,观察组与对照组NF-κB(p65)蛋白阳性表达率分别为100%(40/40)、30%(6/20),MICA蛋白表达于胞质和胞膜,MMP-9蛋白阳性表达率分别为100%(40/40)、15%(3/20),MICA蛋白表达于胞质和胞膜,MICA蛋白阳性表达率分别为100%(40/40)、0;两组比较,P均<0.01。
2.2两组NF-κB、MMP-9、MICA mRNA表达比较观察组与对照组NF-κB mRNA相对表达量分别为13.045±6.200、2.040±2.067,MMP-9 mRNA相对表达量分别为28.770±7.661、2.369±1.460,MICA mRNA相对表达量分别为231.817±41.046、5.062±3.849;两组比较,P均<0.05。
2.3NF-κB蛋白、MICA蛋白与MMP-9蛋白表达的关系NF-κB蛋白与MICA蛋白、MMP-9蛋白表达均呈正相关(r分别为0.368、0.345,P均<0.05)。
3讨论

NF-κB是由Rel/NF-κB家族的多肽成员组成的一组转录因子。当细胞受到外信号刺激后,IκB激酶复合体(IκB kinase IKK)活化将IκB磷酸化,使NF-κB暴露核定为位点。游离的NF-κB迅速移位至细胞核,与特异性κB序列结合,诱导相关基因转录[10]。近年来研究[11]表明,NF-κB与肿瘤的发生发展密切相关。NF-κB可以上调多种细胞因子表达,如肿瘤坏死因子[12]、基质金属蛋白酶[13]、血管内皮生长因子[14]等。Lin等[15]发现,通过肿瘤坏死因子可上调人内皮细胞表面的免疫配体MICA,这种激活上调被控制在转录水平,是由130 bp MICA转录起始位点上游的一个位点控制,这个位点能使NF-κB通路和热休克通路在NF-κB蛋白活化时对细胞表面的MICA产生强烈影响。另外,Molinero等[1]研究表明,MICA基因第1内含子含有转录因子NF-κB结合位点,Hela细胞转染NF-κB基因后能上调MICA蛋白表达,而NF-κB抑制剂PDTC能抑制MICA蛋白表达,这说明MICA可能是NF-κB的下游基因。另外,研究[1,16]发现,MAPK通路、DNA损伤反应通路均能调控MICA基因表达,而这些通路的活化都能激活NF-κB表达,这表明NF-κB可能通过多条通路对MICA基因表达进行调控。本研究中,垂体腺瘤组织中的NF-κB阳性表达率明显高于正常脑组织。提示NF-κB可能是垂体腺瘤发生、发展的重要机制之一。有关NF-κB在垂体腺瘤中的作用机制尚不清楚,目前研究显示NF-κB可能通过调控MICA及MMP-9对垂体腺瘤产生影响。
基质金属蛋白酶(MMPs)是蛋白水解酶中最重要的金属酶之一,通过对细胞外基质的降解促进肿瘤细胞向周围组织侵袭,能促进肿瘤细胞增殖,抑制凋亡等[17]。MMP-9在其启动子区含有转录因子NF-κB的结合位点,是NF-κB的下游基因,与组织发生、伤口愈合及肿瘤的侵润转移密切相关[18]。Turner等[19]发现,在侵袭性垂体腺瘤中MMP-9的表达明显高于非侵袭性垂体腺瘤,推测MMP-9表达可能与垂体腺瘤的复发跟侵袭性有关。近年研究证实,在口腔鳞癌[20]、人骨肉瘤[21]以及结肠癌[22]等肿瘤细胞中,MMP-9能使MICA蛋白脱落水解形成sMICA,从而使肿瘤进行免疫逃逸,说明MMPs对MICA蛋白的水解脱落起重要作用。MICA蛋白在体内有两种存在形式,即位于细胞膜表面的模型MICA蛋白(mMICA)和被分泌入肿瘤微环境及血液中的分泌型MICA蛋白(sMICA)。在多数肿瘤中,虽然总的MICA(包括mMICA与sMICA)表达上调,但其固有免疫仍处于抑制状态。其原因在于mMICA脱落成为sMICA,并且sMICA与NKG2D结合后抑制了NKG2D在NK细胞的表达,不仅降低了NK细胞的细胞毒活性,还导致分泌细胞因子的能力降低,促使肿瘤发生免疫逃逸。本研究中,MMP-9在垂体腺瘤的表达明显高于正常组织,垂体腺瘤患者外周血清中MMP-9、sMICA水平明显高于正常人。我们推测在垂体腺瘤中MMP-9可促进MICA蛋白水解脱落为sMICA,并且MICA与MMP-9均是受NF-κB调控的靶基因,垂体腺瘤中的MICA、MMP-9表达可能也受NF-κB的调控。本研究结果显示,NF-κB表达与MMP-9表达与有明显的正相关性,NF-κB表达与MICA的表达呈明显正相关,我们推测在垂体腺瘤中,NF-κB的活化一方面促使MICA蛋白高表达,一方面诱导MMP-9高表达来水解MICA蛋白,使其脱落为sMICA,促进肿瘤细胞的免疫逃逸。NF-κB、MMP-9、MICA三者的共同作用对垂体腺瘤的发展起到重要作用。MICA-NKG2D在机体抗肿瘤免疫中起到了重要作用,如何提高免疫效应细胞表面的NKG2D受体密度及提高肿瘤细胞表面MICA蛋白的表达,并且抑制MICA蛋白脱落形成sMICA成为避免肿瘤细胞免疫逃逸的一条新路径。本研究为NF-κB可能对垂体腺瘤中MICA蛋白的表达及脱落的调控作用这一设想提供了组织学基础,我们将继续在细胞水平对这一设想进行验证。
参考文献:
[1] Molinero LL, Fuertes MB, Girart MV, et al. NF-κB regulates expression of the MHC class I-related chain A gene in activated T lymphocytes[J]. J Immunol, 2004,173(9):5583-5590.
[2] Ling Y, Yang Y, Lu N, et al. Endostar, a novel recombinant human endostatin, exerts antiangiogenic effect via blocking VEGF-induced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J]. Biochem Biophys Res Commun, 2007,361(1):79-84.
[3] Waldhauer I, Goehlsdorf D, Gieseke F, et al. Tumor-associated MICA is shed by ADAM proteases [J]. Cancer Research, 2008,68(15):6368-6376.
[4] Sun D, Wang X, Zhang H, et al. MMP9 mediates MICA shedding in human osteosarcomas[J]. Cell Biol Int, 2011,35(6):569-574.
[5] Carbone E, Neri P, Mesuraca M, et al. HLA class I, NKG2D, and natural cytotoxicity receptors regulate multiple myeloma cell recognition by natural killer cells [J]. Blood, 2005,105(1):251-258.
[6] Liu Y, Yin H, Zhao M, et al. TLR2 and TLR4 in Autoimmune Diseases: a Comprehensive Review[J]. Clin Rev Allergy Immunol, 2014,47(2):136-147.
[7] Molitch ME, Russell EJ. The pituitary incidentaloma [J]. Ann Intern Med, 1990,112(12):925-931.
[8] Ma L, Li G, Su Y, et al. The soluble major histocompatibility complex class I-related chain A protein reduced NKG2D expression on natural killer and T cells from patients with prolactinoma and non-secreting pituitary adenoma [J]. J Clin Neurosci, 2010,17(2):241-247.
[9] Hayakawa Y. Targeting NKG2D in tumor surveillance [J]. Expert Opin Ther Targets, 2012,16(6):587-599.
[10] Molinero LL, Fuertes MB, Girart MV, et al. NF-κB regulates expression of the MHC class I-related chain A gene in activated T lymphocytes [J]. J Immunol, 2004,173(9): 5583-5590.
[11] Karin M. Nuclear factor-κB in cancer development and progression [J]. Nature, 2006,441(7092):431-436.
[12] Luo JL, Maeda S, Hsu LC, et al. Inhibition of NF-κB in cancer cells converts inflammation-induced tumor growth mediated by TNFα to TRAIL-mediated tumor regression[J]. Cancer cell, 2004,6(3):297-305.
[13] Sánchez AJ, Puerta C, Ballester S, et al. Rolipram impairs NF-κB activity and MMP-9 expression in experimental autoimmune encephalomyelitis [J]. J Neuroimmunol, 2005,168(1):13-20.
[14] Grosjean J, Kiriakidis S, Reilly K, et al. Vascular endothelial growth factor signalling in endothelial cell survival: a role for NFκB [J]. Biochem Biophys Res Commun, 2006,340(3):984-994.
[15] Lin D, Lavender H, Soilleux EJ, et al. NF-κB regulates MICA gene transcription in endothelial cell through a genetically inhibitable control site [J]. J Biol Chem, 2012,287(6):4299-4310.
[16] Gasser S, Orsulic S, Brown EJ, et al. The DNA damage pathway regulates innate immune system ligands of the NKG2D receptor [J]. Nature, 2005,436(7054):1186-1190.
[17] Abdallah MW, Pearce BD, Larsen N, et al. Amniotic Fluid MMP-9 and Neurotrophins in Autism Spectrum Disorders: An Exploratory Study[J]. Autism Research, 2012,5(6):428-433.
[18] Meyer E, Vollmer JY, Bovey R, et al. Matrix metalloproteinases 9 and 10 inhibit protein kinase C-potentiated, p53-mediated apoptosis[J]. Cancer research, 2005,65(10):4261-4272.
[19] Turner HE, Nagy ZS, Esiri MM, et al. Role of matrix metalloproteinase 9 in pituitary tumor behavior[J]. J Clin Endocrinol Metab, 2000,85(8):2931-2935.
[20] Lee BK, Kim MJ, Jang HS, et al. A high concentration of MMP-2/gelatinase A and MMP-9/gelatinase B reduce NK cell-mediated cytotoxicity against an oral squamous cell carcinoma cell line [J]. In Vivo, 2008,22(5):593-597.
[21] Sun D, Wang X, Zhang H, et al. MMP9 mediates MICA shedding in human osteosarcomas [J]. Cell Biol Int, 2011,35(6):569-574.
[22] 周太成,杨劭宇,罗宏图,等.MMP-9介导结肠癌细胞sMICA蛋白脱落的研究[J].岭南现代临床外科,2013,13(4):315-317.
Expression and significance of NF-kappa B, MMP-9, MICA in pituitary adenoma tissues
CHENZheng1, CHANG Ying-wei, LI Zhen-zhu, SUN Qi-kai, WANG Qing-bo, LI Ze-fu
(1AffiliatedHospitalofBinzhouMedicalCollege,Binzhou256600)
Abstract:Objective The aim of this study was to examine the expression levels of NF-κB, MMP-9, and MICA and to explore its significance. MethodsWe examined the association between NF-κB, MMP-9, and MICA by immunohistochemical staining, Quantitative real-time PCR. ResultsThe positive rate of NF-κB were 100%(40/40), 30%(6/20)in pituitary adenomas and normal brain tissue. The positive rate of MMP-9 were 100%(40/40),15%(3/20)in pituitary adenomas and normal brain tissue. The positive rate of MICA were 100%(40/40), 0 in pituitary adenomas and normal brain tissues(P<0.05). Relative to express the NF-κB mRNA were 13.045±6.2, 2.04±2.067 in pituitary adenomas and normal brain tissues. Relative to express the MMP-9 mRNA were 28.77±7.661, 2.369±1.46 in pituitary adenomas and normal brain tissues. Relative to express the MICA mRNA were 231.817±41.046, 5.062±3.849 in pituitary adenomas and normal brain tissues(P<0.05). The expression levels of NF-κB, MMP-9, and MICA were positively related in patients with pituitary adenomas (r=0.368,0.345,P<0.05). ConclusionsNF-κB, MMP-9, and MICA are highly expressed in pituitary adenomas tissues. High levels of NF-κB by promoting the expression of MMP-9 and MICA promote the development of pituitary adenomas.
Key words:Pituitary adenomas;MHC- Ⅰ kind of chain molecules related antigen A;matrix metalloproteinase 9;nuclear transcription-κB
(收稿日期:2014-10-21)
通信作者简介:李泽福(1969-),男,主任医师,研究方向为垂体瘤的免疫治疗。E-mail:lizefu163@163.com
作者简介:第一陈正(1988-),男,在读研究生,研究方向为垂体瘤的免疫治疗。E-mail:wide6087235@163.com
基金项目:国家自然科学基金资助项目(81171119)。
中图分类号:R736.4
文献标志码:A
文章编号:1002-266X(2015)03-0001-04
doi:10.3969/j.issn.1002-266X.2015.03.001
