牛支原体氟喹诺酮类药物耐药靶位突变分析
2015-03-11贾博岩赵立峰高铎孔令聪刘树明王春凤马红霞
贾博岩,赵立峰,高铎,2,孔令聪,刘树明,王春凤,马红霞, 3*
(1.吉林农业大学动物科技学院,长春 130118; 2.辽宁省兽药饲料畜产品质量安全检测中心,辽宁 110000 ; 3.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春 130118)
牛支原体氟喹诺酮类药物耐药靶位突变分析
贾博岩1,赵立峰1,高铎1,2,孔令聪1,刘树明1,王春凤1,马红霞1, 3*
(1.吉林农业大学动物科技学院,长春 130118; 2.辽宁省兽药饲料畜产品质量安全检测中心,辽宁 110000 ; 3.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春 130118)
为探讨牛支原体氟喹诺酮类药物耐药靶位的突变情况,对分离自我国多个省份的牛支原体进行氟喹诺酮类药物耐药性检测和耐药株筛选,通过对临床分离敏感株、耐药株及体外诱导高度耐药株的氟喹诺酮类药物耐药决定区(QRDR)进行测序分析,发现分离菌株中有19%(6/32株)对氟喹诺酮类药物耐药,其QRDR中均存在gyrA(Ser83Phe)或parC(Ser80Ile)的氨基酸突变;但在体外诱导的高度耐药株中QRDR突变类型则以gyrA(Ser83Phe/Tyr或Glu87Lys)和parC(Ser80Ile或Asp84Asn/Tyr)的氨基酸发生突变为主,以上靶位突变在介导牛支原体对氟喹诺酮类药物耐药水平方面是否起着决定性作用,还有待进一步证明。
牛支原体;氟喹诺酮类药物;靶位突变
牛支原体(Mycoplasmabovis,M.bovis)是引起牛呼吸系统疾病的(Bovine respiratory disease,BRD)主要病原之一[1],该病原引发的疾病主要采用大环内酯类、氟喹诺酮类、四环素类抗生素进行治疗[2]。但随着抗生素在兽医临床上的广泛使用,导致M.bovis对上述药物逐渐产生了耐药性。近年来,牛支原体病主要治疗药物的耐药性所引起的抗感染失败给我国畜牧养殖业造成了较严重的经济损失[3]。
氟喹诺酮类药物是80年代兴起的一类广谱抗菌药物,由于其在临床应用时间相对较短,临床分离菌对其相对敏感,日益受到兽医临床工作者的青睐。国外,Sato T等[4]对从日本奶牛厂分离的M.bovis进行氟喹诺酮类药物耐药性检测及耐药机制的研究;国内,张利等[5]对从重庆分离的M.bovis进行耐药情况的监测,但尚未有相关耐药QRDR靶位研究的报道。为此,本文以从我国临床分离的M.bovis为研究对象,在对其进行氟喹诺酮类药物耐药性检测的基础上,对其QRDR靶位突变进行分析,为阐明我国临床分离M.bovis对氟喹诺酮类药物的耐药机制提供佐证。
1 材料与方法
1.1 菌种 32株M.bovis分离自我国江苏、贵州、湖南、广西、内蒙、吉林等9个省份,并由吉林农业大学动物科技学院兽医药理与毒理实验室保存。
1.2 主要试剂及药品 PPLO肉汤培养基,青岛海博生物技术有限责任公司;DMEM培养基,Invitrogen生命科技有限公司;酵母粉、琼脂等,北京鼎国生物技术有限责任公司;ExTaqTMDNA聚合酶、dNTPs、pMD18-T载体试剂盒、DL 1000TMDNA Marker,大连TakaRa有限公司;细菌基因组DNA快速抽提试剂盒、PCR产物纯化试剂盒、丙酮酸钠,生工生物工程(上海)股份有限公司;环丙沙星、恩诺沙星、诺氟沙星,中国食品药品检定研究院。
1.3 药物敏感性试验 采用改良微量稀释法检测临床分离的M.bovis对环丙沙星、恩诺沙星、诺氟沙星三种氟喹诺酮类药物的最低抑菌浓度(Minimal inhibitory concentration,MIC),并以大肠杆菌ATCC®25922和M.bovis标准株PG45作为质控株,判定结果参照BRD其他病原的CLSI标准,MIC≥4 μg/mL判定为耐药[6-7]。
1.4 体外高度耐药株的诱导 将来自临床分离的对氟喹诺酮类药物敏感的5株M.bovis分别接种于含有1/8 MIC的环丙沙星、恩诺沙星和诺氟沙星的PPLO(含10%胎马血清)液体培养基内,37 ℃培养2~3 d后观察结果,若培养基颜色由红色变为澄清的黄色,再将其接种于含有1/4MIC药物的液体培养基中。以上述药物浓度的2倍依次递增,直至其药物浓度达到64 μg/mL及以上。诱导中若M.bovis在某药物浓度下未生长或生长状态欠佳,则降低药物浓度重新诱导[8-10]。
1.5 稳定耐药试验 将经体外诱导获得的对氟喹诺酮类药物高度耐药的M.bovis接种于无药物压力的培养基中传代5次,再应用改良微量稀释法测定其诱导药物的MIC值,筛选耐药性稳定的M.bovis[8-10]。
1.6 交叉耐药试验 采用改良微量稀释法检测体外诱导的对氟喹诺酮类药物高度耐药的M.bovis对3种氟喹诺酮类药物的交叉耐药性[8-10]。
1.7 QRDR靶位突变检测 提取氟喹诺酮敏感株、耐药株及体外诱导株的基因组,参照文献方法[11]合成gyrA、gyrB、parC和parE的 QRDR基因引物,进行PCR反应。PCR反应条件如下:95 ℃预变性3 min,(95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,30个循环),72 ℃总延伸10 min,10 ℃保存。将PCR产物经回收纯化后进行T-A克隆,筛选出重组阳性质粒,并将含有重组阳性质粒的大肠杆菌菌液送至生工生物工程(上海)股份有限公司进行测序,采用DNAMAN软件对测序结果进行对比分析。
2 结果
2.1 药物敏感性试验结果 临床分离的M.bovis对三种氟喹诺酮类药物MIC值的检测结果表明,有6株(19%)M.bovis对氟喹诺酮类药物耐药(MIC为4或8 μg/mL),其他菌株均对氟喹诺酮类药物相对敏感,MIC值测定结果见表1。
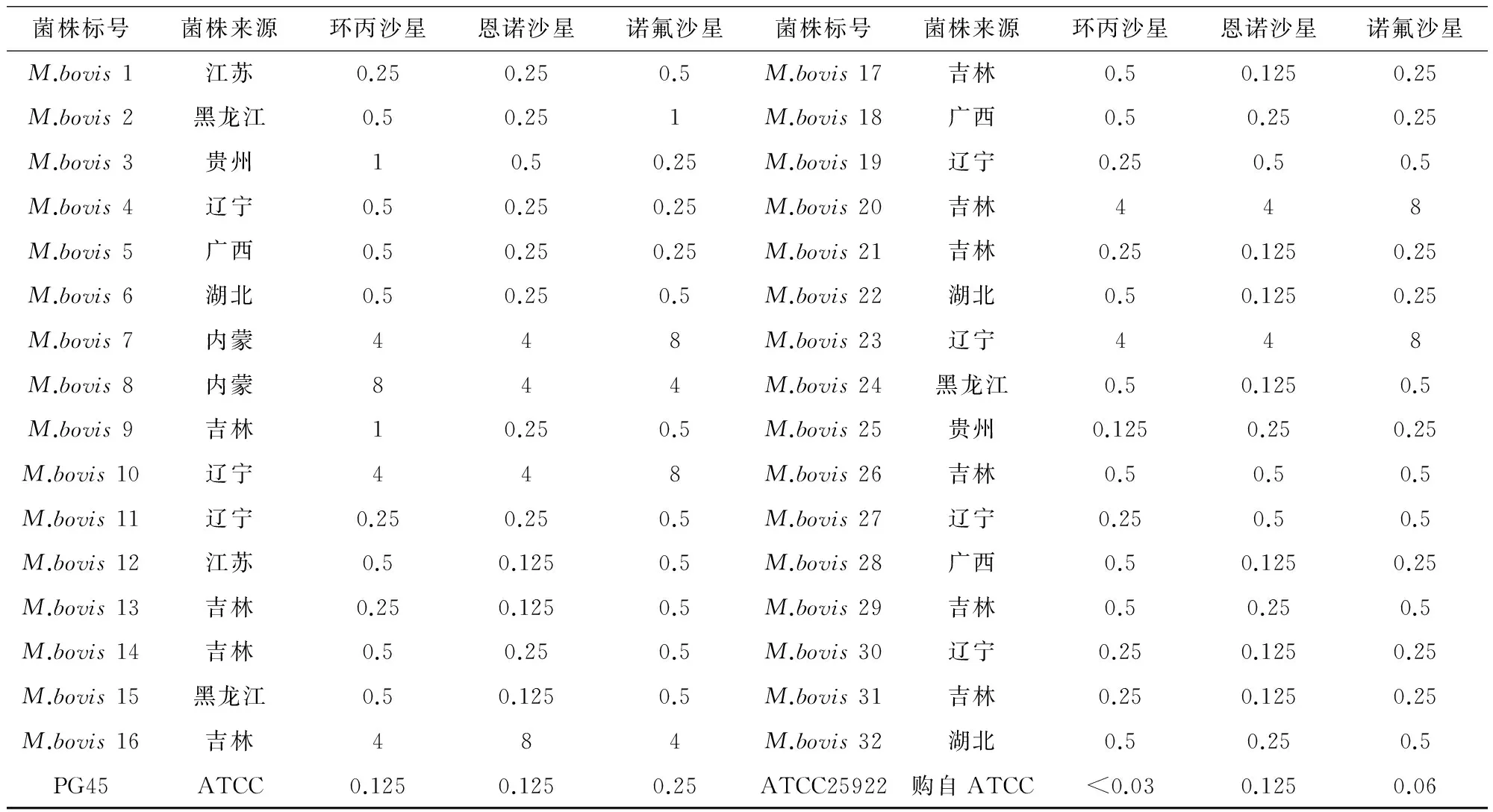
表1 32株M.bovis对三种氟喹诺酮类药物MIC测定结果(μg/mL)
2.2 体外耐药株筛选及交叉耐药性检测 将经体外诱导获得的对一种氟喹诺酮类药物高度耐药的M.bovis进行无药物压力培养,共筛选到15株高度耐药M.bovis,且其它两种氟喹诺酮类药物均存在交叉耐药现象,结果见表2。
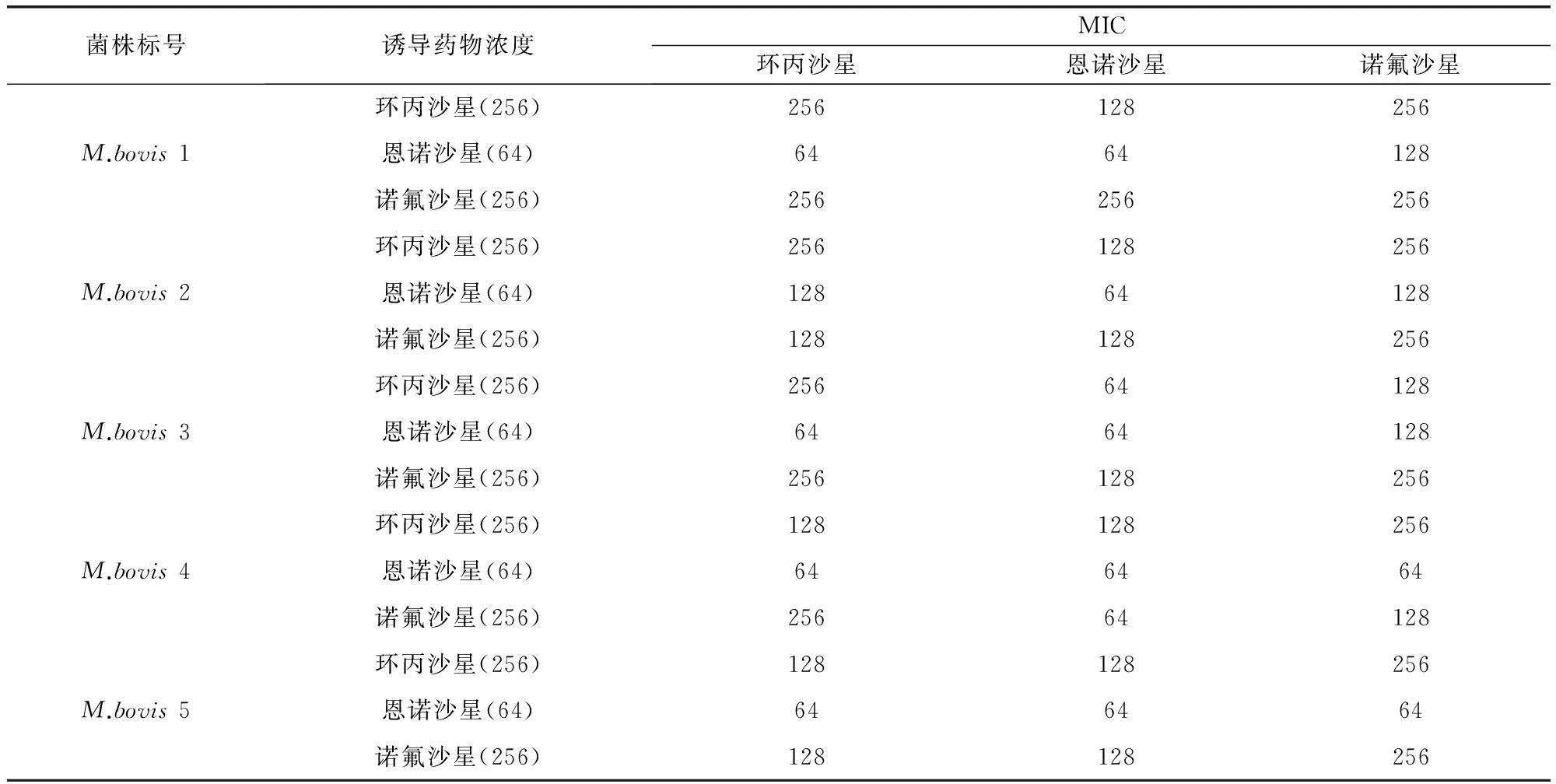
表2 体外诱导株稳定耐药性及交叉耐药性检测结果 (μg/mL)
2.3 QRDR突变分析 对临床分离的M.bovis氟喹诺酮类药物敏感株、耐药株及体外诱导获得的高度耐药株进行氟喹诺酮类药物耐药靶位(gyrA、gyrB、parC、parE)突变分析,结果表明,临床分离的氟喹诺酮类药物敏感株在parC的QRDR中均存在(GAC84GAT)的无意义碱基的突变,即未导致其编码的氨基酸发生突变;临床分离的6株对氟喹诺酮类药物耐药的M.bovis在gyrA或parC的QRDR中存在(TCT83TTT)或(AGT80ATT)的碱基突变,进而导致其所对应的(Ser83Phe)或(Ser80Ile)的氨基酸发生突变,且上述耐药株的耐药水平相对较低;体外诱导对氟喹诺酮类药物高度耐药的15株M.bovis在gyrA和parC的QRDR中存在[(TCT83TTT/TAT)或 (GAA87AAA)]和 [(AGT80ATT)或(GAT84AAT/TAT) ]的碱基突变,进而导致其所对应的(Ser83Phe/Tyr或Glu87Lys)和(Ser80Ile或Asp84Asn/Tyr)的氨基酸发生突变,且上述体外诱导的M.bovis的耐药水平相对较高(表3-表4)。
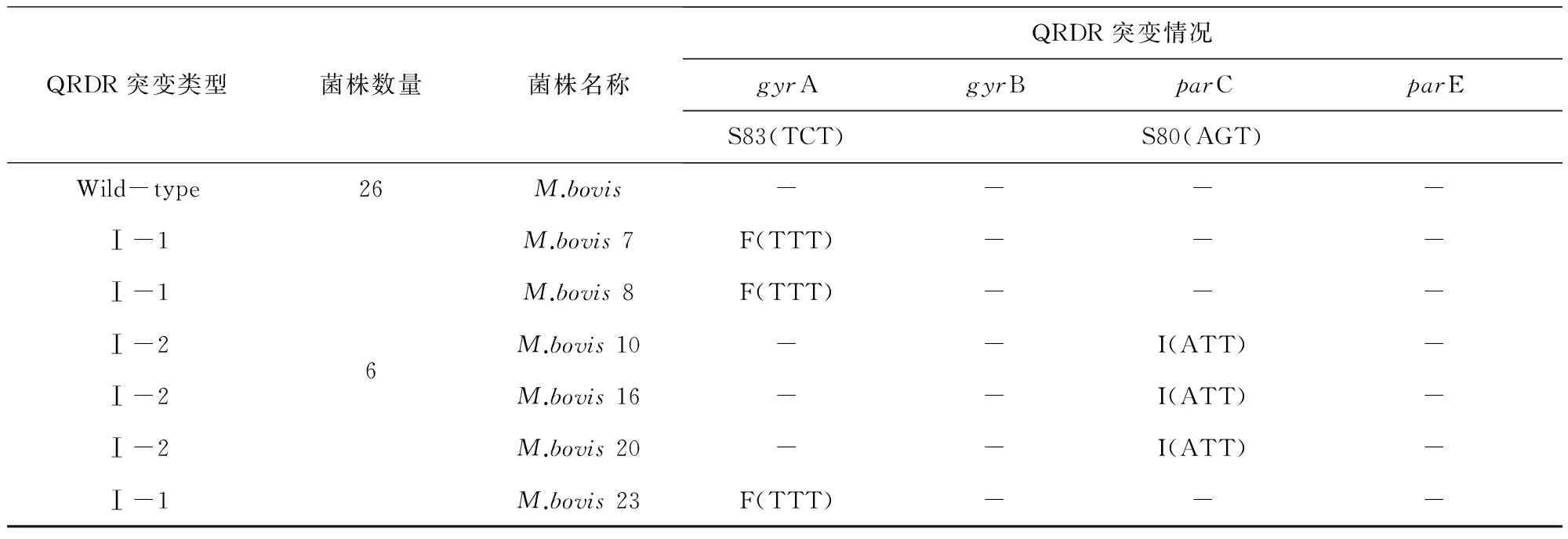
表3 临床分离的32株M.bovis的QRDR突变情况
S:Ser; F:Phe;I:Ile;-:未发生氨基酸置换;Ⅰ:在QRDR中有一个氨基酸发生置换;Ⅰ-1、Ⅰ-2:在QRDR中均有一个氨基酸位点发生突变,两者氨基酸的突变位点不同

表4 体外诱导的对氟喹诺酮类药物高度耐药的15株M.bovis 的QRDR突变情况
S, F, I,- ,Ⅰ:见表3标注; E:Glu; D:Asp; K:Lys; N:Asn; Y:Tyr ; CIP:ciprofloxacin 环丙沙星; ENR:enrofloxacin 恩诺沙星;NOR:norfloxacin 诺氟沙星;Ⅱ,Ⅲ分别代表:在QRDR中有2个,3个氨基酸发生置换;Ⅱ-1、Ⅱ-2、Ⅱ-3、Ⅱ-4、Ⅱ-5分别代表:在QRDR中均有两个氨基酸位点发生突变,五者氨基酸的突变位点不同
3 讨论与小结
试验以从我国东北、华中、华南、华东、西南、西北等地区的9个省份所分离的M.bovis为基础,进一步对其氟喹诺酮类药物的敏感性进行检测,结果表明,我国临床分离的M.bovis均对氟喹诺酮类药物较为敏感,但从内蒙、吉林、辽宁三省分离的部分M.bovis已对氟喹诺酮类药物产生了耐药性(其MIC为4或8μg/mL),分离的耐药菌株占此次临床分离M.bovis的19%。此结果与Lysnyansky I等和Sato T等的报道基本一致,此两组研究人员在以色列和日本检测到的M.bovis耐药率分别为有26%和12%,且MIC值均较低(MIC≤16μg/mL)[4,11]。试验通过体外诱导证实若M.bovis持续处于此类药物的药物压力下则容易出现氟喹诺酮类药物高度耐药株,故建议兽医临床应合理、科学、正确的使用氟喹诺酮类药物,控制其耐药性的产生和蔓延。
本试验进一步对临床分离的M.bovis氟喹诺酮类药物敏感株、耐药株及体外诱导高度耐药株进行了QRDR靶位突变分析。结果发现,临床分离的氟喹诺酮类药物敏感株在QRDR未发生氨基酸突变;临床分离的对氟喹诺酮类药物低度耐药的6株M.bovis在gyrA或parC的 QRDR中存在单一氨基酸突变点,即Ⅰ型突变;体外诱导的对氟喹诺酮类药物高度耐药的15株M.bovis在gyrA和parC 的QRDR存在两个或三个氨基酸突变点,其共有6种突变类型(Ⅱ-1-5型、Ⅲ型),并以两个氨基酸突变点的Ⅱ-1型[gyrA(Ser83Phe)和parC(Ser80Ile)]和Ⅱ-3型[gyrA(Glu87Lys)和parC(Ser80Ile)]较为普遍。据此推测,当gyrA或parC的QRDR发生(Ser83Phe)或(Ser80Ile)单一氨基酸突变可介导M.bovis对氟喹诺酮类药物产生耐药性,且当gyrA和parC的QRDR同时发生(Ser83Phe/Tyr或Glu87Lys)和(Ser80Ile或Asp84Asn/Tyr)氨基酸突变可能介导M.bovis对氟喹诺酮类药物高度耐药。此结论与Sato T等的报道有所不同,该研究团队发现临床分离的部分M.bovis氟喹诺酮类药物敏感株在gyrA的QRDR中检测到Ser83Phe的氨基酸突变,且推断parC的氨基酸突变是导致M.bovis对氟喹诺酮类药物耐药的主要原因[4],但本试验临床分离的M.bovis氟喹诺酮类药物敏感株在gyrA的QRDR中未检测到氨基酸的突变。总之,M.bovis是否还存在其他耐药机制仍有待于进一步研究。
[1] 高铎,孔令聪,王梓,等.牛支原体的分离鉴定及其体外药物敏感性分析[J].中国兽药杂志,2014,48(3): 66-68.
[2] 吴仪谋,叶元康.支原体学[M].人民卫生出版社,2008: 16-25.
[3] 孔令聪,张春艳,高云航,等.牛支原体耐药性研究进展[J].中国兽药杂志,2013,47(9): 63-66.
[4] Sato T,Okubo T,Usui M,etal.Amino acid substitutions in GyrA and ParC are associated with fluoroquinolone resistance inMycoplasmabovisisolates from Japanese dairy calves[J].Journal of Veterinary Medical Science,2013,75(8): 1063-1065.
[5] 张利,李玉平,黎晓敏.牛支原体药物敏感性试验[J].动物医学进展,2012,33: 110-113.
[6] Clinical and Laboratory Standards Insitute.Performance standards for antimicrobial susceptibility testing: approved standard[M].CLSI document,2012: M100-S22.
[7] Soehnlen M K,Kunze M E,Karunathilake K E,etal.Invitroantimicrobial inhibition ofMycoplasmabovisisolates submitted to the pennsylvania animal diagnostic laboratory using flow cytometry and a broth microdilution method[J].Journal of Veterinary Diagnostic Investigation,2011,23(3): 547-551.
[8] 孔令聪.牛源荚膜血清A型多杀性巴氏杆菌的分离鉴定及对喹诺酮类抗生素耐药机制研究[D].吉林农业大学,2013.
[9] 叶萍,邓超干,王辉,等.体外诱导人型支原体对氟喹诺酮类药物耐药的实验研究[J].重庆医学,2009,38(6): 659-660.
[10]刘轶秋,吴聪明,沈建忠,等.3种禽源支原体替米考星耐药株的体外诱导及23S rRNA基因V域碱基突变分析[J].畜牧兽医学报,2011,42(7): 981-987.
[11]Lysnyansky I,Mikula I,Gerchman I,etal.Rapid detection of a point mutation in theparC gene associated with decreased susceptibility to fluoroquinolones inMycoplasmabovis[J].Antimicrob Agents Chemother,2009,53(11): 4911-4914.
(编辑:陈希)
Quinolones Resistance Targeted Mutation Analysis ofMycoplasmabovis
JIA Bo-yan1,ZHAO Li-feng1,GAO Duo1,2,KONG Ling-cong1,LIU Shu-ming1,WANG Chun-feng1,MA Hong-xia1,3*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China; 2.LiaoningProvinceQualityInspectionandTestcenterforVeterinaryDrugfeedandAnimalproduct,Liaoning110000,China; 3.AnimalProduction&ProductQualityandSecurity,MinistryofEducation,JilinAgriculturalUniversity,Changchun130118,China)
In order to discuss the quinolones resistance targeted mutation analysis ofMycoplasmabovis.In this study,Mycoplasmabovisisolated from several provinces were tested on quinolone resistance and quinolone resistant strains were screened.The quinolone resistance determining region(QRDR) of clinical isolates sensitive ,resistant strains and resistant strains induced in vitro were sequenced.The results showed that 19%isolates strains (6/32) were resistant to quinolones,and it was found that the resistant strains possess Ser83Phe in gyrA or ser80Ile In parC.But it found that the QRDR mutation types based ongyrA(Ser83Phe/Tyr or Glu87Lys) and parC(Ser80Ile or Asp84Asn/Tyr)in laboratory -derived resistantMycoplasmabovis.The above targeted mutation either whether paly an important role in mediating the quinolone resistance level ofMycoplasmaboviswill remains to be further proved.
Mycoplasmabovis; quinolone; targeted mutation
国家自然科学基金项目(31272611); 吉林省科技发展计划项目任务书(20150101109JC)
贾博岩,硕士研究生,从事动物药理和毒理学方面研究;赵立峰,高级兽医师,从事兽医临床方面研究,与贾博岩为并列第一作者。
马红霞。E-mail:hongxia0731001@163.com
2015-08-11
A
1002-1280 (2015) 12-0001-05
S852.62
