宁夏地区鸡源耐药性大肠杆菌Ⅰ类整合子的研究
2015-03-11周学章刘成敏
杨 聪,周学章,杜 军,刘成敏,2
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏 银川750021;2.宁夏大学科技成果转化中心,宁夏 银川750021)
细菌对抗生素耐药和多重耐药已成为全球关注的问题。目前认为整合子-基因盒系统,是细菌多重耐药快速发展的一个不容忽视的原因。细菌通过整合子系统,在整合酶作用下,捕获外来耐药基因,并在启动子作用下得到表达,使细菌具有耐药及多重耐药性[1]。目前大肠杆菌Ⅰ类整合子研究较多,但对鸡源大肠杆菌的研究相对较少。以宁夏某地区的30株临床分离的鸡源大肠杆菌为研究对象,对其耐药情况、整合子分布及其结构特征等进行研究,为指导临床合理使用抗生素,控制耐药菌株在禽类间的传播提供理论基础。
1 材料与方法
1.1 菌株 宁夏地区临床分离鸡源大肠杆菌30株,质控菌株为大肠杆菌ATCC25922。
1.2 试剂 Taq DNA聚合酶,2 kb DNAMarke,购自北京全式金生物技术有限公司。药敏纸片共12种:阿莫西林(AMO,10μg/片)、青霉素G(PEN,10μg/片)、头孢噻肟(CTX,30μg/片)、头孢曲松(CRO,30 μg/片)、卡那霉素(KAN,30μg/片)、庆大霉素(GEN,10μg/片)、氯霉素(CHL,30μg/片)、环丙沙星(CIP,5μg/片)、氧氟沙星(OFL,20μg/片);四环素(TET,30μg/片)、林可霉素(LIN,15μg/片)、磺胺甲氧嘧啶(SMD,5μg/片)。
1.3 药敏试验 按照美国临床实验室标准化委员会(NCCLS)推荐的纸片扩散法进行操作和结果判定。
1.4 引物序列 根据GenBank收录的Ⅰ类整合子的序列,参考吴聪明等设计扩增Ⅰ类整合酶基因(Int1Ⅰ)、可变区(基因盒)的引物,引物序列见表1。

表1 Ⅰ类整合子的PCR扩增引物序列
1.5 Ⅰ类整合子的检测
1.5.1 Ⅰ类整合酶基因的检测 用煮沸裂解法提取模版DNA;PCR反应体系为25μL:上、下游引物个0.5μL(10μmol/L);模版DNA 2μL;2×Trans Taq PCRmix 12.5μL;最后加ddH2O至25μL。反应条件为:95℃预变性5 min,94℃变性1 min,57.5℃退火30 s,72℃延伸30 s,扩增30个循环;72℃后延伸10min,4℃保温。PCR产物以2%琼脂糖凝胶电泳检测。
1.5.2 Ⅰ类整合子基因盒插入区的检测 基因盒插入区的检测采用降落PCR(TD-PCR)方法,以提高PCR反应的特异性,反应体系为:95℃预变性5min,94℃变性30 s,65.5℃退火30 s,72℃延伸2min,2个循环;以后每2个循环退火温度降低1℃,退火温度从65.5℃降落到56.5℃;94℃变性30 s,56.5℃退火30 s,72℃延伸30 s,12个循环;72℃后延伸10min,4℃保温。取适量扩增产物以0.8%琼脂糖凝胶进行电泳,用凝胶成像系统观察拍照分析。
1.6 整合子可变区扩增产物测序 将Ⅰ类整合子基因盒的PCR产物经JET quick PCR Product purificationkit纯化后进行DNA测序(北京生物工程公司完成),结果在GenBank数据库中采用BLAST软件进行同源性分析。
1.7 统计方法 根据Ⅰ类整合酶基因的检测结果,将大肠杆菌分为整合子阳性组和阴性组。采用SPSS 10.0统计软件对整合子阳性组和阴性组的药敏情况进行统计学分析。
2 结果
2.1 对药物的敏感性 30株鸡源大肠杆菌对临床常用的抗菌药存在严重的耐药性。耐药率如表2所示。30株临床分离菌株均为耐3种以上不同类抗生素的多重耐药菌株,多重耐药率为100%,耐药菌株多集中在对7~12种抗生素耐药(图2)。

表2 抗生素对临床分离菌株的敏感性
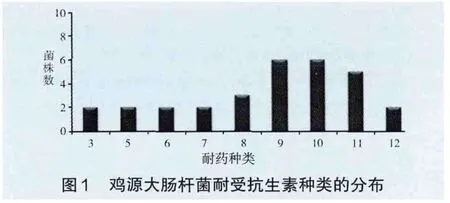
图1 鸡源大肠杆菌耐受抗生素种类的分布
2.2 Ⅰ类整合酶基因在鸡源大肠杆菌中的分布情况 PCR扩增产物片段大小与预期相符,为280 bp,经测序其与GenBank中(GQ900749)公布的Ⅰ型整合酶基因序列同源性为100%。其中有20株菌携带Int1Ⅰ,检出率为66.7%,表明Ⅰ型整合子在鸡源大肠杆菌中普遍存在。
2.3 整合酶阳性菌株与耐药菌株的相关性分析
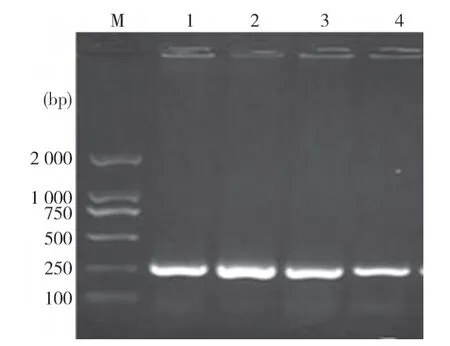
图2 Ⅰ类整合酶基因PCR电泳图
对药敏试验的结果进行分析发现四环素、林可霉素、头孢噻肟/克拉维酸和头孢曲松在整合子阳性组的耐药率明显高于阴性组,并具有统计学意义(P<0.05)。其他抗菌药在两组间的差别无统计学意义(P>0.05),但是在整合子阳性组的耐药率高于整合子的阴性组,见表3。

表3 整合子阳性和阴性组药敏表型
2.4 基因盒插入区PCR的检测结果 20株intI1阳性菌株中共有15株为基因盒阳性菌株,阳性率为75%,部分电泳结果见图3。测序后发现共两种基因盒类型,分别命名为A和B。A类基因盒大小为1 750 bp,与GenBank已公布序列进行对比。结果显示,A类基因盒与GenBank公布的EF488368.1序列中基因盒插入区的序列符合率为98%,其排列为dfr17+aadA5,分别编码Ⅰ型二氢叶酸还原酶和氨基糖-3′-腺苷转移酶的耐药基因。B类基因盒与GenBank公布的FJ266018.1序列中基因盒插入区的序列符合率为99%,大小为1 989 bp,B类基因盒的排列为dhfr+aadA2,分别编码二氢叶酸还原酶和氨基糖-3’-腺苷转移酶的耐药基因。

图3 基因盒插入基因PCR产物的电泳图谱
20株整合酶阳性菌株中,检出A类基因盒的菌株有10株,检出率为50%;仅5株检出B类基因盒,检出率为20%;基因盒阳性在所有菌株中的检出率50%。基因盒阳性菌株与多药耐药关系见图4;耐抗生素种类在8个以上的均为基因盒阳性菌株。

3 讨论
近年来由于抗菌药物的广泛应用,使得人医临床和兽医临床大量出现耐药性细菌,很多细菌甚至对数10种抗菌药物都耐药,这给治疗带来极大的困难。目前,整合子系统所介导的细菌的耐药机制对多药耐药性研究具有重要的意义[2]。细菌在发生水平转移和产生耐药机制的主要途径就是依靠整合子来完成的。
大肠杆菌是人兽共患的一种条件致病菌。有报道称,敏感株的基因变异或者耐药基因的水平传递等都是大肠杆菌多重耐药的主要原因[3],临床检出的耐药大肠杆菌中多数都含有整合子结构,且以Ⅰ类整合子为主[4]。据文献报道,欧美国家不同来源的肠杆菌中有近43%的菌株中含有整合子存在,其中第Ⅰ类整合子占耐药菌株的75%[5],本研究结果显示,30株临床分离的菌株中,20株具有整合酶基因,检出率为66.7%,这一结果与国内外多数结果相似[6-7],说明鸡源大肠杆菌中第Ⅰ类整合酶基因普遍存在。整合酶阳性菌株与耐药菌株的相关性结果分析,发现整合子阳性组的耐药率明显高于阴性组。可见Ⅰ类整合子的阳性检出率与大肠杆菌的多重耐药性密切相关。
Ⅰ型整合子的可变区大小在1 000~3 000 bp,可有种类、数量、结合方式和部位都不相同的基因盒[8],从而决定着细菌对不同抗菌药物的耐药性。本试验中Ⅰ类整合子检测结果与药敏试验的数据对比发现,基因盒阳性菌株均表现出对8耐以上的多重耐药性,共得到两种基因盒类型,均编码二氢叶酸还原酶和氨基糖-3′-腺苷转移酶的耐药基因,且这两种基因分别介导磺胺类药物和氨基糖苷类药物耐药,同文献报道相同[9]。有报道称大肠杆菌整合子携带基因盒种类与细菌的耐药表型并不完全一致[10],本试验显示菌株均呈现多重耐药性,耐药谱包括了氨基糖苷类、磺胺类、β-内酰胺类、四环素类、大环内酯类等,而检出的耐药基因盒主要表达对磺胺类和氨基糖苷类药物耐药,其他耐药基因盒并未检出,说明Ⅰ类整合子虽然广泛存在于鸡源大肠杆菌中,但并非细菌产生多重耐药性的惟一因素。本研究结果显示,在宁夏地区,鸡源大肠杆菌对临床常用的抗菌药物存在严重的耐药性,整合子检出率较高,而且与细菌的耐药性有密切关系。
[1] Recchia G D,Hall R M.Origin of themobile gene cassettes found in integrons[J].TrendsMicrobio,1997,5(10):389-394.
[2] 魏取好,蔣晓飞,吕元.细菌整合子研究进展[J].中国抗生素杂志,2008,33(1):1-5.
[3]Leverstein-van Hall M A,Box ATA,Blok HEM,et al.Evidence of extensive interspecies transfer of integron-mediated antimicrobial resistance genes among multidrug-resistant Entero bacteriaceae in a clinical setting[J].JInfect Dis,2002,186:49-56.
[4] Gu B,Pan S,Wang T,et al.Novel cassette arrays of integrons in clinical strains of Enterobacteriaceae in China[J].Int JAntimicrob Agents,2008,32(6):529-533.
[5]Chang C Y,Chang L L,Chang Y H,et al.Characeterization of drug resistance gene cassettes associated with class 1 integrons in clinical isolates of Escherichia coli from Taiwan,ROC[J].JMed Microbiol,2000,49:1097-1102.
[6]刘衡川,兰全学.多重耐药大肠埃希菌中Ⅰ类整合子的研究[J].中国感染与化疗杂志,2006,6(3):189-192.
[7]Cathy G,Margie D L,Susan S,et al.1Incidence of Class 1 and class2 integrases in clinical and commensal bacteria from livestock,companion animals and exotics[J].Antimicrob Agents Chemother,2001,45(3):723-7261.
[8] Leveoqoue C,Piche L,Larose,et al.PCR mapping of integrons reveals several novel combinations of resistance genes[J].Antimicrob AgentsChemother,1995,39(1):185-195.
[9]李劲松,钱菊娣,项领,等.医院感染革兰阴性杆菌中整合子介导耐药及水平播散机制研究[J].中华医院感染学杂志,2008,18(12):1651-1655.
[10]Machado E,Canton R,Baquero F,et al.Integron content of extended-spectrum-β-lactamase-producing Escherichia coli strains over 12 years in a single hospital in Madrid,Spain[J].Antimicrob Agents Chemother,2005,49(5):1823-1829.
