载脂蛋白E 对EAE 星形胶质细胞的影响
2015-03-11杨程程韦俊杰唐玉兰郑明华韦云飞
杨程程,韦俊杰,唐玉兰,郑明华,韦云飞
多发性硬化(Multiple Sclerosis,MS)是以中枢神经系统(CNS)慢性炎性脱髓鞘为主要特征的自身免疫性疾病。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是研究MS 常用的动物模型。我们之前的研究发现,载脂蛋白E(apolipoprotein E,apoE)可以减轻EAE 髓鞘和轴突的损伤[1],抑制Th1 和Th17 细胞的免疫应答[2],下调CD4+T 细胞的表达[3],对EAE 小鼠有神经保护作用。水通道蛋白4(aquaporins 4,AQP4)和胶质纤维酸性蛋白(glial fibrillary acdic protein,GFAP)均表达于CNS 星形胶质细胞,与星形胶质细胞水肿、增生有关,但apoE 对EAE 小鼠星形胶质细胞AQP4、GFAP 的表达是否有影响?作用机制如何?目前尚未见相关报道。本研究采用apoE基因敲除的C57BL/6 小鼠及野生型C57BL/6 小鼠建立EAE 模型,对神经功能缺损情况进行评分,观察大脑、脊髓病理改变及AQP4、GFAP 的表达,从而探索apoE 对EAE 病灶星形胶质细胞的作用及其机制,以期为MS 的治疗提供新思路。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组 标准化饲养的6~8 w 雌性的apoE 基因敲除C57BL/6 小鼠及野生型C57BL/6 小鼠,体重18~20 g,北京华阜康生物科技股份有限公司提供。20 只野生型C57BL/6 小鼠随机分成普通EAE 组及正常对照组,每组各10 只;10只apoE 基因敲除小鼠作为apoE-/-EAE 组。
1.1.2 主要试剂 髓鞘少突胶质细胞糖蛋白(MOG35-55,纯度>95%,上海生工生物工程有限公司);百日咳毒素(PTX)、完全弗氏佐剂(CFA)(Sigma 公司);卡介苗(Difco 公司);兔抗小鼠AQP4 多克隆抗体(武汉博士德有限公司);兔抗小鼠GFAP多克隆抗体、SP 法免疫组化试剂盒、DAB 显色试剂盒(北京中杉金桥有限公司)。
1.2 方法
1.2.1 制备完全抗原及建立EAE 模型 用0.01 mol/L的磷酸盐缓冲液将MOG35-55 稀释成2 mg/ml,与等量含6 mg/ml 卡介苗的CFA 充分混合,全玻璃注射器抽打至呈油包水乳状,制成完全抗原。普通EAE 组及apoE-/-EAE 组分别于小鼠背部皮下多点注射完全抗原0.2 ml/只,正常对照组以等量生理盐水代替。免疫当天为0 d,分别于0、2 d给apoE-/-EAE 组及普通EAE 组小鼠腹腔注射PTX0.5 g/次。
1.2.2 神经功能缺损评分 免疫后每天上午由同一人对小鼠进行神经功能缺损评分,测量体重并记录。采用7 分评分法。0 分:不发病;1 分:尾巴半瘫;2 分:尾巴全瘫;3 分:步态异常;4 分:后肢轻瘫;5 分:后肢重瘫;6 分:前肢受累;7 分:濒死或死亡。
1.2.3 解剖及病理染色 免疫诱导后35 d,麻醉小鼠,经左心室插管灌注生理盐水,继以4%多聚甲醛缓冲液灌注。断头,分离大脑和脊髓,4%多聚甲醛4℃中固定24 h,逐级予乙醇脱水、二甲苯透明、石蜡包埋,连续切片4 μm,行HE 染色,观察病理学变化。
1.2.4 免疫组化 取上述蜡块行4 μm 连续切片,按SP 法免疫组化试剂盒说明书操作,显微镜下观察大脑和脊髓AQP4、GFAP 的表达,阴性对照用PBS 取代一抗。细胞膜或细胞质呈黄色或棕黄色为阳性表达.每只小鼠的大脑和脊髓各取3 张切片,每张切片取互不重复的5 个高倍视野(×200 倍),应用Image-proplus 6.0 软件测量每个高倍视野的积分光密度值(IOD)和阳性表达面积(area),计算平均积分光密度(IOD/area)。
1.2.5 统计学方法 采用SPSS 16.0 统计软件分析数据,正态计量资料以±s 表示,非正态计量资料以组中值(M)和95%可信区间(95%CI)表示;两个独立样本均数的比较用成组t 检验,多组间均数的比较用单因素方差分析,组间差异用SNK 检验(方差齐时)或Games-Howell 检验(方差不齐时),以P<0.05为差异有统计学意义。
2 结果
2.1 发病情况 apoE-/-EAE 组和普通EAE 组于免疫后11 d 相继发病,症状随时间延长而逐渐加重。两组潜伏期比较无统计学意义(P>0.05)。临床功能缺损评分峰值apoE-/-EAE 组显著高于普通EAE 组(P<0.05)(见表1)。正常对照组无小鼠发病,活动度正常。
2.2 HE 染色 apoE-/-EAE 组和普通EAE 组小鼠大脑、脊髓的小血管周围均发现炎性细胞浸润,典型者呈“袖套样”改变,其中apoE-/-EAE 组的上述病理学改变明显重于普通EAE 组(见图1)。正常对照组大脑和脊髓未见异常。
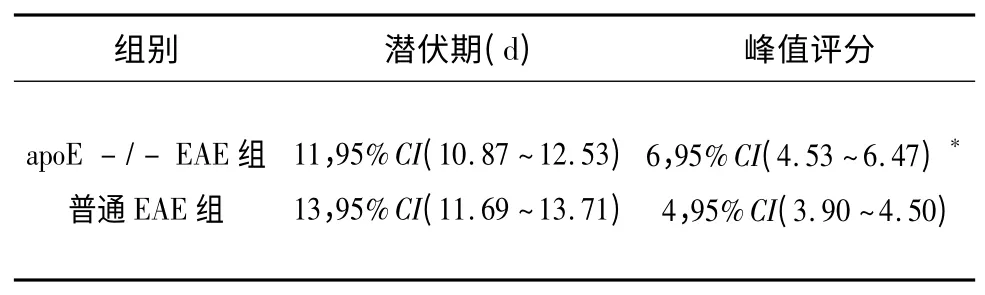
表1 临床症状观察(M,95%CI)
表2 AQP4 在小鼠大脑、脊髓中的表达(±s)
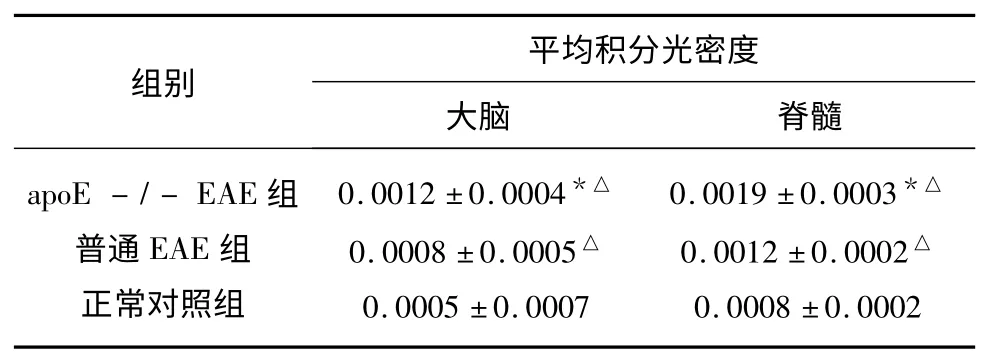
表2 AQP4 在小鼠大脑、脊髓中的表达(±s)
与普通EAE 组比较* P<0.05;与正常对照组比较△P<0.05
表3 GFAP 在小鼠大脑、脊髓中的表达(±s)
与普通EAE 组比较* P<0.05;与正常对照组比较△P<0.05
2.3 各组AQP4 的表达比较 通过免疫组化测定各组织AQP4 的平均积分光密度,发现:apoE-/-EAE 组和普通EAE 组大脑、脊髓中AQP4 的表达量均高于正常对照组,差异均有统计学意义(P<0.05);apoE-/-EAE 组大脑和脊髓AQP4 表达量均高于普通EAE 组,差异均有统计学意义(P<0.05)(见表2、图2)。
2.4 各组GFAP 的表达比较 通过免疫组化测定各组织GFAP 的平均积分光密度,发现:apoE-/-EAE 组和普通EAE 组大脑、脊髓中GFAP 的表达量均高于正常对照组,差异均有统计学意义(P<0.05);apoE-/-EAE 组大脑和脊髓GFAP 表达量均高于普通EAE 组,差异均有统计学意义(P<0.05)(见表3、图3)。
3 讨论
星形胶质细胞是神经元的卫星细胞,对神经元起支持作用,参与血脑屏障(blood-brain barrier,BBB)的形成。apoE 在CNS 主要由星形胶质细胞合成,主要功能是调节CNS 脂类代谢,此外还可以通过下调中枢神经系统炎症反应、减轻氧化应激等机制,发挥神经保护作用[4]。Chiasserini 等报道,apoE在MS 患者中有不同程度的下降[5];而且我们前期研究发现,apoE 拟肽可以减轻EAE 的临床症状和炎性浸润[2]。本研究结果显示,apoE-/-EAE 组较普通EAE 组神经功能缺损加重,病理检查可见血管周围炎性细胞浸润增多,与国内外报道相符。进一步证明了apoE 缺乏可加重EAE 对小鼠造成的神经功能损害。
AQP4 是水通道蛋白家族的一员,在CNS 表达于星形胶质细胞的足突,主要功能是介导水分子转运。本研究结果显示,AQP4 在普通EAE 组的表达较正常对照组显著增高,与Miyamoto 的报道一致[6],表明EAE 中存在星形胶质细胞水肿。我们还发现,与普通EAE 组相比,apoE-/-EAE 组中AQP4 表达水平显著升高,提示apoE 缺乏可以加重EAE 星形胶质细胞水肿。AQP4 有介导水跨膜转运和促进前炎性细胞因子分泌的特性[7],而apoE 缺乏造成了AQP4 的表达升高。因此我们推测,高表达的AQP4 一方面通过正反馈调节,促使更多水分子进入星形胶质细胞,使其体积增大、内压升高,进而形成细胞毒性水肿,甚至导致星形胶质细胞破裂;另一方面也增强了促炎性细胞因子的分泌。加之apoE 缺乏会增加EAE 小鼠基质金属蛋白酶-9 活性[8],有可能影响BBB 的功能,这些作用共同加重了EAE 星形胶质细胞的水肿。
GFAP 为星形胶质细胞的骨架蛋白,其表达的高低可反映星形胶质细胞增生及坏死的程度。有研究报道,在MS/EAE 病灶中心和边缘,有反应性星形胶质细胞聚积[9]。反应性星形胶质细胞在MS/EAE 中发挥双重作用:虽然它在血管周围形成瘢痕样屏障,限制炎症细胞侵入CNS,但病灶周围胶质过多,也阻碍了少突胶质细胞迁移至病灶产生新髓鞘;并且小胶质细胞随之激活,可导致神经细胞二次损伤。可见,胶质细胞过多可恶化EAE 病情。本研究发现,GFAP 在普通EAE 组的表达较正常对照组显著增高,与国内外报道一致[10],表明EAE 中有星形胶质细胞增生。我们还发现,与普通EAE 组相比,apoE-/-EAE 组GFAP 表达水平更高,提示apoE缺乏加重了EAE 反应性星形胶质细胞增生,增多的星形胶质细胞易形成胶质瘢痕,恶化EAE 病情。研究表明,低密度脂蛋白受体相关蛋白(LDLR-related protein,LRP)作为apoE 的配体之一,表达于星形胶质细胞的细胞膜,与胶质细胞的激活有关[11]。我们推测,apoE 与星形胶质细胞表面的LRP 结合,直接阻碍其星形胶质细胞增生;apoE 也可能影响了细胞因子的分泌,从而间接抑制反应性星形胶质细胞增殖。另外,AQP4 可以加快星形胶质细胞迁移[6]。我们认为apoE 也可能通过减少AQP4 的生成,使质膜的水通透性减弱,从而阻碍星形胶质细胞的迁移,抑制其在病灶周围聚集形成胶质瘢痕,改善EAE 病情进展。
本研究结果表明,EAE 中存在星形胶质细胞水肿、增生,apoE 缺乏可以加重EAE 星形胶质细胞的水肿和增生,从而恶化EAE 的病情。因此,本研究的发现可能成为MS 治疗的切入点。但由于MS 星形胶质细胞水肿和增生的形成机制复杂,尚需进一步研究。

图2 D:apoE-/-EAE 组大脑;E:普通EAE 组大脑;F:正常对照组大脑;G:apoE-/-EAE 组脊髓;H:普通EAE 组脊髓;I:正常对照组脊髓(AQP4 免疫组化染色,×400)

图3 J:apoE-/-EAE 组大脑;K:普通EAE 组大脑;L:正常对照组大脑;M:apoE-/-EAE 组脊髓;N:普通EAE 组脊髓;O:正常对照组脊髓(GFAP 免疫组化染色,×400)
[1]韦俊杰,郑明华,梁培霄,等.载脂蛋白E 拟肽对EAE 小鼠的髓鞘和轴突损伤的影响[J].中风与神经疾病杂志,2012,10(29):872-875.
[2]Wei J,Zheng M,Liang P,et al.Apolipoprotein E and its mimetic peptide suppress Th1 and Th17 responses in experimental autoimmune encephalomyelitis[J].Neurobiol Dis,2013,56:59-65.
[3]郑明华,唐玉兰,韦俊杰,等.载脂蛋白E 拟肽对实验性自身免疫性脑脊髓炎小鼠脑脊髓CD4+、CD8+T 淋巴细胞表达的影响[J].临床神经病学杂志,2013,26(3):198-201.
[4]Zhang HL,Wu J,Zhu J.The immune-modulatory role of apolipoprotein E with emphasis on multiple sclerosis and experimental autoimmune encephalomyelitis[J].Clin Dev Immunol,2010,2010:186813.
[5]Chiasserini D,Di Filippo M,Candeliere A,et al.CSF proteome analysis in multiple sclerosis patients by two-dimensional electrophoresis[J].Eur J Neuro,2008,15(9):998-1001.
[6]Miyamoto K,Nagaosa N,Motoyama M,et al.Upregulation of water channel aquaporin-4 in experimental autoimmune encephalomyeritis[J].J Neurol Sci,2009,276(1-2):103-107.
[7]Li L,Zhang H,Varrin-Doyer M,et al.Proinflammatory role of aquaporin-4 in autoimmune neuroinflammation[J].FASEB J,2011,25(5):1556-1566.
[8]Zheng M,Wei J,Tang Y,et al.ApoE-Deficient promotes blood-brain barrier disruption in experimental autoimmune encephalomyelitis via alteration of MMP-9[J].J Mol Neurosci,2014,54(2):282-290.
[9]Voskuhl RR,Peterson RS,Song B,et al.Reactive astrocytes form scar-like perivascular barriers to leukocytes during adaptive immune inflammation of the CNS[J].J Neurosci,2009,29(37):11511-11522.
[10]Lavrnja I,Savic D,Bjelobaba I,et al.The effect of ribavirin on reactive astrogliosis in experimental autoimmune encephalomyelitis[J].J Pharmacol Sci,2012,119(3):221-232.
[11]LaDu MJ,Shah JA,Reardon CA,et al.Apolipoprotein E and apolipoprotein E receptors modulate A beta-induced glial neuroinflammatory responses[J].Neurochem Int,2001,39(5-6):427-434.
