一株耐镍寡养单胞菌的分离及鉴定
2015-03-10巫晶晶张金丽贾成光张亚平
王 鹤,巫晶晶,张金丽,王 洁,贾成光,张亚平
(1.集美大学食品与生物工程学院,福建 厦门 361021;
2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021)
一株耐镍寡养单胞菌的分离及鉴定
王鹤1,2,巫晶晶1,2,张金丽1,2,王洁1,2,贾成光1,2,张亚平1,2
(1.集美大学食品与生物工程学院,福建 厦门 361021;
2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021)
[摘要]从福建某五金厂综合污水中筛选到一株对Ni2+耐受性400 mg/L的菌株,对其形态学、16S rDNA序列及生理生化特征进行分析,并利用较佳生长条件对所得菌株进行Ni2+吸附验证.结果表明:该菌为革兰氏阴性杆菌,在牛肉膏蛋白胨培养基上形成的菌落,表面较光滑,边缘整齐;经16S rDNA序列比对及生理生化特征的分析,将菌株 JMUZJ-1鉴定为寡养单胞菌(Stenotrophomonas sp.);菌株JMUZJ-1生长的较好条件是pH 7.0,温度30 ℃,NaCl质量分数0.5%,在该条件下,菌株对Ni2+表现出良好的吸附性能.
[关键词]微生物;筛选;重金属;耐受菌;镍
0引言
20世纪以来,人类对重金属的开采、冶炼、加工及商业制造活动逐渐增多,重金属对环境的污染和破坏越来越严重[1].镍是常见的重金属污染元素之一,它主要来源于镍金属加工、电镀工艺中的镍残渣,以及在农业生产中由于人类不合理的污水灌溉、过量施用化肥等污染物被过量排放到环境中,造成重金属镍污染加剧[2-3].镍可以致癌[4],对动物或人具有明显的发育毒性和生殖毒性[5].因此,含镍废水的治理已成为环保领域中一个亟待解决的问题.
自然环境中的一些细菌、真菌及其衍生物对一些重金属离子具有良好的选择吸附性[6],如:Seker等采用盘状螺旋蓝细菌(Spirulina platensis)吸附铅、镉和镍[7];Sangeeta等用荧光假单胞菌Presudomonassp.在一定条件下Ni2+吸附量可达61.51 mg/g[8];Nikhil等用解脂耶氏酵母(Yarrowialipolytica,NCIM 3590)对重金属Ni2+进行吸附研究,得到的最大吸附量为85.45 mg/g[9].同时,重金属吸附还具有处理效率高、投资小、运行费用低等优点[10].从重金属污染水体中分离出重金属耐受细菌,具有重金属耐受性的菌株可能成为重金属污染环境中生物修复的工程菌[11],以达到处理重金属污染的目的.因此,分离和筛选具有重金属耐受性细菌,研究它们对重金属的抗性和去除作用,对促进微生物在环境治理中的应用具有重要意义.本研究从福建某五金厂综合污水中筛选对镍具有高耐受能力的菌株,并对其进行形态学、生理生化特征和分子生物学鉴定,进而确定该菌株的分类学和系统发育地位,为今后利用微生物强化治理废水中的镍污染提供菌种来源.
1材料与方法
1.1 实验材料
1)水样福建某五金厂综合污水,其中Ni、Cr、Fe、化学需氧量(CODcr)的质量浓度分别为125、20、13、335 mg/L.
2)培养基牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1000 mL,pH=7.2~7.4,配制固体培养基时向其中加入15~20 g/L的琼脂.
重金属培养基:准确配制含Ni2+10 g·L-1的重金属溶液,用纯水稀释至所需浓度,经0.22 μm的微孔滤膜过滤除菌,无菌操作加入已灭菌的培养基中.
1.2 试剂与仪器
1)主要试剂细菌基因组DNA提取试剂盒(北京百泰克生物技术有限公司);SanPrep柱式PCR产物纯化试剂盒和SanPrep柱式质粒DNA少量抽提试剂盒(上海生工生物工程股份有限公司);pMD®18-T载体(大连宝生物工程有限公司);Ni(NO3)2(优级纯),其他试剂均为分析纯.
2)主要仪器HS-1300μ型水平层流双人净化工作台(苏州净化设备有限公司);DPH-9052型电热恒温培养箱(上海浦东荣丰科学仪器有限公司);ZHWY-2112B型恒温摇床(上海智城分析仪器制造有限公司);Tgradient 96型PCR仪(德国Biometra公司);UV 5200型紫外可见分光光度计(上海元析仪器有限公司);YXQ-LS-30SII 型立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);H1650台式高速离心机(湖南湘仪实验室仪器开发有限公司).
1.3 实验方法
1.3.1耐镍菌株的筛选
取10 mL污水水样于90 mL无菌水中,即为10-1,依次梯度稀释到10-2,10-3,10-4,10-5,10-6,10-7,10-8,10-9.吸取稀释后的水样0.1 mL涂布于含30 mg/L Ni2+的固体培养基上,30 ℃培养48 h,挑取长势较好的菌落在含镍递增的培养基上多次划线分离.
1.3.2菌株的鉴定
1)菌株形态特征观察在固体牛肉膏蛋白胨培养基上接种分离到的菌株,30 ℃培养48 h,将菌株经革兰氏染色后,在显微镜下观察记录菌株的形态特征.
2)菌株的16S rDNA的鉴定利用基因组提取试剂盒提取菌株基因组DNA,以27F(5′-AGAGTTTGATCCTGGCTCAG-3′) 和1492R(5′-GGTTACCTTGTTACGACTT-3′)为引物扩增16S rDNA片段,扩增条件为:95 ℃预变性5 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,30个循环,72 ℃延伸10 min.将扩增出的16S rDNA片段纯化,与pMD®18-T载体连接后,转化感受态大肠杆菌(Escherichia coli),将转化后的大肠杆菌涂布在含有氨苄青霉素的固体培养基上,37 ℃培养过夜.挑取平板上的白色菌落接入含有氨苄青霉素的液体培养基中,37 ℃振荡培养12~16 h,使用质粒提取试剂盒提取重组质粒,然后通过质粒PCR进行阳性克隆验证;将所得到的阳性克隆大肠杆菌送至上海立菲生物技术有限公司测序.将测得的16S rDNA序列通过NCBI(美国国立生物技术信息中心)的Blast程序与GenBank数据库中已有的16S rDNA核酸序列进行相似性分析.获取同源性较高的16S rDNA序列,利用MEGA 4.0软件Neighbor Joining方法进行系统发育分析.
3)生理生化试验参照《常用细菌系统鉴定手册》[12]和《伯杰细菌鉴定手册(第八版)》[13]对菌株JMUZJ-1分别进行了15项生理生化特征鉴定:过氧化氢酶试验、明胶液化试验、淀粉水解试验、V-P试验、甲基红试验、脲酶试验、酯酶试验、吲哚试验、糖类(葡萄糖;果糖;蔗糖;麦芽糖;木糖)发酵试验、硝酸盐还原试验和柠檬酸盐利用试验.
1.3.3菌株生长特性试验
1)种子液的制备挑取活化的JMUZJ-1菌体1~2环接入装有100 mL牛肉膏蛋白胨液体培养基中,在30 ℃,120 r·min-1条件下摇床培养18 h,得到的培养液即为种子液.
2)生长曲线的测定按体积分数2%接种量向液体牛肉膏蛋白胨培养基中接入种子液,30 ℃、120 r·min-1条件下摇床培养,定时取样,经适当稀释后,测定其OD600值;同时以不接菌的液体培养基作空白对照,以培养时间为横坐标,以OD600为纵坐标,绘制菌株JMUZJ-1的生长曲线.
3)pH值、温度、盐度对菌株生长的影响在一定初始pH值、温度、盐度下,将牛肉膏蛋白胨培养基按体积分数2%的接种量接种,30 ℃、120 r·min-1摇床培养,18 h后取样,经适当稀释后测定其OD600值.
4)最小抑菌浓度(MIC)为了考察菌株JMUZJ-1对Zn2+、Cu2+、Cd2+、Cr6+等重金属离子的耐受性,每种金属配制一系列浓度递增的固体牛肉膏蛋白胨培养基,用划线法将菌株JMUZJ-1接种到平板上.30 ℃培养3~5 d,观察菌落的生长情况,确定各金属离子的最低抑菌浓度.
1.3.4Ni2+吸附实验
在一定的pH值和温度下,将湿菌体投加到已知浓度的Ni2+溶液中,120 r/min恒温振荡一定时间后,取样,8000 r/min离心10 min,用原子吸收分光光度计测定上清液中剩余Ni2+的浓度,计算去除率和吸附量.
2结果与分析
2.1 耐镍菌的分离纯化
采用浓度梯度筛选法,经过反复划线分离、多次传代培养,分离纯化到一株对Ni2+具有高耐受性的菌株,其抗性达到400 mg·L-1,命名为JMUZJ-1.该菌株在含重金属的培养基中生长周期短,具有优良的抗镍性状,其在生物治理镍污染领域存在着很大的开发应用潜力.
2.2 耐镍菌鉴定
2.2.1菌株形态特征
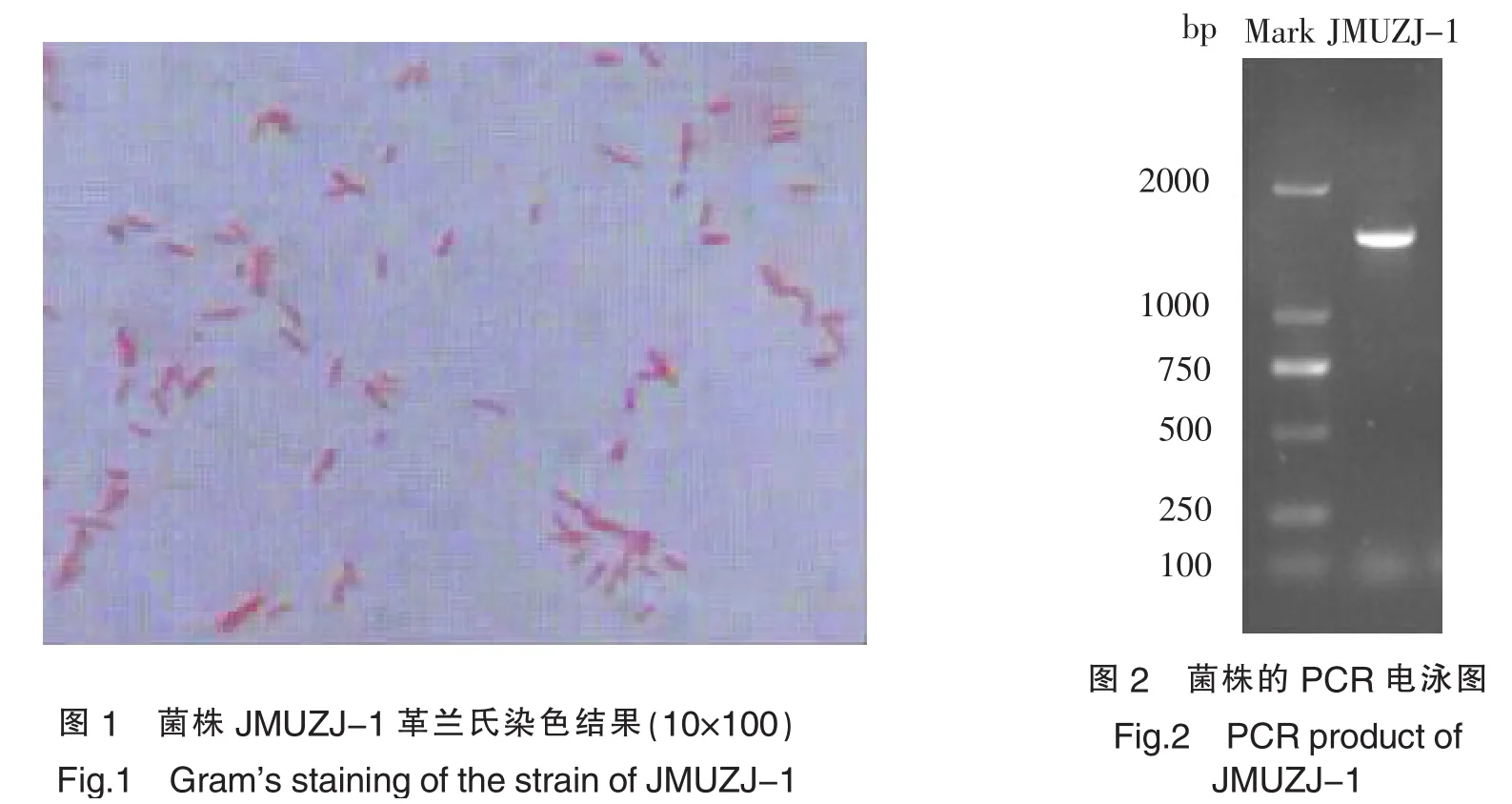
菌株JMUZJ-1在牛肉膏蛋白胨培养基上生长迅速,30 ℃培养24 h后即可形成较大的菌落,JMUZJ-1的菌落,表面光滑,有光泽,中央突起,边缘整齐.菌体的光镜照片(如图1)可见,个体呈杆状,两端钝圆,不规则分散排列.此外,菌体长短不一,推测可能是菌株处于不同的生长周期所致.
2.2.2菌株16S rDNA PCR产物电泳检测与序列分析
提取菌株JMUZJ-1的基因组DNA,以27F和1492R为引物PCR扩增该菌株的16S rDNA基因,得到一段长度在1000~2000 bp之间的目的片段(见图2).将该片段与pMD®18-T载体连接转化后得到的阳性克隆进行测序,得到菌株JMUZJ-1的16S rDNA序列长度为1507 bp.并将其提交至GenBank,获得登录号为KF286281.
2.2.3基于16S rDNA构建系统发育树
利用BLAST程序将所得基因序列与GenBank 数据库的序列进行同源性分析,结果显示,菌株JMUZJ-1的16S rDNA序列与嗜麦芽寡养单胞菌(Stenotrophomonassp.)的序列相似性达99%.获取与菌株JMUZJ-1同源性较高的序列,进行多序列比对,并利用软件MEGA4.0构建系统发育树(见图3).结果显示,菌株JMUZJ-1与Stenotrophomonas maltophiliaJN39的系统发育关系最为接近,处于同一个进化分支,因此,可初步判断该菌株属于寡养单胞菌属(Stenotrophomonassp.)

2.2.4菌株的生理生化特性
对菌株JMUZJ-1进行系列生理生化试验,结果表明:该菌株为革兰氏阴性菌,过氧化氢酶阳性,具有强解脂性,能液化明胶,但不能水解淀粉,V-P试验、甲基红试验、脲酶试验、吲哚试验、硝酸盐还原试验和柠檬酸盐利用试验均呈阴性反应.在糖类发酵中,产酸缓慢或产酸不明显,但能分解麦芽糖,产酸明显.以上这些特征与Stenotrophomonassp.的特征基本符合,结合形态学和16S rDNA的鉴定结果,将菌株JMUZJ-1鉴定为寡养单胞菌属(Stenotrophomonassp.)的一种.
2.3 菌株的生长特性试验
2.3.1菌株JMUZJ-1的生长曲线
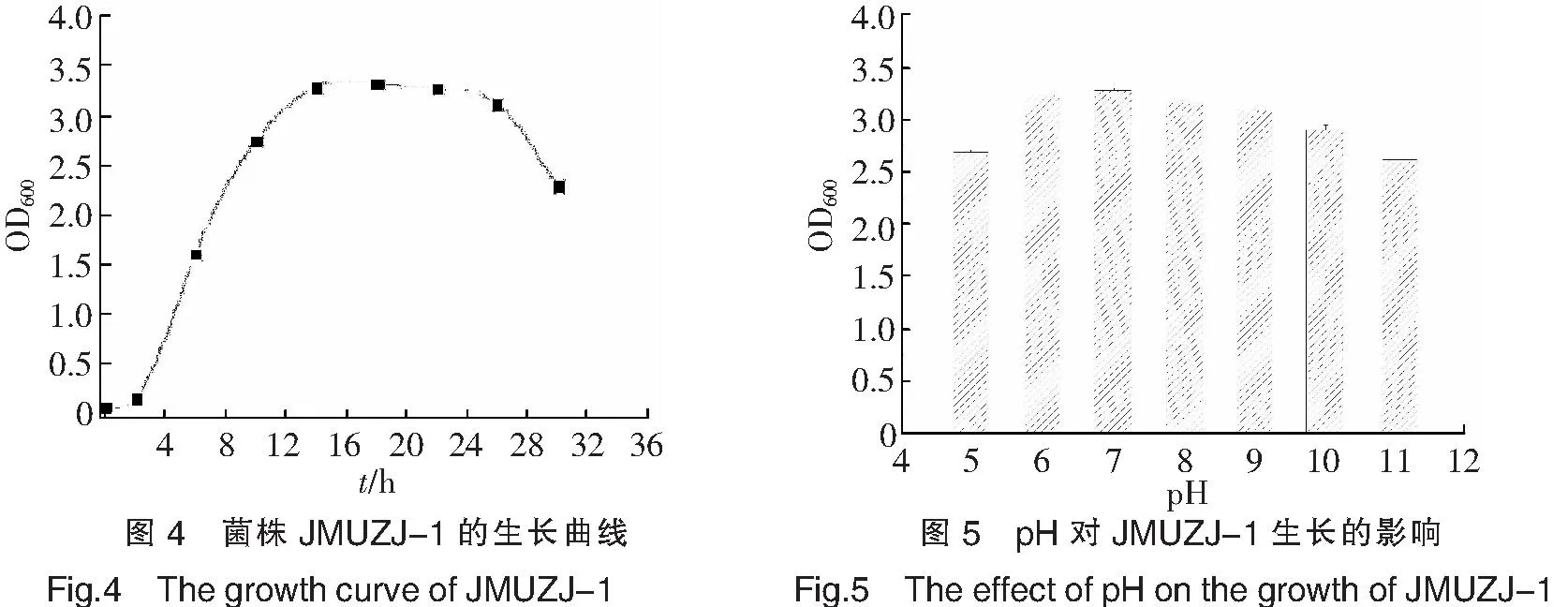
微生物的生长实际上是其自身对周围环境中各种因素的综合反应,微生物的生长规律一般通过生长曲线来反映,以表示其在不同培养条件下的生长情况及生长过程[14].细菌的生长周期可分为延滞期、对数期、稳定期和衰亡期4个阶段.由菌株JMUZJ-1的生长曲线(如图4)可以看出,菌体在0~2h之间是生长的延滞期,菌株进入到新的生长环境之后,由于缺乏足够的能量或某些必需的生长因子,导致菌体的生长受到限制,细胞的数目基本不变,但在此阶段细胞的代谢活动并不是处于停滞状态,细胞内的核酸和蛋白质等物质的含量均有所增加,因此,延滞期也可以看作是菌株对新环境的适应期.2~14h为对数生长期,此阶段细菌的代谢活动最为旺盛,菌体量呈指数递增,菌株的生长繁殖速度达到最大值.从14h开始进入稳定期,持续到26h,整个阶段细菌的生长繁殖速度等于其死亡的速度,菌体细胞的数目保持稳定,26h以后菌体的生长量开始减少,进入到衰亡期.在衰亡期,由于营养物质的大量消耗以及部分菌体自溶等因素,使菌体表现出“负增长”现象.因此,选择14~26h的培养时间不仅可以在较短的周期内获得较大的菌量,而且菌体活力也较高.
2.3.2pH值对菌株生长的影响
每种微生物一般都要在一个合适的pH值范围内才能生长繁殖.由不同pH值条件下菌株的生长量(如图5)可知,在pH值为 5.0~7.0的范围内,随着pH值的增加,菌体的生长量也增加,在pH=7.0时,菌体的生长量达到最大值,OD600值为3.283,此后随着pH值的增加,菌体的生长量有所下降.但总体来看,菌株JMUZJ-1具有宽泛的pH值生长范围,在pH=5.0~11.0范围内均能较好地生长,其OD600值都在2.5以上,推测可能是菌株通过自身的生理代谢活动来调节周围环境的pH值,使pH值维持在一个合适的生长范围.
2.3.3温度对菌株生长的影响
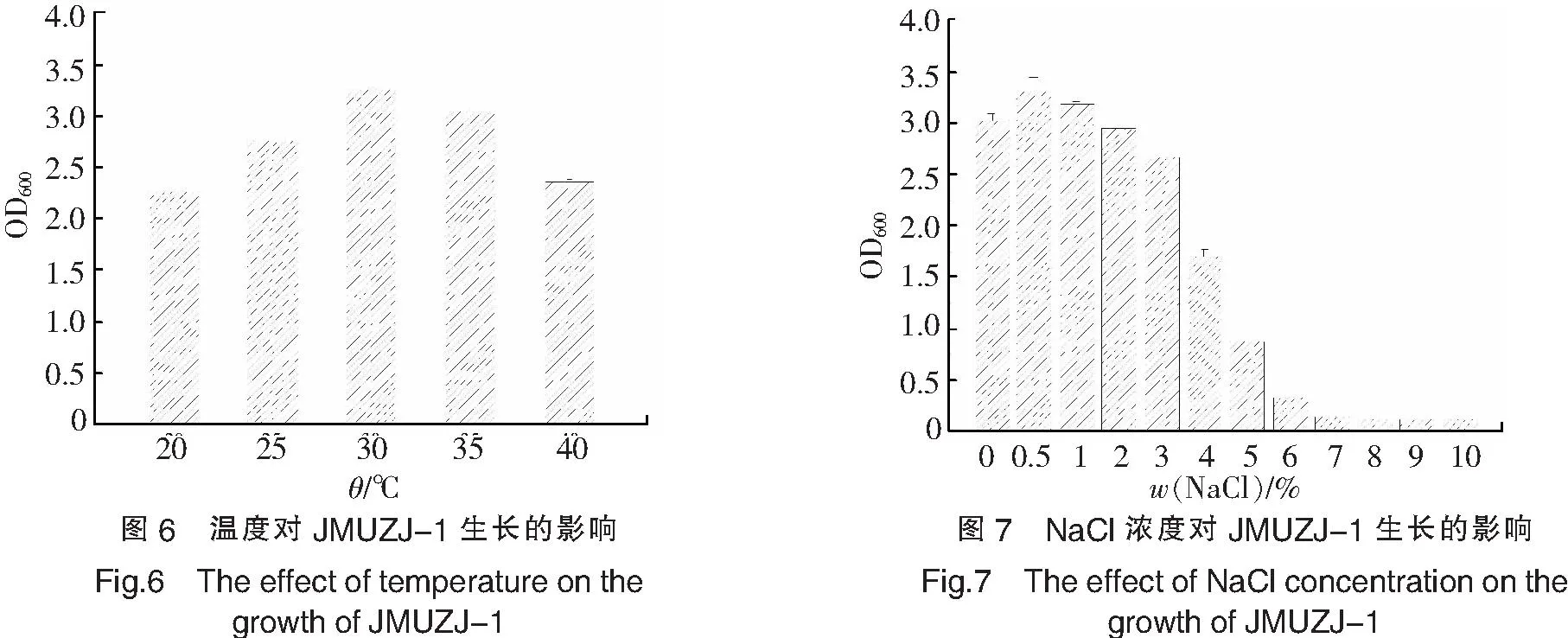
在20~40 ℃范围内考察了菌株JMUZJ-1的生长情况.由图6可知,菌株在20~30 ℃范围内随温度升高生物量增加,30 ℃时菌株生长较好,OD600为3.252,当温度继续升高时,OD600值有所下降.温度主要基于细胞质膜的流动性、生物大分子的活性以及物质的溶解性等方面对微生物的生长代谢产生影响,温度过低导致细胞质膜的流动性、生物大分子的活性和物质的溶解性均降低,从而使微生物细胞的生理代谢活动受到抑制,而温度过高,会导致蛋白质、核酸及酶类等生物大分子发生变性或凝固,使其活性消失,微生物细胞的生长受到抑制,甚至死亡.
2.3.4盐度对菌株生长的影响
实验考察了培养基中不同盐度对菌体生长的影响,结果如图7所示.由图7可以看出,菌株在无NaCl的培养基中能够正常生长,说明Na+不是菌株JMUZJ-1生长的必需元素.菌株在质量分数0.5%NaCl的培养基中长势最好,OD600达到3.301,此后,随着NaCl浓度的增加,菌体的生长受到抑制,当培养基中的NaCl质量分数大于6%时,菌株几乎不生长.溶液中的Na+与维持微生物细胞的渗透压有关,加入适量的钠盐有利于保持细胞的形态,但过高的钠盐会导致菌体细胞严重脱水,进而抑制细胞的生理代谢活动,甚至引起菌体细胞死亡.因此,为了获得最大的菌体生长量,可以在培养基中加入适量的钠盐,对于菌株JMUZJ-1而言,培养基中的最适NaCl质量分数为0.5%.
2.3.5最小抑菌浓度(MIC)
最低抑菌浓度(MIC)可以反映细菌对金属的耐受性,MIC值越大,菌株的耐受性越强,反之,耐受性越弱.结果表明,Ni2+、Zn2+、Cu2+、Cd2+、Cr6+等几种重金属离子MIC值分别为400、200、270、70、190mg·L-1.可以看出,菌株JMUZJ-1对这几种金属离子表现出较高的抗性,其中对Ni2+的抗性最高,对Cd2+的抗性最低.菌株对重金属的耐受性顺序为:Ni>Cu>Zn>Cr>Cd,这可能是由菌株长期生长的特定环境所决定的.
2.4 菌株吸附Ni2+验证试验
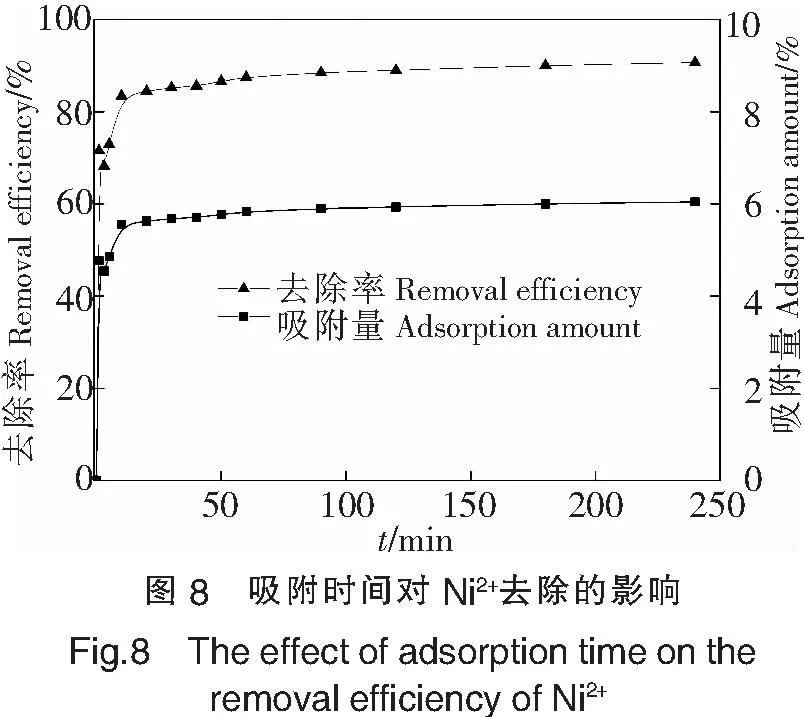
在10mg/LNi2+溶液中投加一定量的菌体,于30℃下120r·min-1振荡吸附,分别在1、3、5、10、20、30、40、50、60、90、120、180、240min后取样测定Ni2+含量,考察菌株对Ni2+去除的影响,结果见图8.从图8可以看出,菌株在前10min对Ni2+的吸附速率很快,去除效率和单位吸附量分别为83.42%和5.56mg·g-1,达到平衡吸附量的94%,此后,随着时间的延长,去除率和单位吸附量的增加速率显著降低,在90min吸附趋于平衡.
3结论
1)本实验分离筛选到一株对Ni2+的耐受性高的菌株JMUZJ-1.经形态学特征、生理生化试验结果及16SrDNA序列同源性比对及系统发育分析,将其鉴定为寡养单胞菌属的菌株.
2)菌株JMUZJ-1在pH=7.0、温度30 ℃、NaCl质量分数0.5%、培养时间为20h时生长较好.
3)该菌对Ni2+有良好的吸附效果,质量浓度为1.5g·L-1菌体吸附10mg·L-1的Ni2+120min后,去除率均达90%以上.
[参考文献]
[1]HAFERBURGG,KOTHEE,METALLOMICS.Lessonsformetalliferoussoilremediation[J].ApplliedMicrobiologyandBiotechnology,2010,87(4):1271-1280.
[2]SREEKANTH T V M,NAGAJYOTHI P C,LEE K D,et al.Occurrence,physiological responses and toxicity of nickel in plants[J].International Journal of Environmental Science and Technology,2013,10(5):1129-1140.
[3]SANDEEP Y,VARSHA S,SUSHMITA B,et al.Studies on the removal of nickel from aqueous solutions using modified riverbed sand[J].Environmental Science and Pollution Research,2013,20(1):558-567.
[4]CHIU A,KATZ A J,BEAUBIER J,et al.Genetic and cellular mechanisms in chromium and nickel carcinogenesis considering epidemiologic findings[J].Molecular and Cellular Biochemistry,2004,255(1):181-194.
[5]刚葆琪,庄志雄.我国镍毒理学研究进展[J].卫生毒理学杂志,2000,14(3):129-135.
[6]BENGUELLA B,BENAISSA H.Effect of competing cations cadmium biosorption by chitin[J].Physicochemical Engineering Aspects,2002,201(1/3):143-150.
[7]SEKER A,SHAHWAN T,EROGLU A E,et al.Equilibrium,thermodynamic and kinetic studies for the biosorption of aqueous lead(II),cadmium(II) and nickel(II) ions onSpirulinaplatensis[J].Journal of Hazardous Materials,2008,154:973-980.
[8]SANGEETA C,PINAKI S.Characterization of a metal resistantPseudomonassp.isolated from uranium mine for its potential in heavy metal(Ni2+,Co2+,Cu2+,and Cd2+) sequestration[J].Bioresource Technology,2009,100(9):2482-2492.
[9]NIKHIL R S,ASHOK V B,AMEETA R K,et al.Removal of Ni(II) ions from aqueous solutions by biosorption onto two strains ofYarrowialipolytica[J].Journal of Environmental Management,2012,102:115-124.
[10]周少奇.现代环境生物技术[M].北京:科学出版社,2003.
[11]ANDREONI V,COLOMBO M,COLOMBO A,et al.Cadmium and zinc removal by growing cells ofPseudomonasputidastrain B14 isolated from a metal-impacted soil[J].Annals of Microbiology,2003,53(2):135-148.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13]R E布坎南,N E杰本斯.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984.
[14]陆晓华,成官文.环境污染控制原理[M].武汉:华中科技大学出版社,2010.
(责任编辑马建华英文审校曹敏杰)
Isolation and Characterization of a Nickel-resistantStenotrophomonasStrain
WANG He1,2,WU Jing-jing1,2,ZHANG Jin-li1,2,WANG Jie1,2,JIA Cheng-guang1,2,ZHANG Ya-ping1,2
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;
2.Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering,Xiamen 361021,China)
Abstract:A nickel resistant strain was obtained from a hardware factory in Fujian province by selection of spontaneous mutants in wastewater containing Ni2+.Morphological tests,molecular identifications of 16S rDNA and biochemical characterization to this strain have been performed.The efficiency of the strain in absorbing Ni2+under optimal growing conditions has been analyzed.The results showed that the nickel-resistant strain was Gram-negative.The strain produces yellow pigmented colonies on medium including beef extract and peptone,with smooth surface and neat edge.Sequence analysis of 16S rDNA and biochemical characteristics identified the strain JMUI-1 as Stenotrophomonas sp.The optimal growth condition for the nickel resistant strain is at pH 7.0,30 ℃,containing 0.5% NaCl solution,which allows JMUI-1 a good absorption performance of Ni2+.
Key words:microbial;screening;heavy metal;tolerant bacteria;Ni2+
[文献标志码]A
[中图分类号]Q 939.97
[文章编号]1007-7405(2015)03-0186-07
[作者简介]王鹤(1990—),男,硕士生,从事环境微生物方向研究.通信作者:张亚平(1978—),男,副教授,硕导,从事水污染控制理论与工程技术研究,E-mail:ypzhang@jmu.edu.cn.
[基金项目]国家自然科学基金资助项目(51004053);福建省高校杰出青年科研人才计划项目(JA11146);集美大学优秀骨干教师第二层次项目(2011B003);中国科学院城市环境与健康重点实验室开放基金项目(KLUEH201302)
[收稿日期]2014-06-17[修回日期]2014-07-10
