5-羟色胺转运蛋白显像剂 11C-DASB的自动化合成及Micro PET/CT显像
2015-03-10张晓军李云钢田嘉禾张锦明
张晓军,刘 健,李云钢,田嘉禾,张锦明
(解放军总医院 核医学科,北京 100853)
5-羟色胺转运蛋白显像剂11C-DASB的自动化合成及Micro PET/CT显像
张晓军,刘 健,李云钢,田嘉禾,张锦明
(解放军总医院 核医学科,北京 100853)
目的:自动化合成5-羟色胺转运蛋白显像剂11C-DASB并进行大鼠Micro PET/CT显像;方法:通过改变甲基化试剂、溶解前体溶剂及反应条件,得到优化的标记条件作为碳-11多功能合成模块的输入参数,进行自动化合成11C-DASB,大鼠静脉注射11C-DASB 45 min后进行显像;结果:采用11C-CH3-Triflate作为甲基化试剂,通入新配制的含1 mg去甲基DASB前体的500 μL DMSO溶液内,80 ℃下加热2 min,标准率为63.7%,大鼠显像表明,11C-DASB特异性的浓聚于SERT富集区域;结论:经优化,11C-DASB自动化合成可得到较高产率,大鼠显像表明,其特异性浓聚于SERT富集区域,有望作为5-羟色胺转运蛋白显像剂。
11C-DASB;5-羟色胺转运蛋白;Micro PET/CT
在中枢神经系统中,以5-羟色胺(5-hydroxytryptamine,5-HT)作为神经递质的神经元广泛的发散其末梢到中枢神经系统各处,如前额皮质、中脑腹侧及背侧纹状体、黑质等区域[1],在各种调节过程中起关键性作用,包括情感、动机、睡眠、食欲、疼痛等[2]。5-羟色胺转运蛋白(serotonin transporter,SERT)是一种对5-HT有高度亲和力的跨膜转运蛋白,位于神经末梢突触前膜,能间接反映五羟色胺神经纤维末梢的数量,其功能异常将导致复杂的行为学异常及疾病,如抑郁症、惊恐障碍、焦虑、强迫症、神经退行性病变、饮食紊乱等[3-6]。利用对SERT亲和力强的PET显像剂,可以从分子水平上研究转运蛋白的功能,认识SERT分布及密度变化与相关疾病病理的关系。2000年,Wilson等首先合成并研究了2-((2-((二甲基胺基)甲基)苯基)硫)-5-氰基苯胺(11C-DASB),作为SERT显像剂,11C-DASB能选择性摄取于SERT感兴趣区,具有高选择性和高亲和力(Ki=1.1 nm)[7]。11C-DASB的合成也得到发展,Wilson采用11C-CH3I与仲胺前体MASB反应制备11C-DASB;Solbach等评价了不同合成条件对亲核反应的影响[8];Belanger等利用11C-CH3-Triflate作为甲基化试剂合成11C-DASB[9];Ungersboeck等探讨了11C-CH3I和11C-CH3-Triflate作为甲基化试剂,MeCN和DMSO作为溶剂时对合成效率的影响,最终合成效率为(45.1±4.6)%[10]。本研究利用国产PET自动化碳-11多功能合成模块制备了11C-DASB[11],探讨不同甲基化试剂、溶剂及反应温度对亲核反应的影响,并进行了大鼠脑部Micro PET/CT显像研究。
1 实验材料
HM-20 回旋加速器:日本住友重机械株式会社;PET 自动化碳-11多功能合成模块,内置液相碘代甲烷、Triflate在线转换、甲基化和HPLC纯化(配紫外和放射性检测器)及固相萃取:派特北京科技公司;分析HPLC仪,配Biocan Flow Count放射性检测器和2487紫外检测器,Sep-Pak C-18:美国Waters公司;1 mol/L的氢化锂铝四氢呋喃溶液:德国,ABX公司;57%HI:AR, 美国Acros公司;乙醇:USP级,美国Milennium公司;丙酮和二甲亚砜(DMSO):AR,美国Sigma公司;前体MASB:2-((2-((甲基胺基)甲基)苯基)硫)-5-氰基苯胺,标准品:12碳-2-((2-((二甲基胺基)甲基)苯基)硫)-5-氰基苯胺:江苏常熟华益化工有限公司产品;eXPlore Vista小动物PET/CT成像系统:美国GE公司;正常Wistar大鼠: 6周龄,190 g北京维通利华实验动物技术有限公司。
2 实验方法
2.1 11C-碘代甲烷的合成
按文献方法作部分改动[11],HM-20加速器经14N(p,α)11C反应产生11C,在靶内与氧气反应生成11CO2,直接将11CO2传到合成器的LOOP环上,LOOP环浸于液氮内。将LOOP环脱离液氮后经空气加热,用40 mL/min的氮气将LOOP环内11CO2载带到含0.2 mL 1 mol/L的氢化锂铝四氢呋喃溶液中,11CO2与氢化锂铝生成复合盐,通入氮气并加热除THF。加入0.2 mL 57%氢碘酸,复合盐水解并与氢碘酸反应生成碳-11碘代甲烷,以40 mL/min流速通入氮气并加热,将11C-CH3I载带出反应管。
2.2 11C-碘代甲烷在线转换11C-CH3-Triflate [12]
在不锈钢管(10 mm×70 mm)内,装入0.4 g三氟甲基磺酰基银与0.65 g石墨的混合物。通入氮气,将之加热到200 ℃。当2.1节中11C-CH3I生成并由氮气载出时,切换气体三通,11C-CH3I通过该不锈钢管,11C-CH3I在线转换成11C-CH3-Triflate(图1)。
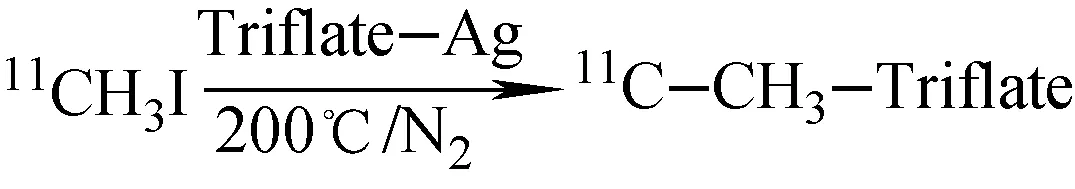
图1 合成11C-CH3-Triflate线路图
Fig.1 Scheme of11C-CH3-Triflate synthesis
2.3 11C-DASB的标记条件
采取不同的条件进行11C-DASB标记,用丙酮或DMSO分别吸附11C-碘代甲烷或11C-CH3-Triflate,取出后与等体积的丙酮或DMSO溶解的前体MASB混合,前体最终浓度为2 g/L,反应体积为0.5 mL,室温放置2 min或80 ℃加热2 min后取出用HPLC分析。
利用优化的标记条件,自动化合成11C-DASB:采用HM-20 回旋加速器,束流为40 μA,轰击15 min,自动化合成11CH3I并在线生成11C-CH3-Triflate,将11C-CH3-Triflate通入到新配制含1 mg的去甲基DASB前体的500 μL DMSO溶液内,常温下反应,观察反应瓶内的放射性计数,待放射性计数达到最大,停止通入气体。加热反应瓶80 ℃,维持2 min。将流动相加到反应瓶终止反应,并转移到中转瓶,将中转瓶内溶液转移到HPLC柱上纯化,流动相为40%乙腈(0.1 mol/L乙酸铵),流速为6 mL/min,收集10~12 min的液体入固相萃取瓶,固相萃取瓶中先注60 mL纯水,以稀释HPLC收集液。将经稀释的收集液转移到Sep-Pak C-18柱上,10 mL水清洗后用1 mL乙醇将产品从柱上洗脱,并加生理盐水稀释。

图2 合成11C-DASB线路图Fig.2 Scheme of 11C-DASB synthesis

图3 全自动合成11C-DASB的模块Fig.3 The module of auto-synthesis for 11C-DASB
2.4 各组分的鉴别及放化纯度的测量
分别将DMSO溶解的11C-碘代甲烷或11C-CH3-Triflate及标记物用HPLC分析,测量条件:Waters的HPLC,2487紫外分光光度计,检测波长:254 nm;515双泵,分析柱为反相Nova-Park C-18柱(3.9 mm×150 mm),Bio-Scan的Flow-Count放射性检测器。流动相为40%乙腈(0.1 mol/L乙酸铵),流速为1 mL/min。分别独立进11C-碘代甲烷、11C-CH3-Triflate、标准品和标记物,以确定各组分的保留时间,并计算标记率和放化纯度。
2.5 11C-DASB的Micro PET/CT显像
取正常Wistar大鼠,尾靜脉注射11C-DASB 74 MBq,于注射后45 min 将其置于扫描床上并持续异氟烷气体麻醉,利用eXplore Vista Micro PET/CT进行扫描,先扫描PET再扫CT以定位,确定放射性浓集的部位。根据大鼠脑解剖位置,比较中脑、丘脑和小脑的放射性摄取。
3 结果与讨论
3.1 各组份的鉴别
在分析HPLC上单独进11C-CH3-Triflate时,其放射性峰的保留时间Rt=2.5 min;单独进11C-CH3I时,其放射性峰的保留时间Rt=7.6 min;标准品DASB的紫外吸收峰Rt=5.7 min。常温下11C-CH3-Triflate通入溶解去甲基前体DASB的DMSO溶液中,直接分析该溶液,其放射性HPLC图谱示于图4。

图4 标记物产物11C-DASB的HPLC图谱Fig.4 The HPLC of 11C-DASB
图4中,Rt=2.5 min和Rt=5.7 min的二个放射性峰分别为未反应的11C-CH3-Triflate和标记产物11C-DASB,同时图中多了二个放射性峰,Rt=4.8 min 和Rt=11.2 min。从去甲基DASB的结构分析,有两个可甲基化的基团,一个是脂肪仲胺,该胺很活泼,中性条件下甲基化的产物为11C-DASB,从图4可见甲基化率大于50%;另一个是芳香胺,采用11C-CH3-Triflate在中性条件下丙酮溶液中常温较容易发生甲基化,如11C-PIB的合成即采用该条件;芳香胺甲基化后产品的脂溶性加大,在HPLC柱上保留时间后移,因此Rt=11.2 min的峰可能是芳香胺甲基化的副产品,而Rt=4.8 min的峰可能是季胺化的11C-DASB。
3.2 11C-DASB的标记优化
为优化11C-DASB的标记,分别采用不同的溶剂溶解前体以及分别用11CH3I和11CH3-Triflate为甲基化试剂,结果列于表1,利用11CH3I作为甲基化试剂,丙酮做溶剂时,11CH3I的离去基团为I-,其活性较弱,常温与80 ℃加热2 min时分别有90.1%和39.8%11CH3I未反应,而在DMSO溶剂中,11C-DASB的合成效率提高,未反应11CH3I残留降低;11CH3-Triflate的离去基团为三氟甲磺酸根(Triflate-),其离去能力强于I-,常温与加热反应的标记率分别为54.5%和63.7%,高于使用直接用11CH3I作甲基化试剂时的效率;加热有助于亲核反应进行,明显提高了反应效率,尽管两种副产物也随之增加,但11C-DASB产率的增加显著。因此,标记条件确定为使用DMSO溶解前体,11CH3-Triflate为甲基化试剂并80 ℃加热2 min。
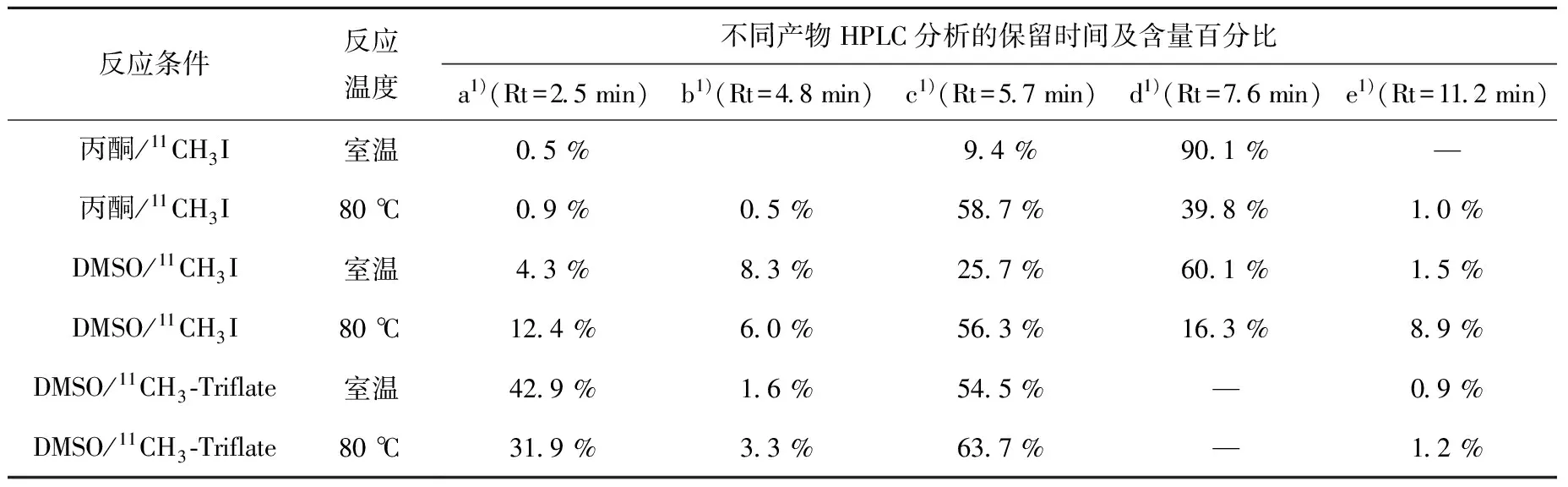
表1 不同条件下11C-DASB的标记产物分析Table 1 The lable of 11C-DASB under different circumstances
注:1) 化合物a为11C-CH3-Triflate,b为11C-DASB季胺化产物,c为11C-DASB,d为11C-CH3I,e为MASB苯胺甲基化产物
3.3 11C-DASB自动化合成
采用全自动合成模块,使用以上优化的条件,从11CO2开始,经中性条件下的甲基化、加热、Semi-prep HPLC纯化、固相萃取,全自动合成了11C-DASB,时间为25 min。图5为Semi-HPLC纯化11C-DASB的放射性图谱,在4~5 min之间出现一个放射性杂峰,这个杂峰可能为副产品,产品峰在11~12 min。最终得到3 GBq的11C-DASB,比活度为50 GBq/μmol。

图5 半制备HPLC分离的放射性图谱Fig.5 Radioactive chromatogram of semi-prep HPLC
3.4 11C-DASB的鉴别及放化纯度的测定
经HPLC分析,11C-DASB的放化纯度大于99 %,紫外图谱未见有前体存在。同时共进标准品的UV保留时间表明,放射性峰与标准品在HPLC上有相同的保留时间,证实放射性物质为11C-DASB。

图6 产品11C-DASB的HPLC图谱Fig.6 Analytical HPLC profiles of 11C-DASB and 12C-DASB
3.5 11C-DASB的Micro PET/CT显像
正常Wistar大鼠静脉注射11C-DASB 约45 min在脑内达到平衡,其Micro PET/CT显像如图7所示,A、B、C区域分别为丘脑、中脑和小脑,11C-DASB 选择性的摄取于SERT区域丘脑和中脑,小脑的放射性摄取很低,中脑和小脑的摄取比为3.23,丘脑和小脑的摄取比为2.97。
4 小结
通过改变甲基化试剂、溶解前体溶剂及反应温度,并利用HPLC分析粗产品,得到优化的标记条件,利用国产PET 自动化碳-11多功能合成模块,可自动化合成SERT显像剂11C-DASB:采用11C-CH3-Triflate作为甲基化试剂,将此通入到新配制的含1 mg去甲基DASB前体的500 μL DMSO溶液内,80 ℃下加热2 min,标记率提高至63.7%,而此前文献报道11C-DASB的标记率为22.7%~45.1%;大鼠的Micro PET/CT显像表明,该显像剂选择性的浓聚于SERT富集区域,靶与非靶比高,有望作为良好的SERT显像剂。
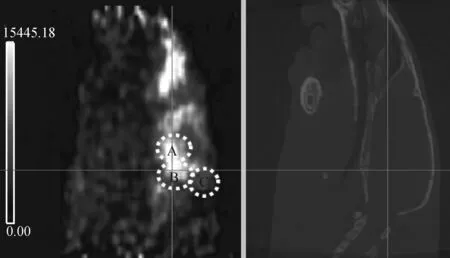
图7 大鼠Micro PET/CT 显像Fig.7 Micro PET/CT images of wistar rat
[1] Hannon J, Hoyer D. Molecular biology of 5-HT receptors[J]. Behav Brain Res, 2008, 195(1): 198-213.
[2] Berger M, Gray J A, Roth B L. The expanded biology of serotonin[J]. Annu Rev Med, 2009, 60: 355-366.
[3] Perrone R, Berardi F, Colabufo N A, et al. Design and synthesis of long-chain arylpiperazines with mixed affinity for serotonin transporter (SERT) and 5-HT(1A) receptor[J]. J Pharm Pharmacol, 2005, 57(10): 1 319-1 327.
[4] Kalivas P W, O'Brien C. Drug addiction as a pathology of staged neuroplasticity[J]. Neuropsychopharmacology, 2008, 33(1): 166-180.
[5] 刘飞,贺佑丰,罗志福. 中枢神经系统5-羟色胺受体显像剂WAY类似物的研究进展[J]. 同位素,2001,14(1):41-49.
Liu fei, He Youfeng, Luo Zhifu. Development progress of WAY analogues in CNS 5-Hydroxytrypamine receptor imaging agents[J]. Isotopes, 2001, 14(1): 41-49(in Chinese).
[6] 郭运行,刘伯里. 5-羟色胺转运蛋白显像剂的研究进展[J]. 化学进展,2008,20(6):869-877.
Guo Yunhang, Liu Boli. Advances in the serotonin transporter imaging agents[J]. Progress in Chemistry, 2008, 20(6): 869-877(in Chinese).
[7] Wilson A A, Ginovart N, Hussey D, et al. In vitro and in vivo characterisation of11C-DASB: a probe for in vivo measurements of the serotonin transporter by positron emission tomography[J]. Nucl Med Biol, 2002, 29(5): 509-515.
[8] Solbach C, Reischl G, Machulla H J. Determination of reaction parameters for the synthesis of the serotonin transporter ligand11C-DASB: application to a remotely controlled high yield synthesis[J]. Radiochim Acta, 2004, 92(4-6): 341-344.
[9] Belanger M J , Simpson N R. Biodistribution and radiation dosimetry of11C-DASB in baboons[J]. Nucl Med Biol, 2004, 31(8): 1 097-1 102.
[10]Ungersboeck J, Philippe C, Haeusler D, et al. Optimization of11C-DASB synthesis: vessel-based and flow-through microreactor methods[J]. Appl Radiat Isot, 2012, 70(11): 2 615-2 620.
[11]张锦明,张晓军,刘键,等. 国产氟多功能模块组合碘代甲烷模块合成11C标记放射性药物[J]. 同位素,2014,27(1):28-34.
Zhang Jinming, Zhang Xiaojun, et al. Fully automated synthesis carbon-11 radiopharmaceuticals using home made PET-MV-2-F module assembled the methyl iodide module[J]. Isotopes, 2014, 27(1): 28-34(in Chinese).
[12]张锦明,田嘉禾,王武尚,等. 在线制备11C-Triflate-CH3[J]. 同位素,2006,19(2):124-128.
Zhang Jinming, Tian Jiahe, Wang Wushang, et al. On-line production of11C-Triflate-CH3[J]. Isotopes, 2006, 19(2): 124-128(in Chinese).
Automatic Synthesis and Micro PET/CT Imaging Study of11C-DASB as a Serotonin Imaging Agent
ZHANG Xiao-jun, LIU Jian, LI Yun-gang, TIAN Jia-he, ZHANG Jin-ming
(DepartmentofNuclearMedicine,ThePLAGeneralHospital,Beijing100853 ,China)
Objectives: Automatic synthesis of11C-DASB as a serotonin imaging agent was established and Micro PET/CT imaging with Wistar rat was performed. Methods: Optimization of11C-DASB synthesis was established by modifying different11C-methylation agents, solvent and reaction conditions. Automated procedure for the synthesis of11C-DASB was established, and Micro PET/CT imaging was complied with Wistar rat. Results: The optimized11C-DASB synthesis was obtained. When11C-CH3-Triflate was used as methylation agent, 500 μL DMSO was used to dissolve 1 mg precursor, the reaction was carried out at 80 ℃ for 2 min, the radiochemical synthesis yield was 63.7%. Micro PET/CT studies in rat showed that the initial uptake of11C-DASB in the brain was high, especially in region of the highest density of SERT, such as colliculus and mid brain. Conclusion: The study should provide the basis for routine preparations of11C-DASB with high reliability, it may be useful for PET imaging of SERT binding sites in the brain.
11C-DASB; SERT; Micro PET/CT
10.7538/tws.2015.28.01.0001
2014-10-17;
2014-12-11
国家自然科学基金资助(81371593)
张晓军(1987—),男,福建泉州人,技师,主要从事放射性药物合成与标记
张绵明,男,研究员,E-mail: zhangjm301@163.com
R817
A
1000-7512(2015)01-0001-06
