鞍区血管外皮细胞瘤的诊断及显微手术治疗
2015-03-10穆林森张红波陈谦学孙彦辉姬玉成曾小君
穆林森 张红波 陈谦学 孙彦辉 姬玉成 曾小君
(广州市脑科医院神经外科,广州 510170)
·短篇论著·
鞍区血管外皮细胞瘤的诊断及显微手术治疗
穆林森 张红波*①陈谦学②孙彦辉③姬玉成③曾小君③
(广州市脑科医院神经外科,广州 510170)
目的 探讨鞍区血管外皮细胞瘤(hemangiopericytomas,HPC)的临床诊断特点及显微手术的治疗效果。 方法对2001年3月~2014年12月6例术后病理证实为鞍区HPC的临床表现、神经影像学、治疗和预后等进行回顾性分析。结果 4例采用额颞入路,1例额眶颧入路,1例额外侧入路。肿瘤全切除3例,近全切除1例,大部分切除2例。术中出血量600~2100 ml,平均1200 ml。6例术后病理证实为HPC,均接受普通放疗。术后并发无菌性脑膜炎2例,抗生素及腰穿置管后治愈。动眼神经麻痹2例,对侧肢体偏瘫1例,神经康复理疗后改善。6例随访6~29个月,平均14.8月,无神经系统转移及死亡。 结论 鞍区HPC临床少见,误诊率高。肿瘤易复发,最有效的治疗方法是全切除肿瘤。
血管外皮细胞瘤; 鞍区
血管外皮细胞瘤(hemangiopericytomas,HPC)是一种少见的软组织血管源性恶性肿瘤,最常见于骨骼系统,颅内多发生于靠近脑膜部位,幕上多见,鞍区罕见[1],具有血供丰富、术中易发生大量出血、术后容易复发及转移等特点[2]。正确诊断及治疗可以降低手术风险及术后并发症。2001年3月~2014年12月采用显微手术治疗6例(广州市脑科医院5例,湖北省中西医结合医院1例)经术后病理证实的鞍区HPC,现报道如下。
1 临床资料与方法
1.1 一般资料
本组6例,男4例,女2例。发病年龄37~59岁,平均47.5岁。病程6~35个月,平均11.2月。首发症状:不典型头痛及头晕5例,4例视物模糊,眼球活动障碍3例,2例男性患者倦怠乏力,精神差等。所有病例均接受常规CT平扫,未行CT增强扫描。6例均累及鞍区结构,3例可见蝶鞍扩大,鞍底下陷。肿瘤直径3~7 cm,(5.1±1.8)cm。病灶密度不均匀,可见混杂的稍低密度影(图1)。4例CT平扫均以稍高密度为主,未见钙化影及瘤周水肿征象;2例CT平扫为高低混杂密度。6例均出现鞍背骨质吸收变薄,鞍底及斜坡骨质破坏,虫蚀样改变(图2)。MRI扫描:T1WI 4例为均匀等信号,2例为等低混杂信号,肿瘤内可见粗大低信号血管流空影,未见瘤周水肿带(图3);T2WI 4例为均匀稍高信号,2例为不规则高低混杂信号,低信号为囊变坏死征象(图4);6例TIWI及T2WI可见肿瘤内血管迂曲流空影像(图3,4)。钆双胺(欧乃影)增强扫描:4例均匀明显强化,2例不均匀明显强化;分叶状改变,瘤内有增强血管影;2例病灶与硬膜呈宽基底相连,4例与硬膜呈窄基底强化;海绵窦及视交叉明显受压(图5)。6例一般资料见表1。
病例选择标准:影像学显示肿瘤基底位于鞍区结构者。
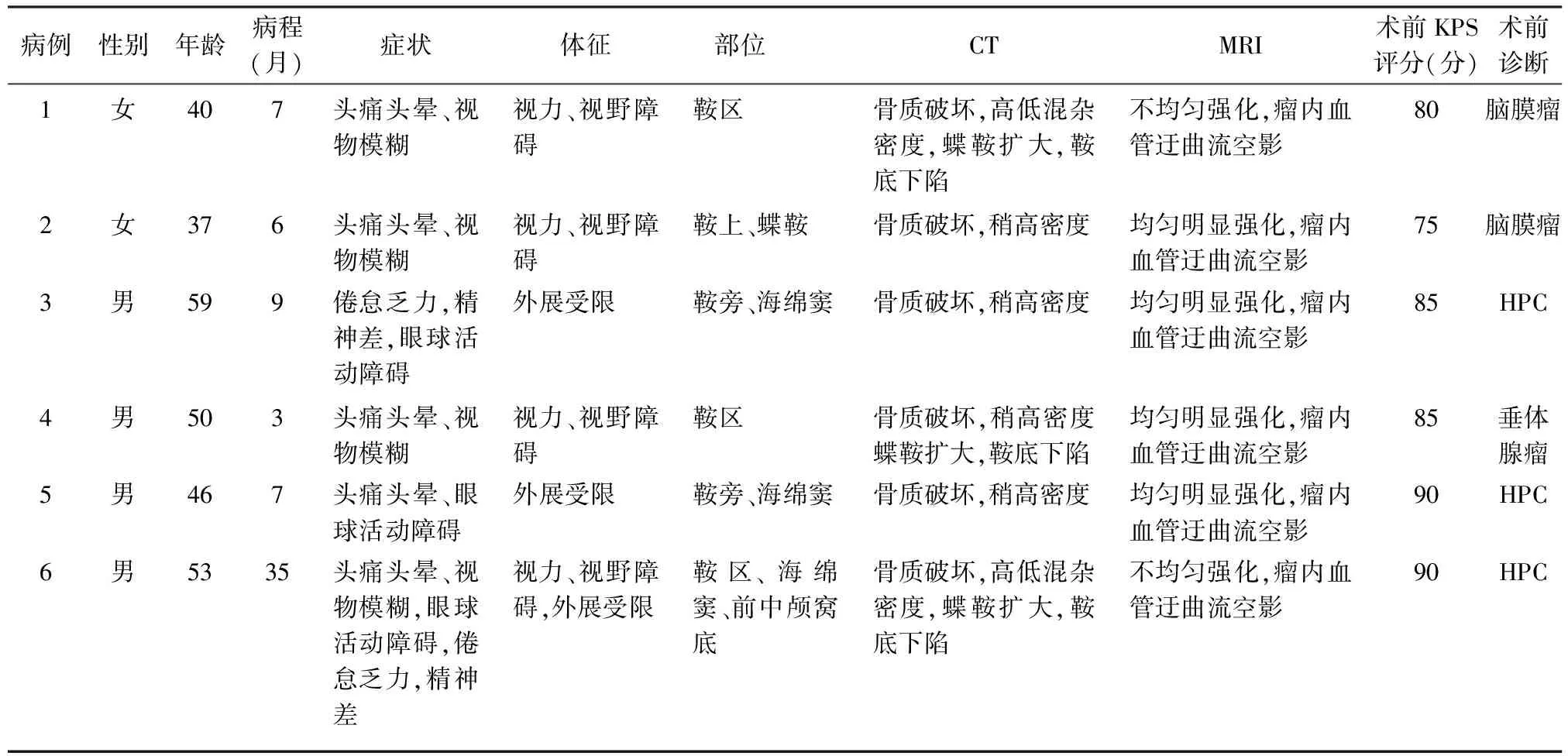
表1 6例鞍区血管外皮细胞瘤(HPC)的一般资料
1.2 方法
气管插管全身麻醉,常规消毒铺巾。根据肿瘤部位、血管神经关系及与鞍区邻近骨性结构和脑组织及血管神经累及决定手术方式及标记切口。2例以鞍区病变为主及2例病变累及鞍旁与海绵窦行额颞入路,1例病变累及鞍区与蝶鞍行额外侧入路,1例病变累及前中颅窝底行额眶颧入路。铣刀成形骨瓣,悬吊硬膜,显微镜下弧形放射状剪开硬脑膜,翻向额颞部。缓慢释放脑脊液,降低脑组织张力。牵拉颞叶及颞极,见肿瘤位于鞍区,海绵窦。质韧,血供丰富,呈灰红色,包膜完整。硬膜下及硬膜外联合,先分离肿瘤前后界及外侧界,电凝肿瘤基底,阻断血供。分块大部分切除肿瘤,见颈内动脉、视神经、动眼神经保护良好,再切除海绵窦内肿瘤。1例因肿瘤生长广泛,侵入鞍内,部分位于海绵窦内侧壁,残留部分。术后根据肿瘤切除程度和MRI复查结果,分为完全切除、近全切除(≥95%)和大部分切除(≥50%~<95%)和部分切除(<50%)。依据术后病理结果,术后常规补充放疗。
2 结果
4例采用额颞入路,1例行额眶颧入路,1例行额外侧入路。肿瘤全切除3例,近全切除1例(图6,7),大部分切除2例。术中出血量500~2100 ml,平均1200 ml,见表2。术中见肿瘤呈红色或紫红色,质地较韧,血供丰富,可见较完整包膜,瘤内可有大小不等的血管腔或血窦。术后病理诊断为HPC。免疫组织化学检查均提示波形蛋白阳性,上皮细胞膜抗原可见(图8)。术后头痛及头晕症状缓解4例,1例持续存在,4例视力、视野障碍均缓解。 1例游离甲状腺素(FT3)降低,为1.2 pmol/L(我院参考值3.5~6.5 pmol/L),行优甲乐替代治疗半年后激素水平恢复正常,逐渐停药。术后无菌性脑膜炎2例,抗生素及腰穿置管后治愈。动眼神经麻痹2例,眼球外展受限1例,对侧肢体偏瘫1例,行神经康复理疗后改善。术后接受放疗7次,未接受化疗。6例随访6~29个月,平均14.8月:无神经系统转移及死亡,5例肿瘤控制良好,未见复发,1例术后4个月复发,行放疗。

表2 6例HPC术中、术后情况
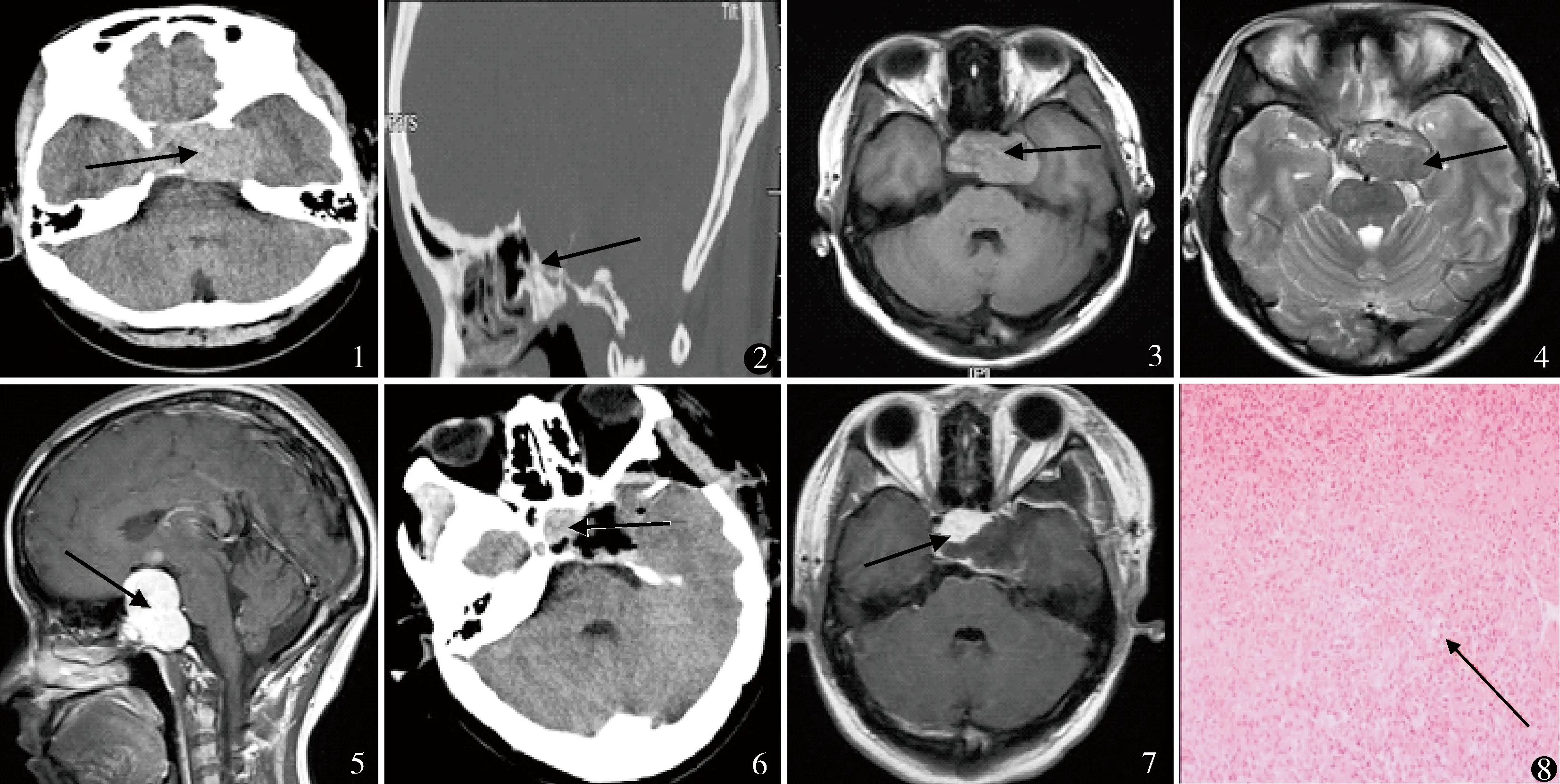
病例6,男,53岁,鞍区、海绵窦、前中颅高底病变。图1 CT平扫鞍区、海绵窦、前中颅高底稍高密度影,中间有混杂稍低密度影,未见钙化影及瘤周水肿征象 图2 蝶鞍扩大,鞍底下陷,鞍背骨质吸收变薄,鞍底及斜坡骨质破坏,虫蚀样改变 图3 T1WI等低混杂信号,肿瘤内可见低信号血管流空影 图4 T2WI为不规则高低混杂信号,低信号为囊变坏死征象,肿瘤内迂曲低信号血管流空影像 图5 病变不均匀明显强化,分叶状改变,瘤内有增强血管影,呈窄基底硬膜强化,海绵窦及视交叉明显受压 图6,7 术后显示肿瘤大部分切除,术后鞍内残留部分肿瘤 图8 肿瘤细胞丰富,细胞大小不一,胞质淡染,可呈空泡状,胞核圆形或梭形,部分肿瘤可有间变表现,瘤内薄壁血管网丰富,可相互吻合成“鹿角样”表现,肿瘤细胞围绕血管排列,未见钙化和沙粒体 HE染色 ×200
3 讨论
1942年Stout和Marry首次报道并系统描述HPC,认为HPC是起源于毛细血管的Zimmemann外皮细胞。神经系统发生率低,占神经系统肿瘤0.2%~1%。HPC具有恶性生物学特性,多中心血管生长,血供丰富,术中易发生大量出血,肿瘤易复发及转移等[1,2]。鞍区结构特殊,神经及血管交错,鞍区HPC的诊断及治疗对术者要求更高。本组3例术前诊断为HPC,2例脑膜瘤,1例侵袭性垂体腺瘤。2例误诊脑膜瘤者因术中血供丰富,行肿瘤大部分切除术。因此,术前正确的诊断及防治策略可以降低手术意外及术后并发症的发生。
同其他部位HPC一样,鞍区HPC为起源于脑膜间质的少见的间叶源性软组织血管肿瘤。Schiariti等[3,4]从分子基因水平检测NF2(neurofibromatosis 2,NF2)基因,认为HPC是来源于脑膜间质血管外皮细胞的一种恶性肿瘤。典型HPC血管丰富,胞浆内特征性结构为直径10 mm的微丝呈束状排列,免疫组化证实为微丝蛋白,以及特征性的不规则的鹿角状血管。本组6例均能见到微丝蛋白及不规则分支血管,未行NF2基因检测。
颅内HPC生长位置与脑膜瘤基本类似,多见于幕上邻近脑膜部位,鞍区罕见。病程长短不一,发病年龄40~50岁,男性多见,男女比例接近2∶1。
本组男4例,女2例,男女比例2∶1;发病年龄37~59岁,平均47.5岁。临床表现取决肿瘤的大小和位置及与邻近周围组织受累情况,无特征性表现[1~3,5],50%以上患者常见症状为头晕、头痛及颅神经受压症状。本组首发症状表现为脑膜刺激有关的不典型头痛5例,与文献报道基本相似。
HPC多为单发,肿瘤形态多不规则,分叶状,多以窄基底与邻近脑膜相连,具有侵袭性的特点[2~4]。CT可见囊变、坏死、流空血管多见,且极少见到钙化,骨质破坏及溶骨性改变。因此,在磁共振上瘤内信号多不均匀,在T2WI上呈高信号或显著高信号。增强扫描明显强化的特点具有特征性,呈进行性延迟强化,强化显著,这与HPC由实性梭形细胞构成,间质成分少,肿瘤内水分较低有关。T2高信号及不均匀强化可作为鉴别诊断的重要依据。Maria等[6,7]认为HPC中增强后所有肿瘤显著强化,部分肿瘤动脉期瘤内可见丰富的肿瘤血管。本组病例MRI平扫和增强表现与文献类似。HPC瘤内及其周围常见大量流空血管影可提示诊断。
鞍区HPC临床易误诊为其他类型肿瘤,原因可能与该部位HPC少见,对疾病临床表现的诊断经验不足,以及对鞍区HPC的特征临床影像学观察不够有关[7,8]。我们总结下列特点可辅助诊断鞍区HPC:①中年男性多见,病程较短,多数病程<1年。②以大脑镰、小脑幕、颅底脑膜处为常见发病部位,常以窄基底与受累脑膜相连。③肿瘤多为单发,形态多不规则,分叶状或蘑菇结节样,边界清楚,跨叶生长,常合并出血坏死。④CT平扫可见病变密度略高、边界较清晰的分叶状的病灶,邻近骨质出现溶解性破坏,无骨质增生和钙化。⑤肿瘤内多见囊变坏死及血管流空信号在T2WI上信号稍高或混杂信号,增强扫描明显及延迟强化及迂曲血管影。
HPC具有侵袭性生长、易复发及转移等病理学特点,预后与肿瘤切除程度有关。HPC的转移率与患者生存期有关,转移率可高达70%,平均90个月,最常见的转移部位依次为骨、肺、肝[8]。因此,目前国内外的学者主张采取以手术为主,辅助放化疗的综合治疗。鞍区HPC的手术入路包括侧方、前方、中线及联合入路等,具体采取哪种入路主要参考肿瘤位置、血液丰富程度、累及区域、生长方向、与邻近脑结构的关系及术者熟练程度等因素。本组4例采用额颞入路,1例额眶颧入路,1例额外侧入路。肿瘤全切除3例,近全切除1例,大部切除2例。1例因肿瘤侵入蝶窦内,因手术路径所限,行大部分切除;1例因肿瘤血供丰富,术中行大部分切除术。鞍区HPC的血供有动静脉双重供血,可通过术前栓塞可减少术中失血量,但是栓塞有可能难以达到止血效果且易导致肿瘤体积变化,增加手术难度及风险[2,3,8],因此,本组病例未行栓塞治疗。
由于肿瘤自身的病理特性,对骨质破坏及与硬脑膜的关系,对于鞍区HPC应尽可能争取肿瘤全切,尤其是肿瘤附着处的基底处理。肿瘤的切除程度与复发、转移及预后有关。颅内HPC术后5年局部控制率,肿瘤全切者为84%,部分切除为38%[9]。因此,HPC术后应常规辅助立体定向放射治疗,推荐低剂量放疗(50 Gy)[10,11]。对于HPC进行辅助化疗研究甚少,经验不多效果,不是很确切,未来针对HPC的靶向化疗药物及机制研究可能为HPC的根治提供理论支撑[11,12]。本组6例术后均接受普通放疗,1例首次手术近全切除术,术后4个月肿瘤复发,行普通放射治疗,无神经系统转移及死亡。
综上所述,颅内HPC发生率低,鞍区HPC罕见,误诊率高。鞍区HPC具有一定的影像学特征,可辅助临床诊断。以手术为主的综合治疗是目前治疗颅内HPC最主要的治疗原则,可提高患者生活质量,延长生命。
1 Stout A, Murray M. Haemangiopericytoma: a vascular tumour featuring Zimmerman’s pericytes. Ann Surg,1942,116:26-33.
2 Ecker RD, Marsh WR, Pollock BE, et al. Hemangiopericytoma in the central nervous system: treatment, pathological features, and long-term follow up in 38 patients. J Neurosurg,2003,98(6):1182-1187.
3 Schiariti M, Goetz P, El-Maghraby H, et al. Hemangiopericytoma: long-term outcome revisited. J Neurosurg,2011,114(3):747-755.
4 Louis D, Ohgaki H, Wiestler O, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol, 2007,114(2):97-109.
5 Juco J, Horvath E, Smyth H, et al. Hemangiopericytoma of the sella mimicking pituitary adenoma: case report and review of the literature. Clin Neuropathol,26(6):288-293.
6 Chiechi M, Smirniotopoulos J, Mena H.Intracranial hemangiopericytomas: mr and ct features. AJNR Am J Neuroradiol,1996,17(7):1365-1371.
7 耿道颖,沈天真,陈星荣,等.颅脑血管外皮细胞瘤的CT、MRI与病理对照研究.中国医学计算机成像杂志,2000,6(5):304-306.
8 Fountas K, Kapsalaki E, Kassam M, et al. Management of intracranial meningeal hemangiopericytomas: outcome and experience. Neurosurg Rev, 2006,29(2):145-153.
9 Sheehan J, Kondziolka D, Flickinger J, et al. Radiosurgery for treatment of recurrent intracranial hemangiopericytomas. Neurosurgery,2002, 51(4):905-911.
10 Rees J, Kitchen N, Beaney R, et al. Cerebral haemangiopericytoma treated with con servative surgery and radiotherapy. Clin Oncol (R Coll Radiol),2000,12(2):124-127.
11 Kano H, Niranjan A, Kondziolka D, et al. Adjuvant stereotactic radiosurgery after resection of intracranial hemangiopericytomas. Int J Radiat Oncol Biol Phys,2008,72(5):1333-1339.
12 李安民,张传秀,傅相平,等.磁导向下磁性化疗药物对肝、肾及骨髓的影响.中国微创外科杂志,2005,5(11):943-946.
(修回日期:2015-06-22)
(责任编辑:李贺琼)
Clinical Diagnosis and Microsurgery Treatment of Sellar Hemangiopericytoma
MuLinsen*,ZhangHongbo,ChenQianxue,etal.
*DepartmentofNeurosurgery,GuangzhouBrainHospital,Guangzhou510170,China
Correspondingauthor:ZhangHongbo,E-mail:hongbozhang99@163.com
Objective To discuss the diagnostic features and microsurgery treatment of sellar hemangiopericytoma (HPC). Methods From March 2001 to December 2014, six cases of pathologically confirmed sellar aera HPC were retrospectively analyzed with respect to its clinical manifestations, neuroimaging, treatment, and prognosis. Results The operation was performed via frontotemporal approach in 4 cases, orbitozygomatic approach in 1 case, and frontallateral approach in 1 case. The tumor was completely removed in 3 cases, nearly subtotally resected in 1 case, and mostly subtotally resected in 2. The blood loss was 600-2100 ml, with an average of 1200 ml. Postoperatively, all the 6 cases were pathologically confirmed as having hemangiopericytoma,and underwent general radiotherapy. There were 2 cases of aseptic meningitis, who were cured with antibiotics and lumbar puncture. Oculomotor nerve palsy occurred in 2 cases and contralateral limb paralysis in 1 case, all of which underwent neurological rehabilitation therapy until improvement. Follow-up examinations were conducted for 6-29 months, with an average of 14.8 months. No nervous system metastasis or death was seen. Conclusion Sellar hemangiopericytoma rarely occurs in clinical practice and subjects to misdiagnosis. With high rate of tumor recurrence,the most effective treatment is total resection.
Hemangiopericytoma; Sella area
R739.41
A
1009-6604(2015)07-0641-04
10.3969/j.issn.1009-6604.2015.07.019
2015-05-15)
* 通讯作者,E-mail:hongbozhang99@163.com
① (湖北省中西医结合医院神经外科,武汉 430015)
② (武汉大学人民医院神经外科,武汉 430060)
③ (首都医科大学北京天坛医院神经外科,北京 100050)
