抗Ma2 抗体阳性的淋巴瘤相关副肿瘤综合征1 例报告
2015-03-10冯加纯
王 爽,王 蕾,孙 莉,冯加纯,杨 宇
神经系统副肿瘤综合征(paraneoplastic neurological syndromes,PNS)是指一些恶性肿瘤非直接侵犯或非转移引起的神经和(或)肌肉损害的一组临床症候群,其临床表现复杂多样。随着免疫学技术的发展,研究人员在部分PNS 患者的体内发现了一些特异性抗神经元抗体,而不同的抗体可能与某些特定的肿瘤发生关系密切。其中一种抗细胞内抗原抗体——抗Ma2 抗体于1999 年被发现与睾丸癌联系密切[1]。抗Ma2 相关性脑炎有着与边缘性脑炎一些相对特异的临床表现,目前国内仅报道1 例,现将我院新近诊断的1 例抗Ma2 抗体阳性的淋巴瘤病例进行总结,以期引起广大医务工作者的重视,减少漏诊乃至误诊。
1 临床资料
患者,男,74 岁。于2015 年7 月11 日入院,5 m 来逐渐出现全身乏力,1 m 前无明显诱因出现腰部疼痛,几日后双侧膝关节及双小腿疼痛,行关节X 线后考虑为骨关节炎,未予特殊处置。20 d 前无明显诱因出现全身疼痛,同时伴有双手脚麻木。10 d 后双下肢无力,上楼梯时摔倒两次,整个病程中伴有反应迟钝,偶有幻视,遂就诊于当地医院,头部CT 示腔隙性脑梗死、老年性脑改变。颈胸腰椎MRI 示脊柱退行性改变及椎间盘突出。离子:钠127.8 mmol/L(正常值135~147),氯89.4 mmol/L(正常值96~110)。超敏C 反应蛋白33.89 mg/L(正常值0~5),B2 微球蛋白9.04 mg/L(正常值1~3),血常规、凝血常规、抗“O”及类风湿因子未见明显异常。于当地医院治疗,自觉症状渐加重,遂就诊于我院神经内科门诊。同时又出现右眼睑下垂,无晨轻暮重现象。近1 m 来体重下降近10 斤。既往高血压病史10 余年,左眼“黄斑病变”病史3 y,脑梗死病史2 y,吸烟饮酒史。否认家族遗传病及类似病史。入院查体:生命体征平稳,心、肺、腹未见明显异常。血压101/76 mmHg,心率98 次/分;多睡懒言,反应迟钝,记忆力定向力差,右眼睑下垂,双侧瞳孔等大同圆,直径约3.0 mm,右侧直间接对光反射略迟钝,右眼内收、上视、下视受限,左眼视力明显下降,上下视亦受限,双上肢肌力5-级,双下肢肌力4-级,四肢腱反射未引出,右侧肢体指鼻试验及跟膝颈试验欠稳准,余神经科查体未见明显阳性体征。MMSE 评分24 分。
辅助检查:多次复查离子:Na+120.7~136.4 mmol/L(正常值137~147),Cl-85.7~97.8 mmol/L(正常值99~110);超敏C 反应蛋白:34.5 mg/L(正常值0~3.5)。血沉:86 mm/h (正常值0~15)。B2 微球蛋白5.28 mg/L (正常值0.7~1.8)。免疫五项:免疫球蛋白G 16.7g/L (正常值7.0~16),免疫球蛋白A:6.7 g/L(0.7~4.0),余指标正常。抗心磷脂IgG 抗体16 U/ml (正常值0~10)。TORCH 病毒抗体(血清):单纯疱疹病毒IgG 抗体阳性,风疹病毒IgG 抗体阳性,巨细胞病毒IgG 抗体阳性。EB 病毒抗体(血清):EB 病毒衣壳抗原IgG 抗体2.472 s/co(正常值<1.100),EB 病毒核心抗原IgG 抗体4.165 s/co (正常值<1.100)。肌酸激酶、乳酸脱氢酶、外科综合正常。副肿瘤综合征相关自身抗体的筛查及脑脊液常规检查神经元抗原谱抗体IgG 抗体检测:脑脊液抗PNMA2(Ma2/Ta)可疑阳性,血清抗PNMA2(Ma2/Ta)弱阳性。脑脊液常规检查:压力正常,蛋白1.32 g/L(正常值0.15~0.45),葡萄糖3.88 mmol/L(正常值2.3~4.1),氯124.3 mmol/L(119~129),潘氏反应+,白细胞4 ×106/L(正常值0~8),红细胞0×106/L(正常值0)。脑脊液免疫球蛋白IgG:200.00 mg/L (正常值0~34)。脑脊液细胞学:白细胞数7 ×106/L,可见少量淋巴细胞,未见异常细胞,可见红细胞。肿瘤标志物:总前列腺特异性抗原:4.56 ng/ml(正常值<4.0),余肿瘤标志物未见明显异常。肺CT 平扫:右肺上叶陈旧性病变。腹部彩超:轻度脂肪肝、胆囊炎、胆囊壁间结石、左肾囊肿、前列腺增生伴钙化灶。阴囊彩超:左侧附睾头精液囊肿。磁共振前列腺平扫:前列腺增生,中央腺体信号结节样欠均匀,双侧腹股沟区、髂血管旁多发淋巴结略肿大。全身PET/CT:全身多发淋巴结略增大伴代谢增高,建议结合病理学检查以除外淋巴瘤。腹股沟淋巴结活检病理诊断:非霍奇金恶性淋巴瘤,WHO 分类:血管免疫母细胞性T 细胞性淋巴瘤(AILT)或外周T 细胞性淋巴瘤(非特殊类型)(PTCL)(见图1)。
磁共振头部平扫:脑内多发腔隙性脑梗死,未见脑干及间脑可疑异常信号。磁共振脑血管成象:左侧椎动脉局部未见显影,考虑闭塞可能。肌电图:上下肢周围神经明显受损表现(脱髓鞘为主)。4 h 脑电图:背景脑电α 节律不明显,泛化前移,调节调幅欠佳;双颞区见较多欠规则尖慢波及不规则δ波,左右不同步出现;双颞区局限性脑功能异常。治疗及预后相关检查结果回报后,请血液科会诊,该患者最终被确诊为淋巴瘤相关副肿瘤综合征。本例确诊之前,一直给予营养神经及对症支持治疗,患者未再出现不认识家人及幻视情况,但多睡懒言及精神状态无明显好转,给予地塞米松15 mg 静点3 d后,患者双下肢无力症状略缓解,精神状态较前好转。MMSE评分28 分。
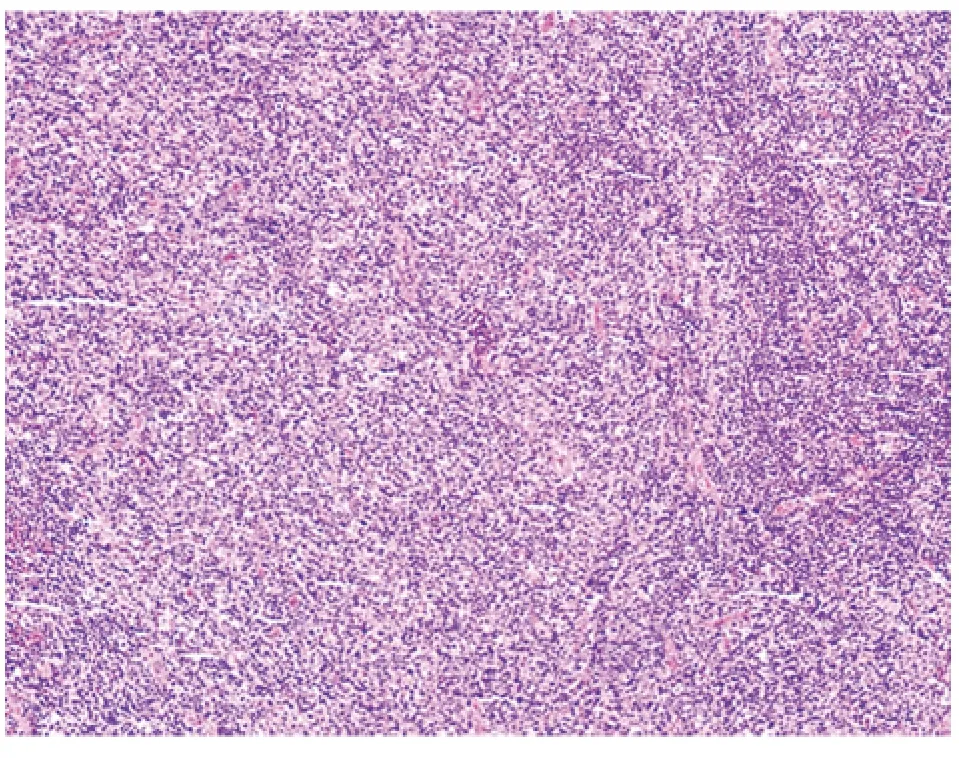
图1 腹股沟淋巴结活检病理诊断:非霍奇金恶性淋巴瘤,WHO分类:血管免疫母细胞性T 细胞性淋巴瘤(AILT)或外周T 细胞性淋巴瘤(非特殊类型)(PTCL)
2 讨论
当肿瘤细胞表达与神经组织相同或相似的抗原时,抗原所介导的免疫应答不仅可以抑制肿瘤细胞的生长,而且产生了抗神经元的抗体,进而造成神经功能的缺失。近些年来,特异性抗神经元抗体的发现为PNS 的诊断提供了重要依据。本例中的抗Ma2 抗体为特异性抗神经元抗体的一种,靶抗原Ma2 是一个42kDa 的蛋白,有人推测Ma2 主要在mRNA 的生物合成中发挥作用[2,3],它分布于正常的脑组织,边缘系统、间脑、脑干、小脑为Ma2 蛋白高表达的区域。因此,当体内产生抗Ma2 抗体时,最易累及上述部位,从而产生相应的临床症状[4~6]。Dalmau 等[7]报道的38 例Ma2 相关性脑炎患者中,95%以上的患者病变累及边缘系统、间脑或脑干,甚至一些患者上述几个部分同时受累。目前国内关于抗Ma2 相关性脑炎的报道很少,在此进一步阐述该病特点,以便引起医务工作者的重视。
典型边缘性脑炎可有近记忆力减退、焦虑、抑郁、错乱、幻觉、癫痫、嗜睡、进行性痴呆等特点。但由于Ma2 蛋白分布的特点,抗Ma2 相关性脑炎除可有上述边缘性脑炎的特点外,还有其独特的临床特点,常见的临床表现有发作性睡病、嗜睡、眼球运动障碍、垂直凝视麻痹、快速眼动期睡眠障碍、癫痫发作、运动减少、复视、眼睑下垂、构音障碍、吞咽困难、共济失调、下丘脑性肥胖、猝倒、双侧面瘫、肌束震颤等。
该患者以全身疼痛伴双下肢无力为首发症状,除此之外还伴有双手脚麻木、反应迟钝、嗜睡、偶有幻觉、眼睑下垂、眼球运动障碍、共济失调、反射消失等表现,从临床表现来看,该患者中枢神经系统及周围神经系统均有累及,入院时头部MRI、脊髓MRI、肺CT 及腹彩未见责任病灶,患者4 h 脑电图示清醒期双颞区见较多欠规则尖慢波及不规则δ 波;肌电图示上下肢周围神经明显受损表现(脱髓鞘为主)。患者此次入院后顽固低钠低氯,加之近期体重下降近10 斤,该患为老年患者,高度怀疑副肿瘤综合征,给予提检肿瘤及副肿瘤综合征相关自身抗体的筛查,结果回报脑脊液抗PNMA2(Ma2/Ta)可疑阳性,血清抗PNMA2(Ma2/Ta)弱阳性。总前列腺特异性抗原:4.56ng/ml(正常值<4.0),阴囊彩超示左侧附睾头精液囊肿。磁共振前列腺平扫示前列腺增生、中央腺体信号结节样欠均匀,双侧腹股沟区、髂血管旁多发淋巴结略肿大。全身筛查未找到明确肿瘤,故提检全身PET/CT,结果回报全身多发淋巴结略增大伴代谢增高,建议结合病理学检查以除外淋巴瘤。行腹股沟淋巴结活检,病理诊断示非霍奇金恶性淋巴瘤。最终患者诊断为淋巴瘤相关的副肿瘤综合征。
从本病例中,总结几个问题如下:(1)该患者中枢神经系统及周围神经系统均有累及,而以往同时累及中枢神经系统和周围神经系统的PNS 是比较少见的[8],此次提示我们遇到同时累及中枢和周围神经系统的病例时,排除可能因素,应考虑副肿瘤综合征。(2)Dalmau 等[7]研究发现,大约75%的PNS 患者有头部MRI 的异常,而这些患者中62%可以累及1个部位以上。此次患者入院后共行2 次头部MRI 检查,均未发现可以解释此次症状及体征的责任病灶,由此可见,在疾病早期,头部MRI 可以没有明显异常,若高度怀疑PNS 时,要注意追踪随访,定期复查。(3)此患者在诊断过程中,抗Ma2 抗体阳性结果回报后,进行了阴囊彩超的检查。而相关研究报道,小于50 岁的男性,抗Ma2 抗体阳性时,提示与睾丸癌关系密切,而老年男性和女性,抗Ma2 抗体阳性时,多提示与非小细胞肺癌、乳腺癌等多种类型肿瘤关系密切[9,10]。因此,任何一个小于50 岁的抗Ma2 相关性脑炎的男性患者应该首先考虑睾丸相关肿瘤。而老年男性及女性患者应考虑非小细胞肺癌、乳腺癌等肿瘤,除非其他的表达Ma2 的肿瘤已被发现。(4)本例中,全身PET/CT 对疾病的最后诊断起到了决定性的作用,PET/CT 对于恶性肿瘤的早期诊断价值已得到了广泛认可,这提示我们当高度怀疑PNS 而又没有筛查到肿瘤时,应用PET/CT 利于疾病的早期发现、早期治疗[11]。(5)对于PNS 的治疗方法除切除原发肿瘤外,主要是免疫治疗,包括皮质类固醇、免疫球蛋白、血浆置换、免疫抑制等的应用。PNS 的部分患者在原发肿瘤切除后或有效治疗后,神经系统的临床表现可以得到改善,有研究证明抗Ma2 抗体阳性的PNS 治疗后临床症状改善明显,部分患者甚至可以完全恢复[4,12~14]。该患者应用地塞米松治疗后,症状有所改善,睡眠较入院时减少,下肢无力情况略缓解,精神状态明显好转。
综上,抗Ma2 相关性脑炎有其特异的临床特点,总结既往报道,常见的特异临床表现主要为发作性睡病、嗜睡、眼球运动障碍、垂直凝视麻痹、癫痫发作、运动减少、复视等。抗Ma2相关性脑炎目前国内鲜有报道,由于其具有相对特异的临床表现,神经科医生应提高对本病的重视,做到早诊断早治疗。
[1]Gultekin SH,Rosenfeld MR,Voltz R,et al.Paraneoplastic limbic encephalitis:Neurological symptoms,immunological findings and tumor association in 50 patients[J].Brain,2000,123:1481-1494.
[2]Rosenfeld MR,Eichen JG,Wade DF,et al.Molecular and clinical diversity in paraneoplastic immunity to Ma proteins[J].Ann Neurol,2001,50:339-348.
[3]Ney DE,Messersmith W,Behbakht K.Anti-Ma2 Paraneoplastic Encephalitis in Association with Recurrent Cervical Cancer[J].J Clin Neurol,2014,10(3):262-266.
[4]Voltz R,Gultekin SH,Rosenfeld MR,et al.A serologic marker of paraneoplastic limbic and brain-stem encephalitis in patients with testicular cancer[J].N Engl J Med,1999,340:1788-1795.
[5]Barnett M,Prosser J,Sutton I,et al.Paraneoplastic brain stem encephalitis in a woman with anti-Ma2 antibody[J].Neurol Neurosurg Psychiatry,2001,70:222-225.
[6]Abdulkader MM,Yousef MM,Al-Abbadi MA,et al.Microscopic Dysgerminoma Associated With Anti-Ma2 Paraneoplastic Encephalitis in a Patient With Gonadal Dysgenesis[J].International Journal of Gynecological Pathology,2013,32:277-282.
[7]Dalmau J,Graus F,Villarejo A,et al.Clinical analysis of anti-Ma2-associated encephalitis[J].Brain,2004,127:1831-1844.
[8]Vogrig A,Ferrari S,Tinazzi M,et al.Anti-Ma-associated encephalomyeloradiculopathy in a patient with pleural mesothelioma[J].Journal of the Neurological Sciences,2015,350;105-106.
[9]Mathew R,Vandenberghe R,GarciaMerino A,et al.Orchiectomy for suspected microscopic tumor in patients with anti-Ma2-associated encephalitis[J].Neurology,2007,68(12):900-905.
[10]Ramos FG,Sanchez AT,Gonzalez RD,et al.Exceptional diagnosis of testicular tumour in a patient with paraneoplastic encephalitis[J].Journal of Clinical Urology,2014,7(3);214-215.
[11]Basu S,Alavi A.Role of FDG-PET in the clinical management of paraneoplastic neuroloficalsyndrome:detection of the underlying malignancy and the brain PET-MRI correlates [J].Mol Imaging Biol,2008,10:131-137.
[12]Bosemani T,Huisman TA,Poretti A.Anti-Ma2-Associated Paraneoplastic Encephalitis in a Male Adolescent With Mediastinal Seminoma[J],Pediatric Neurology,2014,50;433-434.
[13]Kraker J.Treatment of anti-Ma2/Ta paraneoplastic syndrome[J].Curr Treat Options Neurol,2009,11:46-51.
[14]Murphy SM,Khan U,Alifrangis C,et al.Anti Ma2-associated myeloradiculopathy:expanding the phenotype of anti-Ma2 associated paraneoplastic syndromes[J].J Neurol Neurosurg Psychiatry,2012,83(2):232-233.
