脑出血灶周HIF-1α 的表达与脑水肿的实验研究
2015-03-10董静,刘群
董 静,刘 群
缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是由低氧所诱导细胞产生的一种转录因子,于1992 年由Semenza 和Wang 在研究缺氧诱导的EPO 基因时,从细胞核中提取发现,参与氧稳态失衡调节的一个核转录因子[1]。HIF-1 的生理活性主要取决于HIF-1α 亚基的活性和表达[2]。HIF-1α 常氧条件下由于快速降解而无法检测到,缺氧条件下,HIF-1α 与HIF-1β 形成有活性的HIF-1 二聚体,诱导其下游靶基因的表达,通过调节一系列靶基因来调节血管舒张和新生血管生成、红细胞生成和抗炎症反应,从而改善脑组织缺氧和损伤。近年来研究已证实,HIF-1α 在脑缺血的保护性反应中起重要的作用,但有学者推测ICH 后,HIF-1α 的过量表达可能参与神经细胞凋亡等的病理过程,并加重了脑出血(ICH)后脑损伤的过程。近期有学者在动物研究中发现,HIF-1α 与ICH 后水肿密切相关。本研究采用人脑出血灶周组织,应用免疫组化SP 法观察血肿周边神经组织中HIF-1α 蛋白的表达情况,并探讨脑水肿程度与HIF-1α 蛋白表达之间的关系。
1 材料和方法
1.1 一般资料 2013 年1 月~2013 年12 月在吉林医药学院附属医院神经外科收治的高血压脑出血患者24 例,均行开颅经颞叶入路血肿清除术。均符合全国第四届脑血管病学术会议制定的ICH诊断标准,全部为基底节区出血。
1.2 标本的抽取 全部患者在经颞叶皮质“造瘘”清除血肿时,将入路通道范围内紧邻血肿的脑组织保存下来,做为病例组标本,大小约0.1~0.15 mm3,病例组按发病时间分为<6 h、6~24 h、24 h~3 d、>3 d 组。将部分患者皮质“造瘘”起始处即远离血肿2~3 cm 左右脑组织保留下来,做为对照组标本,共6 例。将所取的脑组织分两部分,一部分用液氮运送至-70 ℃冰箱冻存,一部分组织于10%福尔马林固定液中浸泡固定后石蜡包埋。连续切片进行HE 染色和HIF-1α 免疫组化染色。另取血肿周边脑组织约100 mg 进行脑组织含水量测定。
1.3 HIF-1α 免疫组化SP 法检测 鼠抗人HIF-1α 多克隆抗体购于北京博奥森生物技术有限公司,DAB 显色试剂盒、SP-9710 试剂盒均购于福州迈新生物技术开发限公司。免疫组化过程按试剂盒说明进行,以PBS 代替一抗作阴性对照。免疫组化染色细胞质阳性为棕黄色结果,胞核呈蓝色,胞浆呈红色,红细胞呈桔红色,其它成分呈深浅不同红色。数码相机拍照,在血肿周围和对照组随机各取5 个视野,图像采用Motic Images advanced 3.2 彩色图像分析系统,所测得的灰度值越大阳性越弱,灰度值越小阳性越强。
1.4 RT-PCR 方法检测HIF-1αmRNA 定量Rtizol 裂解细胞后抽提总RNA,取1 ml 测光密度值,DNA 消化。使用日本Toyobo 公司试剂盒逆转录体系进行cDNA 合成.引物由北京鼎国昌盛生物技术有限公司设计合成,序列如下:HIF-1α 上游:CCTATGTAGTTGTGGAAGTTTATGC;HIF-1α 下 游:ACTAGGCAATTTTGCTAAGAATG。PCR 体系:cDNA:2 μl,Taq 酶0.25 μl,总反应体系:25 μl。PCR循环参数:94℃预变性,2 min,94 ℃变性,30 s,30 次循环,55 ℃退火,30 s,30 次循环,72 ℃延伸,1 min,30 次循环。反应后将制备好的cDNA 放-20 ℃冷冻保存。扩增产物经琼脂糖凝胶电泳分析。通过凝胶成像系统进行拍照,记录结果。产物定量分析:利用ABI PRISM 7700 Sequence Detector,临测每个循环的荧光强度,通过Ct 值和标准曲线的分析对起始模板进行定量分析。
1.5 脑组织含水量测定 采用干湿重法测定脑组织含水量,取脑组织约150 mg,电子天平称湿重后置于100 ℃烤箱烘烤24 h 至恒重,称取干重。计算公式:按Blliot 公式脑组织含水量(%)=(湿重-干重)/湿重×100%,精确度为0.11 mg。
2 结果
2.1 免疫组化检测HIF-1α HIF-1α 主要在神经元、神经胶质细胞的胞核中表达,其中胞核染色阳性的细胞多聚集在靠近血肿边缘的坏死区及血管相对稀少的区域,胞质中也有表达,DAB 染色成棕褐色(见图1、图2)。对照组及出血灶周人脑组织中HIF-1α 的灰度值测定(见表1),对照组与6 h 组相比无差异(P >0.05),对照组与出血组各组相比均有统计学意义(P <0.05),且出血组各组之间亦有差异(P <0.05)。在出血6 h 后,HIF-1α 的阳性细胞增加,灰度值减少,24 h~3 d 阳性细胞数最多,灰度值最低,之后逐渐上升。
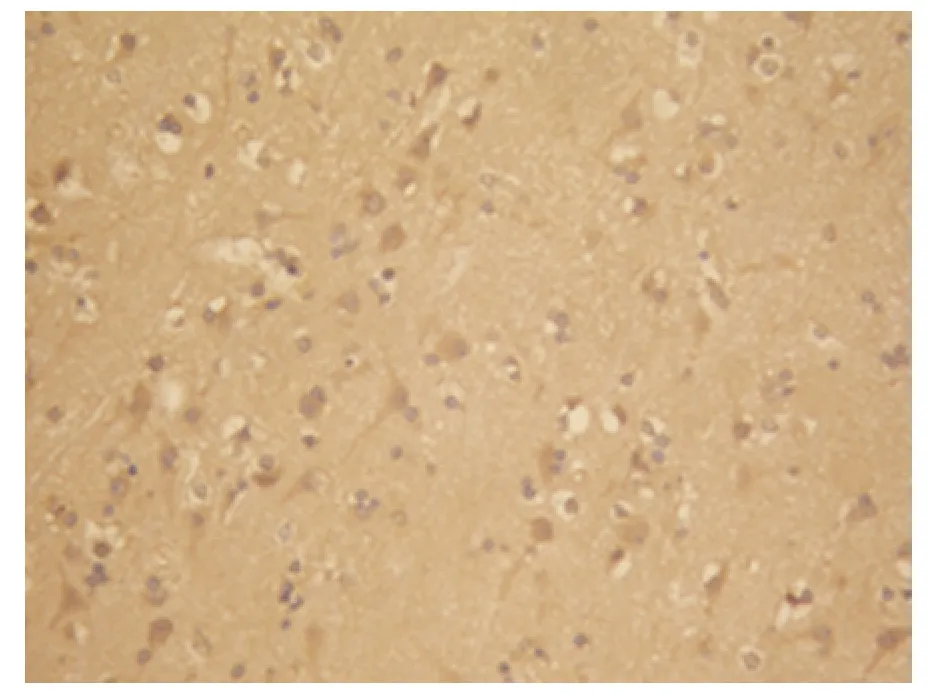
图1 6~24 h 组HIF-1α 阳性表达细胞(SP×400)
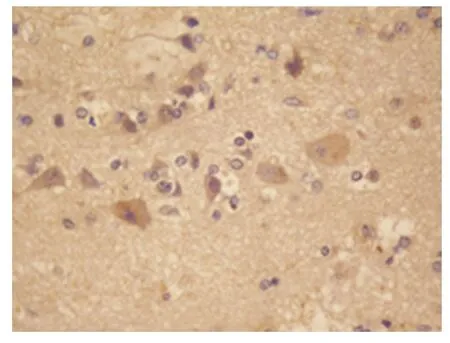
图2 24 h~3 d HIF-1α 阳性表达细胞(SP×400)
表1 各组HIF-1α 灰度值的比较(,n=5)

表1 各组HIF-1α 灰度值的比较(,n=5)
与对照组相比,aP >0.05;与<6 h 组比较,bP <0.05;与6~24 h 组比较,cP <0.05;与24 h~3 d 组比较,dP <0.05
表2 ICH 后HIF-1α mRNA 表达()
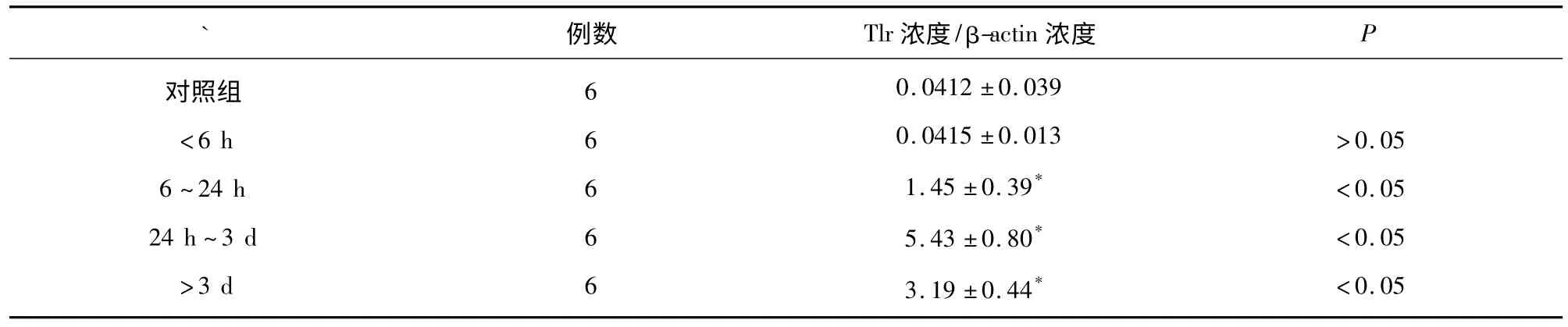
表2 ICH 后HIF-1α mRNA 表达()
与对照组比较* P <0.05

表3 各组脑组织含水量的比较
2.2 RT-PCR 经PCR 扩增后,在近145bp 处出现HIF-1α mRNA 表达产物,分别于各时间点观察对照组及出血组HIF-1α mRNA 的表达,HIF-1α 的PCR 产物相对定量分析结果(见表2、图3),结果可见对照组中有少量表达,血肿灶周6 h 出现HIF-1α阳性细胞,24 h 进一步增加,24 h~3 d 时HIF-1α 阳性细胞表达达高峰,3 d 后仍可见HIF-1α 的表达,但较3 d 时下降(两组相比均有统计学意义,P <0.05)。
2.3 ICH 后脑组织含水量变化 见表3,在出血6 h 内含水量即开始增高,24 h 后较明显增高,3 d左右达到峰值,之后减轻(P <0.05)。
2.4 ICH 组HIF-1α 灰度值与脑组织水含量关系 用直线回归进行分析显示(见图4):ICH 后各时间点HHIF-1α 灰度值与脑组织水含量的变化呈负的直线相关关系(r=-0.85849,P <0.001),24 h~3 d 显著降低(P <0.05);3 d 达到最低;HIF-1α 含量与脑组织含水量均表现出一致的时相依赖性变化,即随着HIF-1α 表达的增加脑组织水含量也增加,且相关关系非常密切。
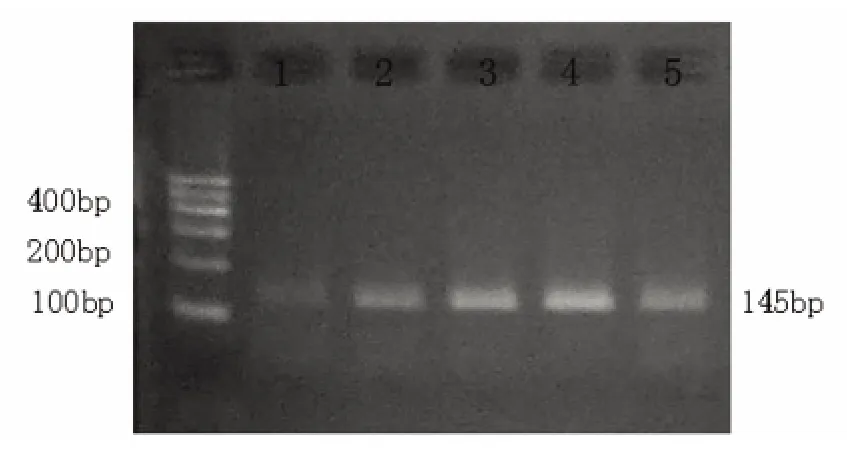
图3 HIF-1α 的PCR 产物相对定量分析
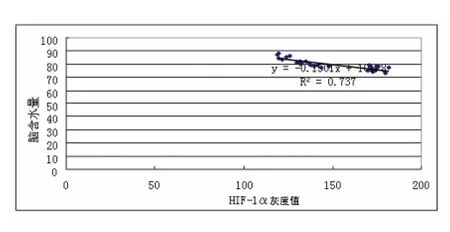
图4 出血灶周脑组织含水量与HIF-1α 灰度值表达
3 讨论
本研究发现:HIF-1α 在ICH 出血灶边缘及坏死区均有明显表达,主要表达于神经细胞核,胞质中也有表达,这和国外一些学者的研究结果基本一致[3],且随着出血时间的延长,HIF-1α 表达的阳性率及表达强度也逐渐增加,3 d 达高峰,后逐渐下降,出血后不同时间点阳性表达率比较(P <0.05),有显著性差异,提示HIF-1α 的表达与神经细胞缺血、缺氧的时间密切相关[4,5]。脑组织缺血、缺氧均可诱导ICH周围缺血区HIF-1α 表达增加[6]。
近二十余年来,动物实验已经证实,ICH 后血肿形成分泌的凝血酶可导致ICH 后脑水肿的形成和神经功能的损伤[7]。1999 年,Xi 等[8]在实验中再一次证实凝血酶可导致ICH 后大鼠脑组织水肿。综上所述,现已达成专家共识。凝血酶本身是引起ICH 早期脑水肿的重要因素。近年来,有学者证明在ICH过程中,凝血酶大量释放,能刺激HIF-1α 蛋白的表达[9]。Richard 等[10]在体外平滑肌细胞培养的研究中发现,在正常氧分压下,凝血酶可以上调HIF-1α的表达。凝血酶导致ICH 后脑水肿的病理生理机制较为复杂,目前已进行了一些相关动物实验研究,提出凝血酶对BBB 的破坏和对神经细胞的毒性作用可能是ICH 后脑水肿形成的重要机制,也有动物实验表明,凝血酶及HIF-1α 共同参与ICH 后脑水肿的形成。
以往的研究表明,ICH 6 h 后,血肿周围开始出现水肿,24 h~3 d 内脑水肿的程度加重,一般认为,ICH 后3 d 水肿程度达到高峰。我们在实验中也观察到,HIF-1αmRNA 在ICH 后3 d 阳性表达,显著高于其它时间点。而且我们经过对ICH 后不同时间HIF-1α 表达的情况与脑水肿的程度进行相关性分析,结果显示HIF-1α 的表达与脑水肿的程度成正相关。国内个别研究有类似发现[11],HIF-1α 表达主要位于出血血肿坏死边缘区域的脑组织,24 h 后HIF-1α 阳性表达率为94.4%,明显高于其它时间,提示HIF-1α 的表达与脑组织水肿程度关系密切。ROS已被证实与脑组织受损后神经细胞发生水肿有直接关系,因而HIF-1α 表达增加的情况与脑水肿的程度有相关性可能与此机制有关。
一般认为低氧环境是诱导HIF-1α 表达增强的一个重要因素[12]。在常氧条件下,细胞浆内HIF-1α的表达水平很低,但在低氧条件下,HIF-1α 却大量集聚并转移至细胞核中。我们的实验也证实ICH 后HIF-1α 主要表达于灶周神经细胞胞核,染色阳性的细胞多聚集在靠近血肿边缘的坏死区及血管相对稀少的区域,和国内某些研究一致。本实验研究结果显示:ICH 后采用RT-PCR 法能明显的检测到HIF-1α 的表达,而对照组未见HIF-1α 蛋白信号,提示在ICH 过程中,存在其他调节HIF-1α 表达的因素,低氧可能并非诱导HIF-1α 蛋白表达增强的唯一机制。
据近年的研究,认为HIF-1α 对出血性卒中有一定的保护作用。HIF-1α 激活转录多种靶基因,增加缺氧组织的氧气供应,维持内环境稳定,对机体形成保护作用。ICH 后,HIF-1α 可以通过靶基因促进VEGF 表达,促使新生血管生成[13,14],改善脑血流动力学,使脑缺血得以迅速恢复,保护脑细胞。ICH后,出血灶周边脑组织处于持续的缺血缺氧状态,而缺氧可使多种基因差异表达,引起相关蛋白及细胞因子变化的连锁反应,导致脑水肿,颅内压增高且启动脑组织细胞的抗损伤和修复反应[15]。HIF-1α 是缺氧状态下血管生成的核心调控因子,通过影响其他生长因子的表达,而直接参与血管生成的全过程[16,17],在这一过程中因对缺氧的适应性可能是脑组织抗损伤和修复的关键。而细胞对缺氧的适应性主要靠HIF-1α 调节[18],它能减少细胞发生凋亡的数目有助于神经功能的恢复。
Papandreou 等[19]研究发现,低氧时HIF-1α 可通过诱导丙酮酸脱氢酶激酶-1 的表达,使得细胞内氧张力增高,改善ICH 后的能量供应,脑损伤减轻。另外,Helton 等[20]通过敲除大鼠大脑HIF-1α 基因发现,不仅未增加脑缺氧缺血损伤,反而减轻了缺氧缺血后脑损伤,这一结果使我们对HIF-1α 的脑保护作用仍有待进一步探讨。普遍认为,轻度缺氧时,HIF-1α 产生缺氧耐受性,发挥神经保护作用;长期重度缺氧时,诱导神经细胞凋亡,具有神经毒性作用[21,22]。实验表明[23]严重长时间缺氧能使HIF-1α去磷酸化,去磷酸化的HIF-1α 导致p53 稳定性增加,介导缺氧诱导的细胞凋亡。综上可见,HIF-lα 具有双重调节作用,在不同的缺氧状态、对细胞发挥着保护或促凋亡的作用,两者谁占主导与缺氧严重程度有关[24]。
目前HIF-1α 在神经系统疾病中的研究正在成为热点,HIF-1α 在ICH 中所发挥的作用,是继发性缺血损伤还是诱导血管新生来促进缺血周边组织的侧枝循环以改善供血,在ICH 时如何调控HIF-1α 的表达值得今后研究。
[1]Flashman E,McDonough MA,Schofield CJ.OS-9:another piece in the HIF complex story[J].Mol Cell,2005,17(4):472-473.
[2]Brown JM,Wilson WR.Exploiting tumor hypoxia in cancer treatment[J].Net Raw Cancer,2004,4(6):437-447.
[3]Sharp ER,Bergeron M,Bemaudin M.Hypoxia-inducible factor in brain[J].Adv ExpMed Biol,2001,502:273-291.
[4]Bemaudin M,Nedelec AS,Divoux D,et al.Normobaric hypoxia induces tolerance to focal cerebral ischemia in association with all increased expression of hypoxia-inducible factor-l and its target genes,erythropoietin in and VEGF in the adult mouse brain[J].J Cerebra Blood Flow Metal,2002,22(47):393-403.
[5]Chevez JC,Lamanna JC.Activation of hypoxia-inducible factor-1 in the rest cerebral cortex after transient global ischemia:potential role insulin like growth factor-1ɑ[J].J Neurosis,2002,22(20):8922-8931.
[6]Marti HJ,Bemaudin M,Bellail A,et al.Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia[J].Am J Pathos,2000,156(3):965-976.
[7]Hua Y,Xi G,Keep RF,et al.Complement activation in the brain after experimental intracerebral hemorrhage[J].Neurosurg,2000,92:1016-1622.
[8]Xi G,Hua Y,Bhasin RR,et al.Mechanisms of edema formation after intracerebral hemorrhage,effects of extravasated red blood cells Ollblood flow and blood-brain barrier integrity[J].Stroke,2001,32:2932-2938.
[9]Jiang Y,Wu J,Keep RF,et al.Hypoxia-Inducible Factor-1 a Accumulation in the Brain After Experimental Intracerebral Hemorrhage[J].Cerebral Blood Flow Metab,2002,22(6):689-696.
[10]Richard DE,Berra E,Pouyssegur J.Nonhypoxic pathway mediates the induction of hypoxia-inducible factor lalpha in vascular smooth muscle cells[J].J Biol Chem,2000,275(35):26765-26771.
[11]Du F,Wu XM,Gong Q,et al.Hyperthermia conditioned atrocity-cultured medium protects neurons from ischemic injury by the up-regulation of HIF-1 alpha and the increased anti-apoptotic ability[J].Euro J Pharmacology,2011,666(1/2/3):19-25.
[12]Schumacker PT.Hypoxia-inducible factor-1 (HIF-1)[J].Crib Care Med,2005,33(12):4232-4251.
[13]Yeh SH,Ou LC,Gean PW,et al.Selective inhibition of early but not late-expressed HIF-1α is neuroprolective in rats after focal ischemic brain damage[J].Brain Pathos,2011,2(3):249-262.
[14]Chen C,Ostrwski RP,Zhou C,et al.Suppression of hypoxia inducible factor-1 alpha and its downstream genes reduces acute hyperglycemia hemorrhagic transformation in a rat model of cerebral ischemic[J].J Neurosis Res,2010,89(9):2046-2055.
[15]Piret JP,Mottet D,Raes M,et al.Is HIF-l alpha a proof all antiapoptotic protein7[J].Brioche Pharmacology,2002,64(5/6):889-892.
[16]Hirota K.Hypoxia-indelible factor l,amasser transcription factor of cellular hypoxic gene expression[J].J Amnesty,2002,16(2):150-159.
[17]Huang LE,BunnHF.Hypoxia-indelible factor and its biomedical relevance[J].J Biol Chem,2003,278(22):19575-19578.
[18]Hammond EM,Garcia AJ.The role 0f p53 in hypoxia-induced apoptosis[J].Brioche Biolphys Ras Common,2005,331(3):718-725.
[19]Papandreou I,Cairns RA,Fontana L,et al.HIF-I mediates adaptation to hypoxia by actively down regulating mitochondrial oxygen consumption[J].Cell Metal,2006,3(3):187-197.
[20]Helton R,Cui J,Scheele JR,et al.Brain-specific knock-ore 0f hypoxia-inducible factor-1 alpha reduce rather than increases hypoxicischemic damage[J].J Neuroses,2005,25(16):4099-4107.
[21]Matsuda T,Abe T,Wu JL,et al.Hypoxia-inducible factor-1 DNA induced angling gneiss in a rat cerebral ischemia model[J].Neural Res,2005,27(5):503-508.
[22]Liu J,Narasimhan P,Yu F,et al.Neumprotection by hypoxic preconditioning involves oxidative stress-mediated expression of hypoxia-inducible factor and erythropoietin[J].Stoke,2005,36(6):1264-1269.
[23]Hammond EM,Garcia AJ.The role of p53 in hypoxia-induced apoptosis[J].Brioche Biolphys Raps Common,2005,331(3):718-725.
[24]Chen W,Ostrowski RP,Obenaus A,et al.Prudent or prosurvival:two facets of hypoxia inducible fator-1 in prenatal brain injury[J].Exp Neural,2009,16:7-15.
