骨髓间充质干细胞治疗血管性痴呆大鼠行为学及海马CaM、CaMKⅡ表达水平的影响
2015-03-10董艳军官志忠
井 沆,田 茂,董艳军,官志忠,2,肖 雁
血管性痴呆(vascular dementia,VaD)是老年期痴呆的主要类型之一,是由一系列脑血管因素(脑组织梗死、低灌注或出血等)导致脑组织损害引起的以认知功能障碍为特征的综合征[1]。随着人口老龄化和脑血管疾病发病率的上升,VaD 的发病率也逐年上升。因此,为VaD 患者提供有效地治疗是亟待解决的问题。近期研究已发现,钙通道及其相关信号的改变与VaD 的发生密切相关[2],可能是引起学习记忆能力下降的主要因素。
1 材料和方法
1.1 材料
1.1.1 动物 成年健康SD 大鼠60 只,购自贵阳医学院动物研究中心[合格证号:SCXK (黔)200220001]。体重200~250 g,雌雄各半;4 周龄清洁级SD 雄性大鼠2 只(BMSCs 分离培养用),自由饮食。
1.1.2 试剂 胎牛血清、低糖DMEM 培养基、0.25% 胰蛋白酶液购于HyClone 公司。CD90、CD29、CD44、CD45 流式检测抗体购自BD 公司。BHA、BFGF 购于美国Sigma 公司。
1.2 方法
1.2.1 BMSCs 的原代分离培养 取4 周龄健康SD 雄性大鼠,10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,无菌条件取两侧股骨及胫骨,PBS 清洗3 次,用添加青-链霉素的L-DMEM 培养基冲洗骨髓腔,反复吹打,将冲出的骨髓制成单细胞悬液,1000 r/m 离心10 min,弃上清,加入事先配好的15%FBS的培养液,吹打均匀接种于25 cm2的培养瓶中,置37 ℃、5%CO2湿度培养箱中进行培养。
1.2.2 BMSCs 的纯化传代及鉴定 取P5 代已纯化的BMSCs,0.25% 胰蛋白酶消化,4 ℃离心,1000 r/m,10 min,用PBS 清洗细胞3 次,各管分别加入流式检测单克隆抗体CD90、CD29、CD44、CD45,同时每管样品设立独立同型阴性对照,于流式细胞仪进行鉴定分析。
1.2.3 BMSCs 的诱导鉴定和标记 选择第3代BMSCs,加入含10 ng/ml bFGF 的L-DMEM(10%FBS)预诱导24 h,更换培养液,PBS 洗3 次,再加入含200 μmol/L BHA,2%DMSO 的无血清DMEM 诱导5 h,用95% 乙醇固定40 min,PBS 洗5 次×3 min,加入3%H2O2室温避光孵育15 min,PBS 洗3次×3 min,各孔加入100 μl NSE、Nestin 一抗,4 ℃孵育过夜,对固定的细胞进行免疫组化鉴定分析,具体步骤按照免疫组化试剂盒进行。诱导后的BMSCs 于移植前24 h 在其培养液中加入BrdU,使其浓度为10 μmol/L,继续培养48 h,离心收集标记后的BMSCs,备用。
1.2.4 VaD 模型的制备 适应性喂养1 w 后,随机分为模型组和对照组。大鼠术前12 h 禁食,4 h 禁水,改良四血管法进行VaD 模型复制;对照组12 只,只分离椎动脉和颈总动脉,不进椎动脉凝闭和夹闭。
1.2.5 学习记忆能力测定 造模后约一个月用Morris 水迷宫检测大鼠的学习记忆能力,进行Morris 水迷宫定向航行实验和空间探索实验,第1~4 天进行定向航行试验:每日将大鼠按Ⅰ、Ⅱ、Ⅲ、Ⅳ象限顺序从各入水点靠池壁放入水中,记录60 s 内大鼠从入水到爬上平台(固定于第Ⅳ象限)所需时间即逃避潜伏期。每只大鼠每天训练4 次。第5 天撤去平台,进行空间探索实验:记录大鼠第一次穿越平台区域的时间以及60 s 内总的穿越平台区域次数。将符合VaD 标准的27 只大鼠通过随机数字表法随机分为两组:(1)模型组(n=12),侧脑室注射1 ml DMEM 基础培养液;(2)BMSCs 组(n=15),侧脑室注射移植BMSCs 密度为1 ×106,1 ml,以1 μl/min 的速度匀速注射;移植4 w 后,模型组死亡6 只,存活6 只,BMSCs 治疗组死亡2 只,存活13只。另对照组死亡5 只,存活7 只。
1.2.6 Morris 水迷宫认知功能检测 BMSCs移植4 w 后,通过Moris 水迷宫实验检测大鼠的空间学习和记忆能力,方法同上。
1.2.7 海马钙调蛋白(calmodulin,CaM)及钙调蛋白依赖性激酶Ⅱ(calcium/calmodulin-dependent protein kinaseII,CaMKⅡ)mRNA 表达水平 取海马组织加入组织裂解液制备10%组织匀浆。采用Trizol 一步法提取实验鼠海马组织总RNA,取3 μg RNA 样品逆转录cDNA,以cDNA 为模版扩增CaM、CaMKⅡ和β-actin 基因。CaM 引物序列,上游:3’-GAACCCAACAGAGGCTGAACT-5’,下 游:5 ’ -CACGGATTTCTTCTTCGCTATC-3’,片段长度137 bp;CaMK Ⅱ引物序列,上游:3’-AATGCCAGGAGGAAACTGAAG-5’,下游:5’-ATGGTGGTGTTGGTGCTCTC-3’,片段长度134 bp;β-actin 引物序列,上游:3’-AGCCATGTACGTAGCCATCC-5’,下游:5’-ACCCTCATAGATGGGCACAG-3’,片段长度115 bp。ABI Step One Plus 型实时荧光定量PCR 仪采集CaM、CaMKⅡ及内参β-actin 扩增各循环荧光信号,以SDS1.4 软件(Applied Biosystems)进行荧光收集和资料分析。SDS1.4 软件分析其△△Ct 值及RQ(relative quantity)值,RQ=2-△△Ct。分析实验结果时以β-actin为内对照,计算各种基因的相对表达水平。
1.2.8 海马CaMKⅡ蛋白表达 蛋白提取并定量,Western-blot 检测CaMKⅡ蛋白表达。Western blot 结果用GDS-8000 型UVP 凝胶成像系统照像,以Labworks 软件分析结果时以β-actin 蛋白条带作为内参照,计算CaMKⅡ蛋白条带与β-actin 蛋白条带像素灰度的百分比值作为CaMKⅡ基因蛋白质表达的相对水平。
1.2.9 统计学方法 采用SPSS 13.0 统计分析软件,数据以均数±标准差()表示,组间比较采用单因素方差分析或非参数检验,P <0.05 表示差异有统计学意义。
2 结果
2.1 Morris 水迷宫行为学测试结果 对照组、模型组和BMSCs 组移植后30 d,进行Morris 水迷宫行为学测试。模型组大鼠平均逃避潜伏期明显长于对照组(P <0.05),表明VaD 模型大鼠定向航行能力降低。第5 天观察空间探索能力,移走平台,以在原平台象限(第1 象限)的活动时间为指标,发现与对照组比较,模型组和BMSCs 组第一次穿越平台所用时间延长(P <0.05),穿越站台次数明显减少(P <0.05)。表明VaD大鼠学习能力降低。而模型组与BMSCs 组相比,BMSCs 组逃避潜伏期明显缩短,第一次穿越平台时间减少,穿越平台次数增加(P <0.05)(见表1)。
2.2 海马CaM、CaMKⅡmRNA 及海马CaMKⅡ蛋白表达水平 用Real-time PCR 方法检测到对照组、模型组和BMSCs 细胞治疗组3 组中,模型组和BMSCs 细胞治疗组海马CaM 与CaMKⅡmRNA表达水平都较对照组明显增高(P <0.01),而BMSCs 治疗后海马CaM 与CaMKⅡmRNA 表达水平较模型对照组降低(P <0.05)(见图1)。
2.3 海马CaMKⅡ蛋白表达水平 与对照组相比模型组和干细胞治疗组CaMKⅡ表达水平明显增高(P <0.01),而干细胞治疗后CaMKⅡ表达水平较模型对照组降低(P <0.05)(见图2)。
表1 对照组、模型组和BMSCs 组大鼠定向航行实验及空间探索实验结果的比较()

表1 对照组、模型组和BMSCs 组大鼠定向航行实验及空间探索实验结果的比较()
与对照组比较* P <0.05;与模型组比较#P <0.05

图1 CaM、CaMKⅡmRNA 表达水平
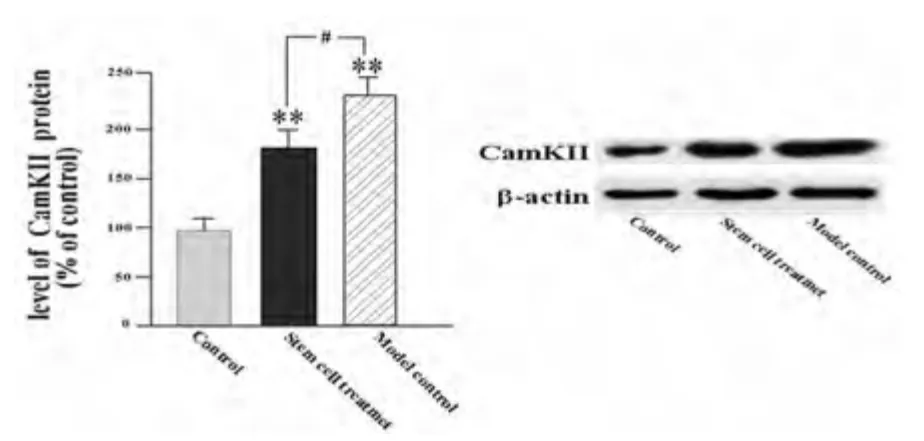
图2 海马CaMKⅡ蛋白表达水平
3 讨论
在VaD 的发病机制中,钙超载被认为是VaD 发病机制中一个重要致病因素,但是钙超载在VaD 记忆和认知功能低下的机制尚未阐明清楚。近期研究已发现,钙通道及其相关信号的改变与VaD 的发生密切相关[2],可能是引起学习记忆能力下降的主要因素。在VaD 患者中往往由于脑组织的缺血缺氧造成大量钙离子的内流,然后通过激活内质网、线粒体钙通道、使钙离子大量释放进入细胞质,从而导致钙离子超载,钙稳态平衡被破坏,过量的钙离子通过激活一系列的钙依赖性酶促反应从而促进了神经元细胞的凋亡[3,4]。
Ca2+通过与细胞内的受体主要是CaM 相结合,使CaM 构象发生变化,作用于钙调蛋白依赖性激酶(calcium/calmodulin-dependent protein kinase,CaMK),然后再作用于下游的信号分子[5]。CaMKⅡ在动物的Ca2+/CaM 介导的信号系统中起着重要作用。当Ca2+内流时能够使CaMKⅡ磷酸化而被激活,活化的CaMKⅡ自身磷酸化,而且当Ca2+下降后CaMKⅡ的活性仍能保持其状态,推测CaMKⅡ可能是记忆的分子开关,在诱导长时程增强(long-term potentiation,LTP)的过程中起着关键的作用[6]。海马被认为与空间记忆功能障碍密切相关[7],特别是与年龄相关性认知功能损害有关[8]。本研究通过对对照组、模型组和BMSCs 细胞治疗组大鼠的海马组织内CaM、CaMKⅡmRNA 和蛋白表达水平均进行了检测,结果显示,BMSCs 组和模型组海马组织CaM mRNA、CaMKⅡmRNA 和CaMKⅡ蛋白表达均显著高于对照组,并且与行为学上的变化相一致。而BMSCs 治疗后,上述指标降低,说明由于缺血所引起的钙超载从而导致海马组织CaM 和CaMKⅡ表达增高,在侧脑室内移植经诱导的BMSCs 后,可能通过降低与钙信号相关的CaM 和CaMKⅡ等的表达,来缓解缺血引起的神经元损伤,从而改善VaD 鼠的认知功能。
[1]Meguro K,Tanaka N,Nakatsuka M,et al.Vascular lesions in mixed dementia,vascular dementia,and Alzheimer disease with cerebrovascular disease:The kurihara project[J].J Neurol Sci,2012,322(1~2):157 -160.
[2]Roman GC.Brain hypoperfusion:a critical factor in vascular dementia[J].Neurol Res,2004,26(5):454 -458.
[3]Min D,Guo F,Zhu S,et al.The alterations of Ca2+/calmodulin/CaMKⅡ/CaV1.2 signaling in experimental models of Alzheimer’s disease and vascular dementia[J].Neurosci Lett,2013,538:60 -65.
[4]吕佩源,李文斌,尹 昱,等.血管性痴呆小鼠海马神经细胞静息态[Ca2+]i 及CaM mRNA、CaMPKⅡmRNA 表达的变化[J].中国应用生理学杂志,2004,20(2):146 -149.
[5]Zhao Y,Yang H,Meng K,et al.Probing the Ca2+/CaM-induced secondary structural and conformational changes in calcineurin[J].Int J Biol Macromol,2014,64:453 -457.
[6]Zeng S,Holmes WR.The effect of Noise on CaMKⅡactivation in a dendritic spine during LTP induction[J].J Neurophysiol,2010,103(4):1798 -1808.
[7]Yassa MA,Stark SM,Bakker A,et al.High-resolution structural and functional MRI of hippocampal CA3and dentate gymsin patients with amnestic mild cognitive impairment[J].Neuroimage,2010,51(3):1242 -1252.
[8]Haberman RP,Colantuoni C,Stocker AM,et al.Prominent hippocampal CA3gene expression profile in neurocognitive aging[J].Neurobiol Aging,2011,32(9):1678 -1692.
