FOXQ1基因在肝细胞性肝癌中的表达及与临床病理特征的关系
2015-03-09黄恒
黄 恒
(泸州医学院附属中医医院 普外科, 四川 泸州, 646000)
FOXQ1基因在肝细胞性肝癌中的表达及与临床病理特征的关系
黄恒
(泸州医学院附属中医医院 普外科, 四川 泸州, 646000)
摘要:目的探讨叉头框蛋白Q1(FOXQ1)基因表达与肝细胞肝癌(HCC)相关临床病理特征之间的关系。方法选择病理学检查确诊,进行肝胆外科手术治疗的肝癌患者68例,术中分别取新鲜肝癌组织及癌旁组织。以免疫组织化学法检测样本中FOXQ1蛋白的表达,分析其与临床相关病理特征之间的关系。结果FOXQ1蛋白阳性表达主要定位于肝癌细胞的胞质内,肝癌组织中FOXQ1阳性表达率为61.76%, 癌旁组织FOXQ1阳性表达率为11.76%, 2组比较差异有统计学意义(P<0.05)。HCC中FOXQ1蛋白表达与年龄、TNM分期、肿瘤分化程度、肿瘤数目和肿瘤大小等参数有相关性。Spearman等级相关性分析表明随TNM分期的增高,FOXQ1蛋白表达升高(r=0.667,P<0.05); 随肿瘤分化程度降低,FOXQ1蛋白表达显著升高(r=-0.564,P<0.01)。结论FOXQ1在肝癌细胞的细胞质中高表达,其检测可作为HCC恶性程度及肿瘤分化程度的判断指标。
关键词:叉头框蛋白Q1; 肝细胞肝癌; 病理特征; 免疫组织化学
肝细胞性肝癌(HCC)是中国常见的恶性肿瘤之一,其死亡率占所有肿瘤的第3位[1]。中国的HCC患者多数发生在肝硬化的基础上,多数患者就诊时已为中晚期HCC,可手术切除的不到20%,适合局部消融患者有限[2]。因此寻找肝癌发生发展中的重要基因及蛋白,寻找早期诊断和治疗的有效途径有其重要意义[3]。叉头框(FOX)蛋白是一类广泛存在真核细胞的转录因子,研究发现叉头框蛋白Q1(FOXQ1)作为转录因子,其活性的高低、亚细胞定位及信号通路均与肿瘤的发生发展密切相关,其异常高表达见于结肠癌、卵巢、乳腺、非小细胞肺癌、膀胱癌、神经胶质瘤、胰腺导管癌[4]。关于其在HCC患者肝癌组织中的表达与临床病理特征的关系研究报道甚少。本研究使用免疫组织化学法检测FOXQ1在肝癌组织中的表达,探讨其与临床相关病理特征之间的关系,报告如下。
1资料与方法
1.1 一般资料
选择2013年9月—2014年9月于泸州医学院附属医院病理学检查确诊,并进行肝胆外科手术治疗的肝癌患者68例,所有患者术前均未放疗、化疗。其中男52例,女16例;年龄23~72岁,中位年龄52岁。Gleason组织学分级[5]: 高分化组(Gleason评分2~4)11例,中分化组(Gleason评分5~6)38,低分化组(Gleason评分7~10)19例。根据美国癌症联合委员会(AJCC)及国际抗癌联盟(UICC)推荐的TNM分期标准[6]: Ⅰ~Ⅱ期44例,Ⅲ~Ⅳ期24例。本研究经泸州医学院附属医院肝胆外科伦理道德委员会批准,所有患者均签署知情同意书。
1.2 方法
以免疫组织化学法检测样本中FOXQ1蛋白的表达。所有患者术中分别取新鲜肝癌组织及癌旁组织(距癌灶边缘至少2 cm的正常肝组织,并经病理学检查确定无肿瘤组织残余),常规10%中性福尔马林固定,石蜡包埋,置于-20 ℃冰箱待检测。使用切片机切取厚度约4 μm连续切片,高温抗原修复,预处理组织切片,滴加一抗——鼠抗人FOXQ1单克隆抗体(美国Santa Cruz公司),3%过氧化氢去离子水孵育5 min,PBS冲洗3 min×3次,加入二抗(北京中杉金桥生物技术有限公司)和辣根过氧化物酶标记的鼠抗兔二抗(美国Abgent公司),37 ℃孵育15 min,PBS冲洗3 min×3次;作DAB染色,苏木素复染,常规脱水,封片,盐酸酒精分化、100%乙醇脱水、氨水返蓝5 min; 二甲苯透明、中性树胶封片、镜检。以磷酸盐缓冲液(PBS)代替一抗做阴性对照。
1.3 结果判断
FOXQ1蛋白染色阳性为胞质呈棕褐色。结果由2名不知情资深病理医师进行双盲评判,在200倍光镜下以阳性细胞百分率及显色深浅对染色结果评分。标准如下: ① 阳性细胞百分率,未见阳性细胞者为0分;1%~33%为1分;34%~66%为2分;>67%为3分。② 染色强度:0=阴性染色,1=弱染色,2=中度染色,3=强染色。阳性细胞百分比和染色强度得分判断免疫组化结果:0分为阴性,1~2分为弱阳性(+),3~4分为中度阳性(2+),5~6分为强阳性(3+)。
1.4 统计学处理
所有数据均应用SPSS 13.0进行统计分析,计数资料以百分率表示,组间比较采用χ2检验或Fisher精确检验。等级资料的相关性使用Spearman等级相关性分析,P<0.05为差异有统计学意义。
2结果
2.1 肝癌组织与癌旁组织样本中FOXQ1蛋白表达
肝癌细胞形态不规则,边缘模糊,细胞间出现大量纤维化及结缔组织,FOXQ1蛋白阳性表达主要定位于肝癌细胞的胞质内,呈大面积黄染;癌旁组织细胞形态规则,边缘清晰,细胞质几乎无FOXQ1蛋白表达。见图1。
68例肝癌组织中FOXQ1阳性表达42例(61.76%),阴性26例(38.24%);68例癌旁组织中,FOXQ1阳性表达8例(11.76%),阴性表达60例(88.24%)。肝癌组织与癌旁组织FOXQ1蛋白表达率差异有统计学意义(P<0.05)。
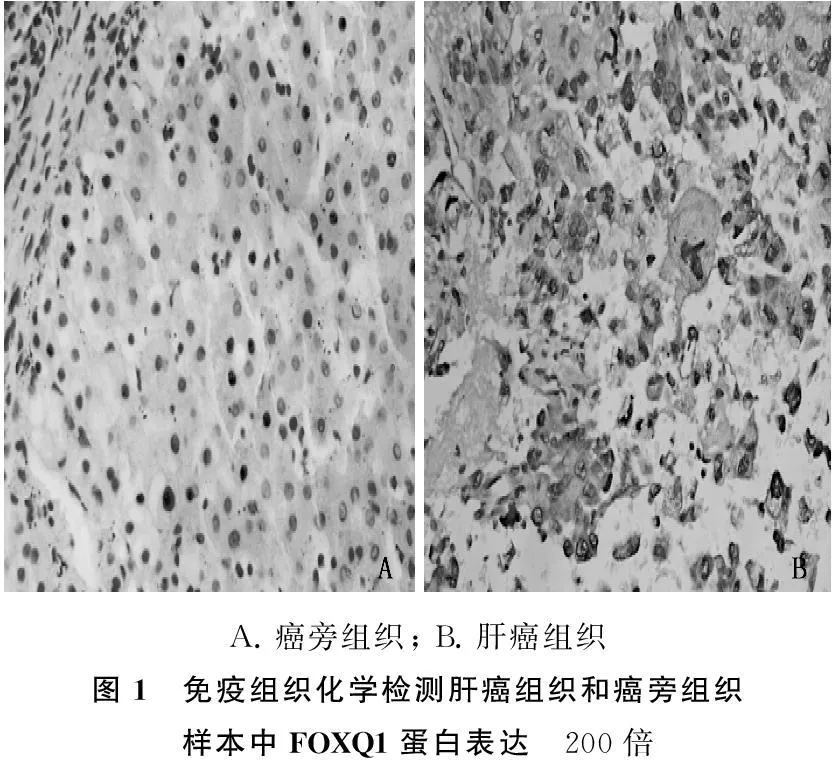
A.癌旁组织;B.肝癌组织图1 免疫组织化学检测肝癌组织和癌旁组织样本中FOXQ1蛋白表达 200倍
2.2 FOXQ1表达与HCC临床病理特征的关系
HCC中FOXQ1蛋白表达与患者性别、乙肝表面抗原(HBsAg)阳性、甲胎蛋白(AFP)水平、是否肝硬化、门静脉癌栓(PVTT)及淋巴结转移等临床病理参数无相关性,而与年龄、TNM分期、肿瘤分化程度、肿瘤数目和肿瘤大小等参数有相关性。见表1。
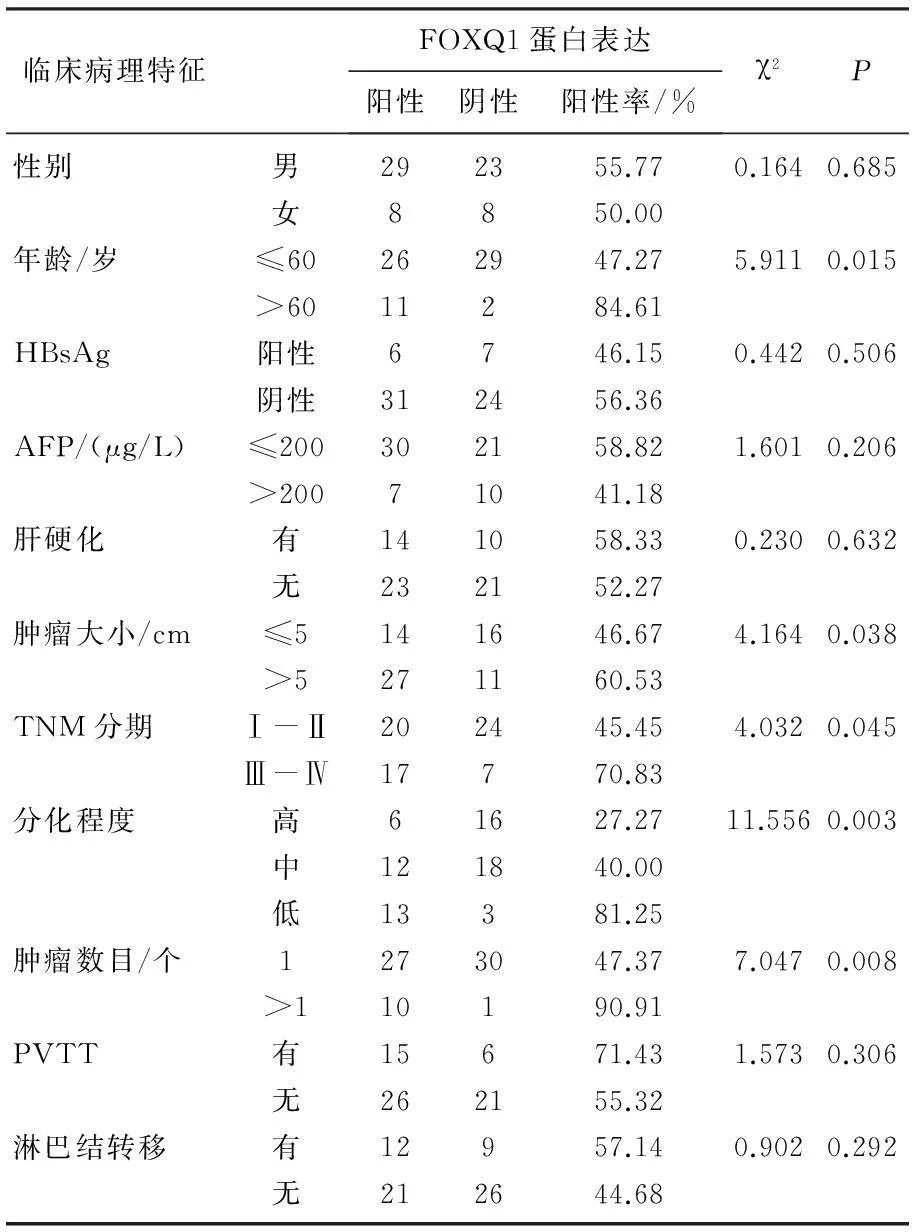
表1 FOXQ1蛋白表达与HCC患者临床病理特征之间的关系
2.3 FOXQ1蛋白表达与TNM分期、肿瘤分化程度的相关性
对68例HCC组织进行Spearman等级相关性分析。结果表明随TNM分期的增高,FOXQ1蛋白表达升高(r=0.667,P<0.05); 随肿瘤分化程度降低,FOXQ1蛋白表达显著升高(r=-0.564,P<0.01)。
3讨论
FOX家族蛋白是含有一段由110个氨基酸组成的保守序列,通过与DNA特异位点结合而发挥其生物学调控功能。FOX蛋白可作为典型的转录因子调节基因转录,还能直接参与染色质重构,协同其他转录因子参与转录调节。目前为止,发现FOX蛋白可参与多种生理病理过程,如对生长发育、新陈代谢、癌症与癌前病变,以及衰老等过程的调控[7-8]。FOXQ1在多种组织中发现其广泛表达,但目前比较明确的功能是调控毛发分化,在体外也可见FOXQ1抑制平滑肌分化基因[9-10]。近年来的一些文献报道发现FOXQ1 mRNA在结肠癌、卵巢癌、乳腺癌等发展过程中扮演着重要的角色,其功能主要涉及到肿瘤恶性增殖、耐药、血管形成、转移及EMT等方面[11-12]。研究人员揭示了FOXQ1通过改变肿瘤微环境,诱导上皮间质转化并招募巨噬细胞浸润,从而促进了肝癌转移[13]。
肿瘤的形成、侵袭、转移、需要基因的重新调整表达,FOXQ1可能作为致癌基因在肝癌中高表达并促进肝癌的发生发展。为了解FOXQ1在肝癌中的表达与临床病理特征之间的关系,本研究使用免疫组化方法比较肝癌和癌旁组织中FOXQ1蛋白表达,结果表明FOXQ1蛋白表达定位于细胞质,在HCC组织中表达高达61.76%,而在癌旁组织仅为11.76%。同时研究发现FOXQ1的表达与年龄、TNM分期、肿瘤分化程度、肿瘤数目和肿瘤大小等参数具有相关性。其中,中、低分化以及多个肿瘤病灶、肿瘤直径>5 cm的肝癌组织FOXQ1蛋白表达阳性率高于高分化、单个肿瘤及肿瘤直径≤5 cm的肝癌组织,表明FOXQ1的表达与肝癌的恶性生物学特性相关,上述结果与邓大炜[14]等研究一致。而本研究显示PVTT者FOXQ1阳性表达率虽高达71.43%, 但PVTT与无PVTT者FOXQ1表达差异无统计学意义,可能与肿瘤晚期无法手术切除[15], 导致样本量过小有关。进一步Spearman等级相关性分析表明FOXQ1蛋白表达与TNM分期呈正相关、与肿瘤分化程度呈负相关,结果首次表明FOXQ1可作为HCC临床诊断及分期的指标,该结果需进一步扩大样本量并验证。
参考文献
[1]刘强, 刘静. 肝细胞性肝癌相关分子信号通路的研究进展[J]. 世界华人消化杂志, 2014, 22(1): 59.
[2]徐辉雄, 谢晓燕, 吕明德. 超声引导经皮热消融治疗肝细胞性肝癌[J]. 中华肝胆外科杂志, 2005, 11(12): 809.
[3]Llovet J M, Bruix J. Molecular targeted therapies in hepatocellular carcinoma[J]. Hepatology, 2008; 48(4): 1312.
[4]吴红雁, 范方田, 刘兆国, 等. 转录因子叉头框Q1与肿瘤相关性的研究进展[J]. 肿瘤, 2014, 34(7): 662.
[5]Sparks R, Madabhushi A. Statistical Shape Model for Manifold Regularization: Gleason grading of prostate histology[J]. Comput Vis Image Underst, 2013, 117(9): 1138.
[6]邢金春. 前列腺癌诊断治疗学[M]. 北京: 人民卫生出版社, 2011: 22.
[7]Feuerborn A, Srivastava P K, Kuffer S, et al. The Forkhead factor FoxQ1 influences epithelial differentiation[ J]. J Cell Physiol, 2011, 226(3): 710.
[8]Xia L, Huang W, Tian D, et al. Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma[J]. Hepatology, 2013, 57 (2) : 610.
[9]Feuerborn A, Srivastava P K, Kuffer S, et al. The Forkhead factor FoxQ1 influences epithelial differentiation[J]. J Cell Physiol, 2011. 226(3): 710.
[10]Potter C S, Peterson R L, Barth J L, et al. Evidence that the satin hair mutant gene Foxq1 is among multiple and functionally diverse regulatory targets for Hoxc13 during hair follicle differentiation[J]. J Biol Chem, 2006, 281(39):29245.
[11]Zhang H, Meng F, Liu G, et al. Forkhead transcription factor foxq1 promotes epithelial-mesenchymal transition and breast cancer metastasis[J]. Cancer Res, 2011, 71( 4) : 1292.
[12]Wu Y, Qiao X, Qiao S, et al. Targeting integrins in hepatocellular carcinoma[ J]. Expert Opin Ther Targets, 2011, 15(4) : 421.
[13]Xia L, Huang W, Tian D, et al. Forkhead box Q1 promotes hepatocellular carcinoma metastasis by transactivating ZEB2 and VersicanV1 expression[J]. Hepatology, 2014, 59(3): 958.
[14]邓大炜, 孔宪炳, 王平, 等. FOXQ1 在肝癌中的临床意义及其对 SMMC-7721细胞体外血管形成的影响[J]. 中国生物化学与分子生物学报, 2015, 31(4): 422.

Expression and the relationship with clinicopathological features
of FOXQ1 protein in hepatocellular carcinoma
HUANG Heng
(DepartmentofGeneralSurgery,ChineseMedicineHospitalAffiliatedtoLuzhouMedical
College,Luzhou,Sichuan, 646000)
ABSTRACT:ObjectiveTo explore the Forkhead box protein Q1 (FOXQ1) expression in hepatocellular carcinoma (HCC) tissue and the relationship with the clinicopathological features of HCC patients. MethodsSixty-eight HCC patients that diagnosed by pathological examination and underwent hepatobiliary surgery were selected in the study. Fresh HCC tissue and peritumoral tissue were collected during each surgery respectively. FOXQ1 protein expression was determined by immunohistochemistry. Meanwhile the relationships of FOXQ1 protein expression with clinicopathological features were analyzed. ResultsFOXQ1 protein expression was mainly localized in the cytoplasm of HCC cells. the FOXQ1 positive expression was 61.76% in HCC tissue and 11.76% in paracancerous tissue, with a significant difference between these two kind of tissues (P<0.05). FOXQ1 protein expression was correlated with age, TNM stage, tumor differentiation, tumor number and tumor size in HCC patients. Spearman rank correlation analysis showed that FOXQ1 protein expression was positively related to TNM staging (r=0.667,P<0.05) and negitively related to tumor differentiation (r=-0.564,P<0.01). ConclusionsHigh expression of FOXQ1 protein is found in the cytoplasm of HCC cells. Detection of FOXQ1 protein level plays an important role in the judgment of HCC malignant degree and tumor differentiation.
KEYWORDS:Forkhead box protein Q1; hepatocellular carcinoma; clinicopathological feature; immunohistochemistry
基金项目:中国高校医学期刊临床专项资金(11522409)
收稿日期:2015-03-06
中图分类号:R 735.7
文献标志码:A
文章编号:1672-2353(2015)15-058-04
DOI:10.7619/jcmp.201515017
