猪流行性乙型脑炎病毒prM-E抗原捕获ELISA检测方法的建立
2015-03-09王晓磊郭立平步志高华荣虹
王晓磊,霍 红,郭立平,李 伟,步志高,华荣虹
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/农业部兽医公共卫生重点开放实验室,黑龙江 哈尔滨 150001)
流行性乙型脑炎(Japanese encephalitis,JE)是由JE 病毒(JEV)引起的一种危害严重的蚊媒性人兽共患传染病。JEV 广泛流行于亚洲大部分地区和西太平洋地区,近年来在澳大利亚北部和巴基斯坦的传播表明JE 的流行范围在不断扩大[1-4]。人与多种动物均能够感染JEV,其中猪是主要的易感动物[5]。JEV 能够引起妊娠母猪流产、死胎或木乃伊胎,公猪睾丸炎等临床症状,对养猪业造成严重的经济损失[6-8]。对猪进行疫苗免疫可以有效减少JEV 对养猪业造成的危害,同时对JEV 的综合防控具有重要的公共卫生学意义。
目前我国主要对种猪进行JEV 弱毒活疫苗免疫,对JE 防控发挥了重要作用。但该疫苗的生产需要进行病毒培养,由于病毒效价难以提高,影响疫苗的产量和生产成本。新型的基因工程亚单位疫苗可以克服以上不足。本实验室已经构建了稳定表达JEV 结构蛋白prM-E 的哺乳动物细胞系[9],该细胞系所表达的prM-E 蛋白能够组装成病毒样颗粒(VLP)分泌至细胞培养液中。该抗原免疫原性强,能够对小鼠提供完全保护;免疫猪可以诱导产生高效价的JEV 中和抗体,有望开发为JE 亚单位疫苗。在亚单位疫苗的研发中,疫苗抗原的检测是重要的质量控制技术手段。本研究以JEV prM-E 结构蛋白特异性单克隆抗体(MAb)作为捕获抗体和检测抗体建立了JEV prM-E 蛋白的抗原捕获ELISA(ACELISA)方法,并组装成试剂盒,为JE 亚单位疫苗的研制与生产奠定了基础。
1 材料和方法
1.1 主要实验材料 JEV、猪瘟病毒(CSFV)、脑心肌炎病毒(E MCV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)、猪细小病毒(PPV)均由本实验室保存;JEV prM-E 抗原的制备参见文献[9];抗JEV 结构蛋白prM-E MAb 5B10 和5E7 均由本实验室制备;辣根过氧化物酶(HRP)标记的抗prM-E 蛋白MAb 5E7(HRP-5E7)由本实验室标记和纯化。
1.2 主要试剂 红外荧光标记的羊抗鼠IgG(IRD-IgG)购自北京中杉金桥生物技术有限公司;蛋白定量试剂盒购自BIO-RAD 公司;四甲基联苯胺(TMB)购自Sigma 公司。
1.3 JEV prM-E抗原的纯化 以凝胶过滤柱层析法纯化20 倍浓缩的JEV prM-E 抗原上清。利用SDS-PAGE 和western blot 分析纯化效果,蛋白定量试剂盒测定纯化后蛋白的浓度。
1.4 AC-ELISA方法的建立及条件优化 将纯化的MAb 5B10 作为抗原捕获抗体包被酶标板,PBST 洗板;封闭液封闭,洗板;加抗原,同步设阴性对照,洗板;加HRP-5E7 标记的检测MAb,洗板;加TMB 显色液;终止反应;测定OD450nm值,分析结果。通过优化条件:MAb 5B10 包被浓度、包被液、封闭液和封闭条件、抗原稀释液、抗原作用时间、HRP-5E7 稀释倍数和反应时间、底物显色时间,建立AC-ELISA 标准化程序。
1.5 AC-ELISA阴阳性临界值的确定 以30 份不含JEV 抗原的不同细胞培养上清液以及不同血清浓度的培养液作为阴性对照,采用建立的AC-ELISA方法进行检测,计算样本OD450nm值的平均值(X)和标准方差(SD)。按照公式:阴阳性临界值=X+3SD,计算临界值。
1.6 特异性试验 采用建立的AC-ELISA 方法检测CSFV、EMCV、PRRSV、PRV、PPV 以及JEV 细胞培养物,同时设立JEV prM-E 抗原的阳性对照和阴性对照,检验该方法的特异性。
1.7 敏感性试验 将纯化的JEV 和JEV prM-E 抗原分别进行1∶1~1∶256 和1∶100~1∶51 200 倍比稀释,采用建立的AC-ELISA 方法进行检测,得出阳性临界值时的最大稀释倍数,计算AC-ELISA 的敏感度。
1.8 试剂盒的组装、重复性与保存期试验 按照优化后的试剂组分组装试剂盒,试剂盒由96 孔反应板、5 倍浓缩洗涤液、HRP-5E7、TMB 底物显色液、JEV prM-E 抗原阳性与阴性对照样品组成。采用同批次和不同批次包被的ELISA 板条,检测强阳性、弱阳性和阴性样品各2 份,每份样品重复检测16 次,计算批内和批间变异系数。同时将3 个批次的试剂盒置4 ℃保存,于不同时间取样进行保存期测定。
1.9 试剂盒检测亚单位疫苗抗原 将构建的稳定表达JEV prM-E 的细胞系进行传代培养,细胞长满后换为抗原表达维持培养液,之后从第1 d 至第10 d,分别取细胞上清液进行抗原含量测定。以梯度稀释的纯化的JEV prM-E 抗原为标准品制作标准曲线,计算检测样品的抗原含量。
2 结果
2.1 JEV prM-E抗原的纯化 以凝胶过滤柱层析法纯化20 倍浓缩的JEV prM-E 抗原上清。电泳结果表明纯度较高、分子量较大的JEV prM-E 抗原最先流出,其后出现的高的蛋白峰则主要为杂蛋白(图1)。

图1 JEV prM-E 纯化图谱Fig.1 The spectrum of purified JEV prM-E protein
2.2 AC-ELISA方法的建立及条件优化 经系列反应条件优化后,确定了以下最佳条件:包被缓冲液为50 mmol/L pH9.6 碳酸盐缓冲液,MAb 5B10 包被浓度为6 μg/mL,100 μL/孔;4 ℃包被过夜(16 h),PBST 洗涤3 次;0.5 %聚乙烯醇(PVA),200 μL/孔,37 ℃封闭2 h;待检抗原以0.5 %牛血清白蛋白(BSA)稀释,37 ℃反应2 h;HRP-5E7 按1∶500 比例稀释,37 ℃作用1 h;TMB 室温显色8 min;2 mol/L H2SO4终止,酶标仪测定OD450nm值(表1)。

表1 AC-ELISA 检测方法的反应条件优化结果Table 1 The optimized conditions of the AC-ELISA
2.3 AC-ELISA阴阳性临界值的确定 以不含JEV抗原的不同细胞培养上清液以及不同血清浓度的培养液作为阴性对照样品进行多次重复测定,计算出样本的与SD。以+3SD 为阴阳性判定临界值,确定样品OD450nm小于0.174 为阴性,OD450nm值大于0.174 为阳性(图2)。
2.4 特异性试验结果 采用建立的AC-ELISA 方法检测不同的常见猪病病毒细胞培养物,结果表明该试剂盒仅对JEV prM-E 阳性对照及JEV 细胞培养物呈阳性反应,与其它常见猪病病原无交叉反应(图3)。
2.5 敏感性试验结果 采用AC-ELISA 方法检测梯度稀释的纯化的JEV 和JEV prM-E 抗原。结果表明该方法对JEV 和JEV prM-E 抗原的最低检测限度分别为1.25×105pfu/mL 和48.44 ng/mL(图4 和图5)。绘制JEV prM-E 标准抗原不同浓度之间的标准曲线,确定AC-ELISA 的最佳定量范围为0.05 μg/mL~1.00 μg/mL,标准曲线相关系数(R2)=0.9962。

图2 阴性样品结果正态分布图Fig.2 Negative samples normal distribution diagram

图3 AC-ELISA 的特异性试验Fig.3 The specific test of AC-ELISA

图4 AC-ELISA JEV 定量标准曲线Fig.4 Standard curve for quantifying JEV by AC-ELISA

图5 AC-ELISA prM-E 蛋白定量标准曲线Fig.5 Standard curve for quantifying JEV prM-E protein by AC-ELISA
2.6 试剂盒的重复性与保存期试验 AC-ELISA 方法的批内变异系数介于2.77 %~8.66 %,批间变异系数介于1.13 %~6.96 %,均低于10 %,表明该方法具有良好的重复性(表2)。试剂盒组装后置4 ℃保存1 年稳定,对保存在-70 ℃的同批次样品检测结果无明显变化(图6)。

表2 AC-ELISA 的重复性试验Table 2 The repeatability assay of AC-ELISA

图6 试剂盒稳定性试验Fig.6 Stability test of the ELISA kit
2.7 试剂盒检测亚单位疫苗抗原 试剂盒对细胞系表达prM-E 抗原的检测结果表明,该细胞系在更换维持液后的1 d~4d,抗原量不断增加,在4 d~6 d后抗原量达到平台期,此时抗原含量为20 μg/mL~25 μg/mL(图7)。
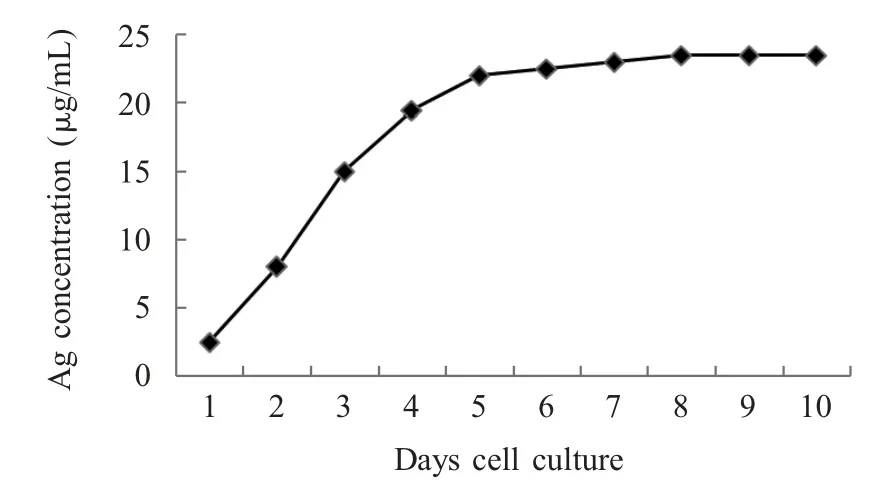
图7 ELISA 试剂盒对细胞系表达疫苗抗原的检测Fig.7 Detection of cell line expressed subunit vaccine antigen
3 讨论
ELISA 具有操作简单、易标准化、灵敏、快速等优点,已广泛应用于JEV 抗原抗体的检测[10-14]。AC-ELISA 的特异性和敏感性取决于抗体的生物学特性。本研究采用的2 株抗JEV prM-E 特异性MAb 5B10 和5E7,效价高,结合抗原能力强,可以用于检测具有天然构象结构的JEV prM-E 抗原。
本研究对JEV prM-E 抗原纯化方法进行了改进。前期实验结果表明,蔗糖密度梯度离心法所得抗原纯度较低,不能满足标准样品的需要。凝胶过滤柱层析法回收率高、操作简便、具有直观性,能够得到纯度高、保持完整颗粒性和反应原性的JEV prM-E抗原。以该方法纯化的抗原可以作为标准品,对JEV prM-E 抗原进行定量分析。
本研究通过控制单一变量法对AC-ELISA 方法的影响因素进行了优化,建立的AC-ELISA 方法灵敏度和准确度高、重复性和稳定性好。检测病毒的敏感性为1.25×105pfu/mL,而检测天然构象的prM-E重组蛋白的敏感性为48.44 ng/mL。建立的标准曲线R2能达到99 %以上,线性范围为0.05 μg/mL~1.00 μg/mL。本研究还对ELISA 反应板保护剂以及酶标抗体保护液进行了优化,提高了试剂盒的稳定性。JEV prM-E 蛋白的AC-ELISA 检测试剂盒的研制,为JEV 亚单位疫苗研发生产过程中的质量控制提供了技术支持与保障。
[1]Hanna J N,Ritchie S A,Phillips D A,et al.An outbreak of Japanese encephalitis in the Torres Strait,Australia,1995[J].Med J Aust,1996,165(5):256-260.
[2]Hanna J N,Ritchie S A,Phillips D A,et al.Japanese encephalitis in north Queensland,Australia,1998[J].Med J Aust,1999,170(11):533-536.
[3]Mackenzie J S,Johansen C A,Ritchie S A,et al.Japanese encephalitis as an emergingvirus:the emergence and spread of Japanese encephalitis virus in Australasia[J].Curr Top Microbiol Immunol,2002,267:49-73.
[4]Van den Hurk A F,Ritchie S A,Mackenzie J S.Ecology and geographical expansion of Japanese encephalitis virus[J].Annu Rev Entomol,2009,54:17-35.
[5]Simpson D I,Smith C E,Marshall T F,et al.Arbovirus infections in Sarawak:the role of the domestic pig[J].Roy Soc Trop Med Hyg,1976,70(1):66-72.
[7]Campbell G L,Hills S L,Fischer M,et al.Estimated global incidence of Japanese encephalitis:a systematic review[J].Bull World Health Organ,2011,89(10):766-774.
[8]赵凡凡,游卫云,王晓杜,等.猪日本乙型脑炎检测技术研究进展[J].中国畜牧兽医,2011,38(10):174-179.
[9]Hua Rong-hong,Li Ye-nan,Chen Zhen-shi,et al.Generation and characterization of a new mammaliancell line continuously expressing virus-like particles of Japanese encephalitis virus for a subunit vaccine candidate[J].BMC Biotechnol,2014,14(1):62-68.
[10]于丹,李静,李军,等.ELISA 定量检测乙型脑炎病毒抗原[J].临床检验杂志,2009,27(6):440-441.
[11]张国强,冯素英,沈淑芹.乙型脑炎病毒抗原定量检测试剂的研制[J].中国生物制品学杂志,2006,5:511-513.
[12]Kumar J S,Parida M,Rao P V.Monoclonal antibody based antigen captureimmunoassay for detection of circulating non structural protein NS1:Implications for early diagnosis of japanese encephalitis virus infection[J].J Virol,2011,83(6):1063-1070.
[13]Mei L,Wu P,Ye J,et al.Development and application of an antigen capture ELISA assayfor diagnosis of Japanese encephalitis virus in swine,human and mosquito[J].Virol J,2012,9(1):4-10.
[14]Konishi E,Shoda M,Ajiro N,et al.Development and evaluation of an enzyme-linked immunosorbent assay for quantifying antibodies to Japanese encephalitis virus nonstructural 1 protein to detect subclinical infections in vaccinated horses[J].J Clin Microbiol,2004,42(11):5087-5093.
