番茄采后寄生菌的分离鉴定及(E)-2-己烯醛抑菌活性研究
2015-03-08张继红孙和龙俞可欣王先友
田 虎,张继红*,孙和龙,高 莹,俞可欣,王先友
(湘潭大学 a.化工学院; b.化学学院, 湖南 湘潭 411105)
番茄采后寄生菌的分离鉴定及(E)-2-己烯醛抑菌活性研究
田虎a,张继红a*,孙和龙a,高莹a,俞可欣a,王先友b*
(湘潭大学a.化工学院; b.化学学院, 湖南 湘潭 411105)
摘要:番茄采后储藏、运输中遭受的病害有很多,严重影响了番茄的品质。生物防治因低毒、高效,已作为控制采后病害的新途径,成为研究热点。本文主要对采后成熟番茄表面寄生菌进行分离纯化,通过形态特征、生理生化特性、rDNA-ITS序列分析以及系统发育分析对该菌株进行鉴定,并通过不同浓度(E)-2-己烯醛对该菌种进行抑菌分析。采用真菌通用引物扩增18S rDNA基因,得到PCR产物(约500 bp)。测序后,NCBI数据库比对可知,确定其为圆弧青霉菌(Penicillium cyclopium)。根据圆弧青霉的生长曲线可知,生长60-72 h,其生物量达到最大,其最适温度为25-30 ℃,最适pH为5.0。抑菌结果显示,(E)-2-己烯醛对圆弧青霉的菌丝生长有较好的抑制作用,对菌丝生长的最低抑菌浓度(MIC)为160 μL/L。
关键词:番茄,菌株鉴定,rDNA-ITS序列分析,圆弧青霉,(E)-2-己烯醛,抑菌活性
番茄为茄科草本植物,浆果,皮薄肉厚,含水量达95%,作为一种重要的农产品。在采摘和运输过程中极易受到机械损伤,从而易受真菌入侵。番茄采后病原菌,包括灰霉病使番茄产量造成重大损失[1],番茄的病害是影响番茄品质的重要因素之一。
番茄采后储存和运输中遭受的病害有许多,其中主要包括番茄早疫病,青霉果腐病,番茄实腐病等。目前,对番茄采后病害的防治仍然以化学防治为主。长期、过量使用化学农药,不但成本高,残留多,还容易产生抗药性。生物防治已被证明在许多作物有效,因无毒、高效、成本低,作为控制采后病害的新途径,成为研究热点[2]。
近年来,天然抑菌剂受到人们广泛关注,前人在果蔬保鲜储藏方面做了不少研究。茶树油熏蒸能有效抑制草莓灰霉病致病菌的菌丝生长和孢子萌发,维持草莓果实的品质,延长其保鲜期[3]。Smid等[4]研究表明,肉桂醛能明显降低番茄果实表面和萼部的细菌和真菌的数量,从而对番茄表面进行消毒。拮抗微生物的应用被证明是一种行之有效的方法[5, 6]。钙能提高酵母菌Candida guilliermondii和Pichia membranefaciens对桃采后软腐病的防治能力[7]。水杨酸对增强酵母拮抗菌Rhodotorula glutinis防治甜樱桃采后病害的效果显著[8]。
E-2-己烯醛作为一种绿叶挥发性物质(GLVs),已被证明对真菌、革兰氏阳性菌和革兰氏阴性菌具有明显的抑菌活性[9-11]。Patrignani等[12]研究发现,亚致死剂量的E-2-己烯醛能显著改变四种病原细菌细胞膜及挥发性物质的组成。迄今为止,E-2-己烯醛对番茄采后寄生菌菌丝的抑制作用的报道较少。鉴于此,从采后番茄表面分离纯化得到一个菌株,本研究从寄生菌株的形态特征、生理生化特性、18 S rRNA-ITS PCR扩增、基因序列比对等方法对菌株进行鉴定。本试验研究E-2-己烯醛对该菌株的抑制作用,测定其最低抑菌浓度(MIC),用以防治番茄采后病害。
1材料与方法
1.1材料
1.1.1菌株和试剂
番茄寄生真菌由湘潭大学微生物实验室从采后番茄表明分离、保存。Taq DNA 聚合酶、dNTPs、胶回收试剂盒均购买自天根(TIANGEN)公司。18S rDNA引物由生工生物工程(上海)有限公司合成。
1.1.2培养基
牛肉膏3 g,蛋白胨10 g,琼脂15-20 g,Nacl 5 g,pH值7.0,最后用双蒸水定容至1 000 mL,121 ℃、1.01×105 Pa 灭菌25 min,倒平板,冷却形成固体培养基(PDA)[20];
1.2番茄寄生菌的分离
在无菌操作台下,用接种环挑取番茄的真菌,用加有0.05%的Tween 80(w/v)的灭菌双蒸水制成菌悬液,浓度约为1.0x105CFU/mL,涂布到PDA培养基上,Parafilm封口膜密封,倒置,28 ℃培养3-4 d。将长出的菌落挑出,划线分离纯化,得到的菌株50%甘油-80 ℃保存,以便后续观察、备用。
1.3菌株的鉴定及生物学特性分析
1.3.118s rDNA-ITS序列分析
番茄寄生的真菌基因组DNA的提取采用改良的氯化苄法[13],并以此为模板进行PCR扩增,18S rDNA 基因克隆的PCR 引物为ITS1 (5′-TCCGTAGGTGAACCTGCG-3′) 和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR 扩增条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸2 min,35 个循环;最后72 ℃延伸10 min。所得PCR 产物经琼脂糖凝胶电泳,胶回收后,由上海生工生物有限公司完成测序。将所测得的18S rDNA序列与GenBank数据库中的18S rDNA序列进行相似性比较,并用MEGA5.0软件绘制系统发育进化树。
1.3.2寄生真菌的形态学观察[14]
取菌丝体样品于超净菌台,置于2.5%的戊二醛溶液中4 ℃固定过夜。然后倒掉戊二醛溶液,用0.1 mol/L pH7.0的磷酸缓冲液清洗三次,每次5 min,30%,50%,70%,80%,90%和95%浓度的乙醇溶液分别对样品进行梯度脱水,每次处理持续15 min,再用100%的乙醇处理30 min,用叔丁醇代替乙醇继续处理45 min,所得样品真空冷冻干燥过夜,最后干燥好的样品经离子溅射镀膜机喷金后,在JEOL JSM-6360LV型扫描电镜中观察。
1.3.3寄生真菌生长曲线的测定
取50 μL的菌悬液加入到装有50 mL已灭菌的PDA液体培养液的锥形瓶中,于30 ℃恒温培养箱140 r/min震荡培养,每隔12 h经真空过滤,50 ℃恒温干燥,称取菌丝体干重[15]。每组重复3次,取平均值。
1.3.4温度对菌丝体生长的影响
取100 μL的菌悬液均匀涂布在PDA上培养2 d,沿菌丝生长前沿,用内径为5.5 mm的无菌打孔器打下菌台,置于灭菌的PDA平板中央。设置7个温度梯度,分别为5 ℃,10 ℃,15 ℃,20 ℃,25 ℃,30 ℃,35 ℃,每组重复3次,培养3 d后,采用十字交叉法测量菌落直径,取平均值。
1.3.5pH对菌丝生长体的影响
取100 μL的菌悬液均匀涂布于已灭菌的PDA固体培养基上培养2 d,沿菌丝生长前沿,用内径为5.5 mm的无菌打孔器打下菌台,置于已灭菌的PDA平板中央。然后,分别将菌台置于pH值为4.0,5.0,6.0,7.0,8.0,9.0,10.0的已灭菌的PDA固体培养基平板中央,30 ℃倒置培养,每组梯度重复3次,培养3 d后,采用十字交叉法测量菌落直径,取平均值。
1.3.6真菌分生孢子的致死温度
取10 mL 1×105CFU/ml的致病菌悬浮液装于试管中,当水浴温度达到预定值时分别将试管移入水浴锅中并开始计时,以40 ℃为起点,以5 ℃的梯度递增,直至80 ℃。试管分别加热10 min,最后移取0.1 mL菌悬液于灭菌的PDA固体培养基上,28 ℃恒温倒置培养2 d。每温度梯度重复三次,观察并判断病原菌在培养基上菌落生长情况。
1.3.7己烯醛对寄生真菌最低抑菌浓度(MIC)的测定
以己烯醛为原液,用乙醇稀释,过滤灭菌,制备成20 ml/L的己烯醛母液。分别吸取己烯醛母液,加入刚灭菌的PDA固体培养基中,混匀,则培养基含己烯醛浓度依次为0,10,20,40,80,160,320 μL/mL,凝固后,用内径为5.5 mm的无菌打孔器在培养2 d的圆弧青霉PDA固体培养基平板中打下菌台,接种到上述的平板上。
30 ℃恒温培养2 d,采用十字交叉法测量菌落直径,每个实验4次重复,取平均值。以完全无菌生长的最低己烯醛浓度为己烯醛对该菌的最低抑菌浓度(MIC)。将没有生长的菌苔移接到新的培养基上继续培养2 d,肉眼看不到任何菌丝体生长的最低浓度认为该组分的最低杀菌浓度(MFC)。
2结果与分析
2.1番茄采后寄生菌的鉴定
2.1.1番茄寄生菌的形态特征
番茄寄生菌在固体PDA培养基上前期形成为白色菌落,反面无色或带黄色,后期转为深绿色,菌落反面赭褐色,菌落较厚,表面有颗粒状物质,中央凸起,具放射状皱纹,质地丝柔状。其菌丝的形态为帚状枝三轮生,有些二轮生,不对称,梗颈较短,分生孢子球形或近球形,壁光滑,如图1所示。
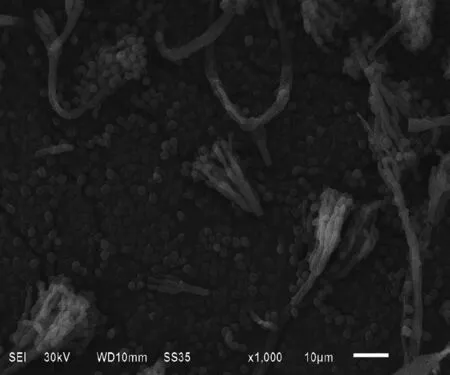
图1 番茄寄生菌的扫描电镜照片(1000×)Fig.1 The scanning electron micrograph of parasitic fungus of tomato fruits(1000×)
2.1.218S rDNA-ITS基因扩增及序列分析
对番茄寄生菌株利用氯化苄法提取DNA,并进行ITS序列扩增,其扩增产物大小为550 bp左右,如图2所示。所得序列在NCBI数据库进行比对,发现该菌株与Penicillium cyclopium strain CICC 4026 的核苷酸序列同源性高达99%。结合番茄寄生菌的形态特征,其鉴定结果为圆弧青霉(Penicillium cyclopium)。从NCBI数据库中搜寻与圆弧青霉同一种属的青霉模式菌株,下载其ITS基因序列,构建系统进化树 (图3)。
2.1.3圆弧青霉(Penicillium cyclopium)的生长曲线
从图4中可见,圆弧青霉菌株在0~24 h内菌丝体重量变化不明显,处于延滞期,菌体为适应新的环境而表现出生长迟缓,几乎不繁殖,故而菌丝体干重几乎不变;在24~60 h进入对数生长期,菌丝体干重呈指数倍增加,菌株生长很旺盛,;在60~72 h进入平稳期,菌株菌丝体重量趋于平衡,变化不明显,生长速度等于死亡速度。
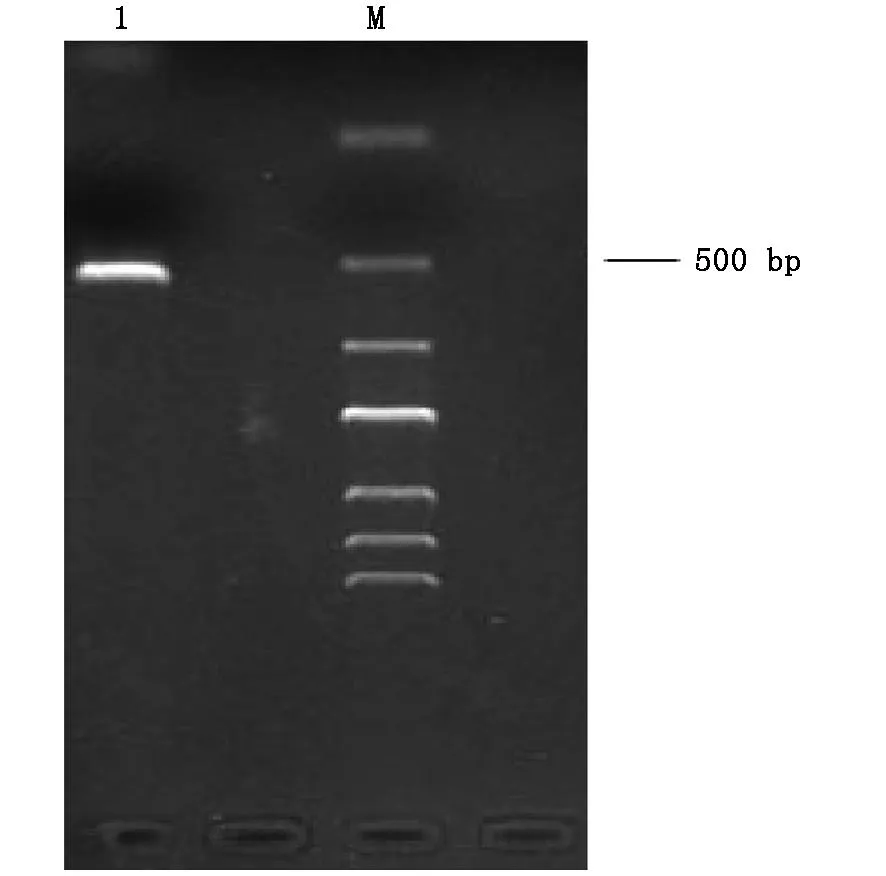
图2 18S rDNA-ITS基因扩增的PCR产物电泳结果Fig.2 The electrophoretic results of PCR products of 18S-rDNA-ITS
2.1.4温度对圆弧青霉(Penicillium cyclopium)菌丝体生长的影响
由图5可知,培养温度为10 ℃-25 ℃时,菌落生长直径呈上升的趋势,培养温度为30 ℃-35 ℃时,菌落生长直径呈明显下降的趋势,圆弧青霉菌丝体在5 ℃几乎不生长,35 ℃时菌丝生长量很少,直径只有6 mm左右,接种菌台为5.5 mm。较高(35 ℃)和较低(10 ℃)温度下该菌丝体的生长均受到明显抑制,因此25 ℃-30 ℃为圆弧青霉培养的最适温度范围,菌落生长直径较大。
2.1.5pH对圆弧青霉(Penicillium cyclopium)菌丝体生长的影响
圆弧青霉菌在pH4.0-10.0的范围内均能生长(图6),由图可知,酸性条件下有利于该菌株的生长,pH为5.0时菌落的直径最大,达到13.5 mm,随着pH值的升高,菌落直径逐渐变小,pH值为10.0时,菌落几乎不生长,接种菌台直径为5.5 mm。
2.1.6圆弧青霉(Penicillium cyclopium)分生孢子的致死温度
由表1可知,圆弧青霉孢子悬浮液经不同温度处理后,分别涂板,恒温培养2 d后,检测菌落数以显示该菌对温度的敏感性。随着处理温度的升高,菌落数急剧减少,温度达到70 ℃时,肉眼基本观察不到菌落,由此可知,圆弧青霉分生孢子的致死温度为70 ℃。
表1圆弧青霉(Penicillium cyclopium)分生孢子致死温度的测定
Tab.1The determination of lethal temperature of the conidiophores of Penicillium cyclopium

温度(℃)4550556065707580菌落数++++++++---
注:+++表示菌落数很多;++表示菌落数可数;+表示菌落数极少;-表示没有菌落

图3 番茄寄生菌Penicillium cyclopium ITS基因部分序列构建的N-J系统进化树Fig.3 Pheylogenetic analysis of ITS sequence of Penicillium cyclopium fungi of tomato fruits

图4 圆弧青霉(Penicillium cyclopium)的生长曲线Fig.4 The growth curve of Penicillium cyclopium

图5 不同温度对圆弧青霉(Penicillium cyclopium)菌丝体生长的影响Fig.5 The influence of different temperature on Penicillium cyclopium mycelium growth

图6 pH对圆弧青霉(Penicillium cyclopium)菌丝体生长的影响Fig.6 The influence of pH on the Penicillium cyclopium mycelium growth
2.2(E)-2-己烯醛最低抑菌浓度(MIC)和最低杀菌浓度(MFC)测定结果
由表2可知,各浓度(E)-2-己烯醛对圆弧青霉均表现出较强的抑菌效果,随着PDA固体培养基中(E)-2-己烯醛浓度的升高,培养皿中的圆弧青霉菌落的直径逐渐变小,说明抑菌的效果越明显。(E)-2-己烯醛对圆弧青霉的MIC为160 μl/L,MFC为320 μl/L。
表2(E)-2-己烯醛对圆弧青霉(Penicilliumcyclopium)的MIC和MFC(μl/L)测定
Tab.2The determination of MIC and MFC of E-2-Hexenal onPenicilliumcyclopium

(E)-2-己烯醛浓度(μl/L)菌落直径(mm)022.75±1.881022.69±1.312019.69±1.414013.5±1.83809.13±0.881605.5±03205.5±0
注:接种菌苔直径为5.5 mm
3结论与展望
大量研究表明,从芳香植物或中草药中提取的精油类物质具有抑菌或杀菌的活性,可作为天然的食品防腐剂[16]。植物挥发物已被广泛用于食品调味剂,其中大部分普遍被公认为是安全的[17]。GC/MS测定番茄叶中,含量最高的挥发组分为(E)-2-己烯醛,普遍存在于各种绿色植物中,被称为“绿叶气味”[18]。本研究根据寄生真菌形态学特征结合18S rDNA-ITS分子检测结果,对照《真菌鉴定手册》,对采后番茄寄生真菌进行分离纯化鉴定。结果表明,该菌株与以往报道的圆弧青霉菌rDNA-ITS序列同源性为99%,可以判断该菌株为圆弧青霉(Penicilliumcyclopium)。
根据对圆弧青霉的生长曲线、温度、pH值及致死温度研究,了解此种圆弧青霉的生长特性。从圆弧青霉的生长曲线可知,当菌丝生长60-72 h,其生物量达到最大,最适温度为25-30 ℃,最适pH为5.0。本实验采用菌丝生长速率法测定了(E)-2-己烯醛对圆弧青霉的影响,结果表明,(E)-2-己烯醛对圆弧青霉的菌丝生长有较好的抑制作用,对菌丝生长的最低抑菌浓度(MIC)为160 μl/L。乙醛部分跟巯基基团在生理条件下起反应主要是通过1,4-加成[19]。其他醛的抗菌作用机制,如戊二醛和邻苯二甲醛,可能涉及与细胞质膜的相互作用,增加其渗透率[20, 21]。从橄榄中提取的醛展示出对红色毛癣菌和犬小孢子菌株显著的抗真菌活性。不饱和醛类对所有的癣菌显示出更强的活性,其MIC值小于1.9 μg/mL,尤其是(E)-2-己烯醛和(E)-2-壬烯醛较相应的饱和己醛和壬醛显示出更广谱的抗性[22]。
本研究所分离的番茄圆弧青霉病菌,可为探讨番茄果实采后防腐保鲜提供实验材料。而(E)-2-己烯醛对番茄采后圆弧青霉病菌的抑菌作用,为(E)-2-己烯醛在番茄果实的贮藏保鲜上提供一定的理论和实践依据。
参考文献
[1] BADAWY M E I, RABEA E I. Potential of the biopolymer chitosan with different molecular weights to control postharvest gray mold of tomato fruit [J]. Postharvest Biol Technol, 2009, 51(1):110-117.
[2]ELAD Y, MALATHRAKIS N E, DIK A J. Biological control of Botrytis-incited diseases and powdery mildews in greenhouse crops [J]. Crop Prot, 1996, 15(3):229-240.
[3]程塞, 邵兴锋, 郭安南, 等.茶树油熏蒸对草莓采后病害和品质的影响 [J]. 农业工程学报, 2011, 27(4):383-388.
CHENG Sai, SHAO Xingfeng, GUO Annan,etal. Effects of tea tree oil fumigation on disease and quality of postharvest strawberry fruits [J]. Transactions of the CSAE, 2011, 27(4):383-388.
[4]SMID E J, HENDRIKS L, BOERRIGTER H A M. Surface disinfection of tomatoes using the natural plant compound trans-cinnamaldehyde [J]. Postharvest Biol Technol, 1996, 9:343-350.
[5]WILSON C L, WISNIEWSKI M E. Biological control of postharvest diseases of fruits and vegetables:alternatives to synthetic fungicides [J]. Crop Protection, 1989, 10:172-177.
[6]EI-GHAOUTH A, SMILANICK J L, WILSON C L. Enhancement of the performance of Candida saitoana by the addition of glycolchitosan for the control of postharvest decay of apple and citrus fruit [J]. Postharvest Biol Technol, 2000, 19(1):103-110.
[7]TIAN S P, FAN Q, XU Y,etal. Effects of calcium on biocontrol activity of yeast antagonists against the postharvest fungal pathogenRhizopusstolonifer[J]. Plant Pathol, 2002, 51(3):352-358.
[8]QIN G Z, TIAN S P, XU Y,etal. Enhancement of biocontrol efficacy of antagonistic yeasts by salicylic acid in sweet cherry fruit [J]. Physiol Mol Plant Pathol, 2003, 62(3):147-154.
[9]BISOGNANO G, LAGANA M G, TROMBETTA D,etal.Invitroantibacterial activity of some aliphatic aldehydes fromOleaeuropeaL [J]. FEMS Microbiol Lett, 2001, 198(1):9-13.
[10]TROMBETTA D, SAIJA A, BISIGNANO G,etal. Study on the mechanisms of the antibacterial action of some plant α, β-unsaturated aldehydes [J]. Lett Appl Microbiol, 2002, 35(4):285-290.
[11]NAKAMURA S, HATANAKA A. Green-leaf-derived C6-aroma compounds with potent antibacterial action that act on both Gram-negative and Gram-positive bacteria [J]. J Agric Food Chem, 2002, 50(26):7639-7644.
[12]PATRIGNANI F, IUEEI L, BELLETTI N,etal. Effects of sub-lethal concentrations of hexanal and 2-(E)-hexenal on membrane fatty acid composition and volatile compounds ofListeriamonocytogenes,Staphylococcusaureus,SalmonellaenteritidisandEscherichiacoli[J]. Int J Food Microbiol, 2008, 123(1-2):1-8.
[13]MOILER E M, BAHNWEC G, SANDERMAN H,etal. A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi, fruit bodies, and infected plant tissues [J]. Nucleic Acids Res, 1992, 20(22):6115-6116.
[14]LV F, HAO L, YUAN Q P,etal.Invitroantimicrobial effects and mechanism of action of selected plant essential oil combinations against four food-related microorganisms [J]. Food research International, 2011, 44(9):3057-3064.
[15]周海恩, 陶能国, 贾雷. 一株柑橘采后酸腐病菌的分离与鉴定 [J].湘潭大学自然科学学报, 2013, 35(1):92-96.
ZHOU Hai’en, TAO Nengguo, JIA Lei. Isolation and identification of a sour rot of citrus fruits [J]. Natural Science Journal of Xiangtan University, 2013, 35(1):92-96.
[16]ANTUNES M D C, CAVACO A M. The use of essential oils for postharvest decay control [J]. Flavour Fragr J, 2010, 25:351-366.
[17]NEWBERNE P, SMITH R L, DOULL J,etal. GRAS flavouring substances [J]. Food Technol, 2000, 54(6):66-83.
[18]何培青, 张金灿, 蒋万枫, 等. 不同方法收集番茄叶挥发性物质的GC/MS指纹图谱比较 [J]. 西北植物学报, 2005, 25(9):1868-1872.
HE Peiqing, ZHANG Jincan, JIANG Wanfeng,etal. GC/MS Fingerprint comparison of the volatile organic compounds extracted fromLycopersiconesculentumleaves by different methods [J]. Acta Bot Boreal-Occidentalia Sinica, 2005, 25(9):1868-1872.
[19]KUBO I, FUJITA K. Naturally occurring anti-Salmonella agents [J]. J Agr Food Chem, 2001, 49(12):5750-5754.
[20]SIMONS C, WALSH S E, MAILLARD J Y,etal. A note:ortho-phthalaldehyde:proposed mechanism of action of a new antimicrobial agent [J]. Lett Appl Microbiol, 2000, 31(4):299-302.
[21]TSUCHIYA H. Biphasic effects of acetaldehyde-biogenic amine condensation products on membrane fluidity [J]. J Pharm Pharmacol, 2001, 53(1):121-127.
[22]BATTINELLI L, DANIELE C, CRISTIANI M,etal.Invitroantifungal and anti-elastase activity of some aliphatic aldehydes fromOleaeuropaeaL. fruit [J]. Phytomedicine, 2006, 13(8):558-563.
Isolation&Identification of Bacteria from Postharvest Tomato and A Study on the Antibacterial Activity of (E)-2-Hexenal
TIANHua,ZHANGJihonga*,SUNHelonga,GAOYinga,YUKexina,WANGXianyoub*
(Xiangtan University a.College of Chemical Engineering; b.College of Chemistry, Xiangtan 411105, Hunan, China)
Abstract:There were many diseases of tomato during postharvest storage and transportation, which seriously affect the quality of tomato. Because of low toxicity and high efficiency, biological control had been used as a new way to control postharvest diseases, became research hotspot. The paper mainly focused on the isolation and purification of the parasitic bacteria on the surface of the mature tomato, the bacterial strains were identified by morphological characteristics, physiological and biochemical characteristics, rDNA-ITS sequence analysis and phylogenetic analysis. Antibacterial activity of different concentrations of (E)-2-Hexenal against the bacterial strains were analysed. 18 S rDNA genes were amplified by using universal fungal primers, PCR products (about 500 bp) were obtained. After sequencing, the bacterial strains were determined to be Penicillium cyclopium by blasting in NCBI database. According to the growth curve of Penicillium cyclopium, which can be learned that the biomass reached the maximum around 60-72h, the optimum temperature was 25-30 ℃, the optimum pH was 5.0. The antibacterial results showed (E)-2-Hexenal treatment was significantly effectives against mycelial growth of Penicillium cyclopium, the MIC was 160 μl/L in growth inhibition assays.
Key words:tomato; strain identification; rDNA-ITS sequential analysis; penicillium cyclopium; (E)-2-Hexenal; antibacterial activity
文章编号:1007-7146(2015)06-0545-06
文献标志码:A
中图分类号:Q939.99
*通讯作者:张继红(1977-),男,湖南湘乡人,湘潭大学副教授,硕士生导师,从事生物化学与分析检测研究。(电话)0731-58292246;(电子邮箱)jihongzh01@xtu.edu.cn;王先友(1963-),男,湖南湘乡人,湘潭大学教授,博士生导师,从事新型电源及电极研究。(电话)0731-58292060;(电子邮箱)xywang@xtu.edu.cn
作者简介:田虎(1989-),男,湖南岳阳人,硕士研究生,主要从事植物病理与农产品储藏研究。
基金项目:湖南省自然科学基金项目(15JJ6108);湘潭大学博士启动经费(KZ08033)
收稿日期:2015-07-24;修回日期:2015-10-15
doi:10.3969/j.issn.1007-7146.2015.06.010
