饥饿素对贫铀所致MC3T3-E1细胞损伤的保护作用研究
2015-03-08郝玉徽黄嘉伟第三军医大学军事预防医学院复合伤研究所重庆400038
郝玉徽,黄嘉伟,刘 聪,李 蓉 (第三军医大学军事预防医学院复合伤研究所,重庆 400038)
饥饿素对贫铀所致MC3T3-E1细胞损伤的保护作用研究
郝玉徽,黄嘉伟,刘聪,李蓉(第三军医大学军事预防医学院复合伤研究所,重庆 400038)
[摘要]目的评价饥饿素对贫铀(DU)所致成骨细胞(MC3T3-E1细胞)损伤的影响。方法不同浓度的饥饿素提前1 h预处理MC3T3-E1细胞后暴露于DU(500 μM)24 h,检测细胞存活率、细胞内抗酒石酸酸性磷酸酶(StrACP)、碱性磷酸酶(AKP)、骨保护素(OPG)、可溶性核因子-κB受体活化因子配体(sRANKL)含量以及细胞内过氧化氢酶(CAT)和活性氧(ROS)水平。结果饥饿素预处理可明显提高DU暴露后细胞存活率及CAT含量,降低细胞内StrACP、AKP、sRANKL/OPG以及ROS水平,并且存在剂量依赖关系。结论饥饿素通过调节OPG/RANKL系统的失衡以及降低细胞内氧化应激,发挥对DU暴露后MC3T3-E1细胞的保护作用。
[关键词]饥饿素;贫铀;成骨细胞;活性氧
贫铀(depleted uranium,DU)是天然铀经过提炼浓缩核燃料-铀(235U)之后的剩余产物,其235U含量低于0.72%,主要由238U构成,具有放射毒性和重金属毒性双重作用,但主要危害在于其重金属毒性[1]。骨骼是DU慢性暴露的主要蓄积器官,骨铀含量可作为评估慢性铀暴露的主要指标。朱国英等[2]研究表明,DU片嵌入损伤可致骨量明显降低、骨生物力学性能下降、骨组织结构出现明显损伤,并存在剂量和时间效应。然而目前为止,几乎没有关于DU引起骨损伤的救治研究。
饥饿素(Ghrelin)是一种含有28个氨基酸残基的脑肠肽,主要由由胃肠道分泌[3],其可明显减轻10 Gy电离辐射所引起的大鼠肠道细胞的凋亡[4]。有研究显示,饥饿素可调节骨代谢和骨细胞的功能,并能够抑制成骨细胞的凋亡,促进骨骼生长[5]。然而,饥饿素对DU引起骨损伤的影响还未见报道。本研究通过成骨细胞(MC3T3-E1细胞)暴露于DU建立实验模型,从骨代谢、骨保护素(OPG)/核因子-κB受体活化因子配体(RANKL)系统调节及氧化应激等方面初步探究饥饿素对DU所致MC3T3-E1细胞损伤的保护作用。
1材料与方法
1.1主要试剂及配制
贫铀溶液的制备:配制成质量浓度为25 mg/mL的溶液,取500 mg的DU片(238U占99.75%,235U占0.2%及痕量234U),溶于5 mL硝酸中,微热,溶解,双蒸水稀释至20 mL(配好后调pH至中性)。过滤灭菌,4 ℃保存,备用。
MC3T3-E1细胞购自美国ATCC细胞库,饥饿素购自成都凯捷生物技术有限公司,抗酒石酸酸性磷酸酶(StrACP)试剂盒、碱性磷酸酶(AKP)试剂盒、过氧化氢酶(CAT)试剂盒购自南京建成生物技术研究所。OPG检测试剂盒、可溶性核因子-κB受体活化因子配体(sRANKL)检测试剂盒购自上海生工。BCA蛋白浓度测定试剂盒、活性氧(ROS)检测试剂盒购自碧云天生物技术研究所。CCK-8细胞增殖毒性检测试剂盒购自东仁化学科技公司。DMEM培养基购自Hyclone公司。胎牛血清购自Gibco公司。
1.2实验方法
1.2.1细胞培养MC3T3-E1细胞株用含体积分数10% FBS、100 kU/L青霉素和100 mg/L链霉素的DMEM置于37 ℃,体积分数5%CO2的细胞培养箱中培养,取生长状态良好的细胞用于实验。
1.2.2CCK-8细胞增殖毒性检测试验分析细胞存活将生长状态良好的MC3T3-E1细胞接种于96孔板,接种量为2×104个/孔,待细胞生长旺盛时进行实验,分为以下几组:对照组(control组,不作任何处理),贫铀组(DU组,加入贫铀溶液,使培养液中贫铀浓度最终达到500 μM),饥饿素处理组(DU+G 0.01、DU+G 0.1、DU+G 1、DU+G 10、DU+G 100组,培养液中加入饥饿素使其最终浓度分别达到0.01 nM、0.1 nM、1 nM、10 nM、100 nM,1 h后再加入贫铀溶液使其最终浓度达到500 μM),每组设5个复孔,细胞置于37 ℃、5%CO2培养箱内培养24 h,吸干培养液后加入含10 μl CCK-8 的新鲜培养液100 μl,孵育1 h,450 nm波长测量吸光值(OD值) ,根据OD值计算细胞存活率。细胞存活率(%)=(实验组OD值-空白OD值)/(对照组OD值-空白OD值)×100%。其中空白组为单纯培养基加上CCK-8 试剂。
1.2.3细胞提取液制备将生长状态良好的MC3T3-E1细胞接种于100 mL培养瓶中,接种量为106个/瓶,待细胞生长旺盛时进行实验,分组情况与1.2.2相同,细胞置于37 ℃、5%CO2培养箱内培养24 h,吸取细胞培养液,备用。用胰酶消化细胞,并收集至备用的细胞培养液中。4 ℃ 600 g离心5 min收集细胞,除去上清,PBS洗涤1次,除去上清,按照每200万细胞加入100 μl裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15 min,4 ℃ 16 000~20 000 g离心15 min,吸取上清,BCA法测定蛋白浓度后-70 ℃保存备用。
1.2.4细胞内StrACP、AKP、OPG、sRANKL、CAT的测定分别按照相关试剂盒说明书对细胞提取液中StrACP、AKP、OPG、sRANKL、CAT的含量进行测定。
1.2.5细胞内ROS检测将生长状态良好的MC3T3-E1细胞接种于6孔板,接种量为2×105个/孔,待细胞生长旺盛时进行实验,分组情况与1.2.2相同,细胞置于37 ℃、5%CO2培养箱内培养24 h,去除细胞培养液,每孔加入2 mL浓度为10 μM的荧光探针DCFH-DA工作液,37 ℃孵育20 min,用无血清细胞培养液洗涤细胞3次,荧光显微镜下观察。
1.3统计学分析
2结果
2.1饥饿素对DU暴露后细胞存活率的影响
MC3T3-E1细胞暴露于DU(500 μM)24 h后,DU组与control组相比存活率显著降低(P<0.05),饥饿素处理组(DU+G0.01~DU+G100组)与DU组相比存活率明显升高(P<0.05),且细胞存活率随饥饿素浓度浓度的增高逐渐增高(图1)。本结果表明饥饿素对DU暴露后的MC3T3-E1细胞具有明显的细胞保护作用。
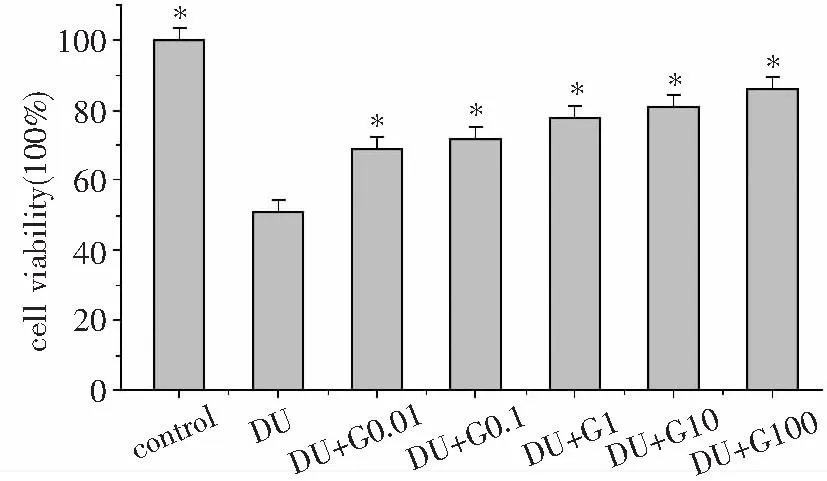
*:与DU组相比,P<0.05
2.2饥饿素对DU暴露后骨代谢的影响
如图2所示,正常情况下MC3T3-E1细胞内StrACP处于较低水平,暴露于DU(500 μM)24 h后,DU组与control组相比,StrACP水平显著上升(P<0.05),而饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比,StrACP水平明显下降(P<0.05),且StrACP水平随饥饿素浓度的增高逐渐降低;同时,DU组与control组相比,AKP水平显著上升(P<0.05),饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比AKP水平明显下降(P<0.05),且AKP水平随饥饿素浓度的增高呈现下降的趋势。
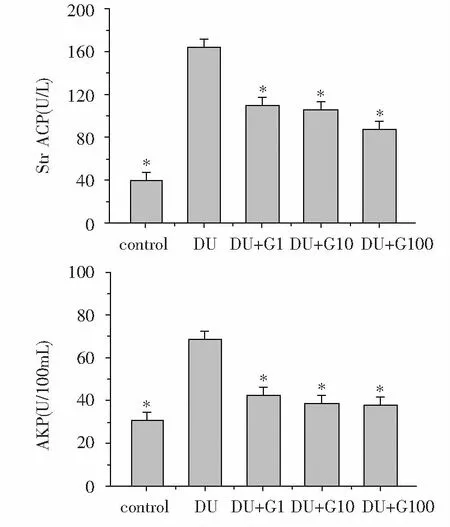
*:与DU组相比,P<0.05
2.3饥饿素对DU暴露后骨代谢OPG/RANKL系统的影响
如图3所示,正常情况下MC3T3-E1细胞内sRANKL处于较低水平,暴露于DU(500 μM)24 h后,DU组与control组相比,sRANKL水平显著上升(P<0.05),而饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比,sRANKL水平明显下降(P<0.05),且sRANKL水平随饥饿素浓度的增高呈现下降趋势;同时DU组与control组相比,OPG水平显著下降(P<0.05),饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比,OPG水平明显升高(P<0.05),且OPG水平随饥饿素浓度的增高逐渐增高。对于sRANKL/OPG,DU组与control组相比显著上升(P<0.05),饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比,sRANKL/OPG水平明显下降(P<0.05),且sRANKL/OPG水平随饥饿素浓度的增高呈现下降趋势。
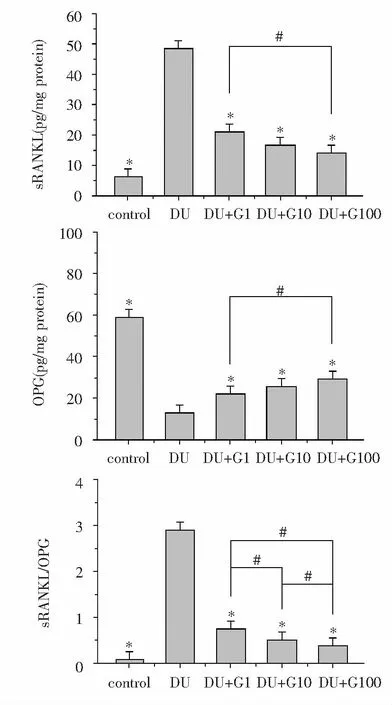
*:与DU组相比,P<0.05;#:组间两两比较,P<0.05
2.4饥饿素对DU暴露后细胞氧化应激的影响
MC3T3-E1细胞暴露于DU(500 μM)24 h后,DU组与control组相比,CAT水平显著降低(P<0.05),而饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比,CAT水平明显升高(P<0.05),且CAT水平随饥饿素浓度的增高逐渐增高(图4)。
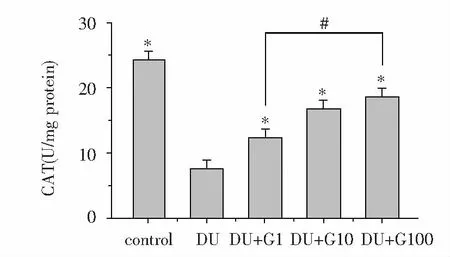
*:与DU组相比,P<0.05;#:组间两两比较,P<0.05
2.5饥饿素对DU中毒后ROS的影响
如图5所示,正常情况下细胞ROS活性低,在荧光显微镜下观察并不明显,DU组细胞ROS活性与正常组相比明显升高,而饥饿素处理组(DU+G1、DU+G10、DU+G100组)与DU组相比ROS活性逐步降低。
3讨论
针对DU中毒的救治,目前研究多重视通过合成螯合剂进行体内铀的促排,探索出一系列的药物[6-7],并认为具有明显的DU促排效果。但是,促排药的使用还有一定的争议,因为它们和铀形成复合物后需要由肾排出,有可能会加重肾损伤[8]。事实上,除了DU促排外,阻断DU在生物体内的作用途径,减轻DU对组织细胞的损伤,也是一种重要的救治方法。饥饿素是生长激素分泌受体-1a(GHSR-1a)的内源性配体,参与机体重要的生物学功能,例如能量代谢、抗炎症、抗氧化及细胞的增殖和凋亡等[3]。本研究从细胞存活率骨代谢、OPG/RANKL系统调节及氧化应激等几方面初步证实,饥饿素对贫铀所致MC3T3-E1细胞损伤具有明显的保护作用。
本研究通过细胞增殖毒性检测试验发现,DU对细胞具有明显的毒性作用,而饥饿素有效地提高了DU暴露后MC3T3-E1细胞的存活率,并且存活率随饥饿素浓度增大而升高。提示饥饿素对DU暴露后的MC3T3-E1细胞具有明显的保护作用,且保护作用与饥饿素的浓度呈正相关。
本研究还观察了饥饿素对骨代谢的影响,着重讨论饥饿素对StrACP和AKP的影响情况。StrACP是酸性磷酸酶(ACP)同功酶的第5型,是公认的鉴别破骨细胞的标志之一,主要存在于破骨细胞、巨噬细胞中。骨吸收时,StrACP参与骨基质中固体钙磷矿化底物的降解。因此,StrACP标志着破骨细胞的活性,并在一定程度上反映了骨吸收状况[9]。DU暴露后细胞StrACP水平明显升高,饥饿素有效降低了DU暴露后StrACP的浓度,且StrACP的浓度与饥饿素的浓度呈负相关,提示饥饿素对破骨细胞的活性具有一定的抑制作用,进而一定程度抑制骨吸收。AKP是成骨细胞分化时所分泌的酶,它的主要功能是在碱性条件下(pH7.6~9.9)水解多种磷酸酯并具有转磷酸基作用。AKP被普遍认为是成骨细胞分化和功能的标志,能够反映成骨细胞合成Ⅰ型胶原、形成骨基质的能力,其活性的高低可反映成骨细胞的成熟状况[10]。DU暴露后细胞AKP水平明显升高,饥饿素有效降低了DU暴露后AKP的浓度,且AKP的浓度与饥饿素的浓度呈负相关,提示饥饿素提高成骨细胞的活性,进而促进骨生成。饥饿素抑制破骨细胞活性同时提高成骨细胞活性,使得骨吸收减少而骨生成增加,对骨代谢产生明显影响。
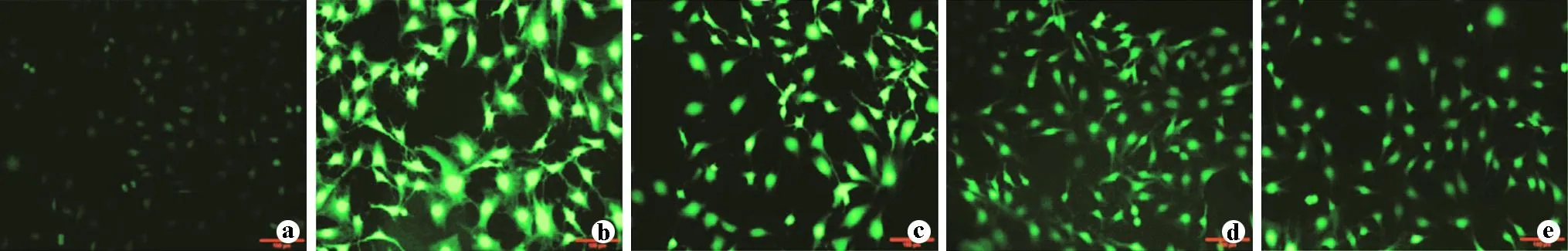
a:Control;b:DU;c:DU+G1;d:DU+G10;e:DU+G100
本研究评价了饥饿素对骨代谢OPG/RANKL系统的影响。OPG/RANKL系统是调节破骨细胞分化的重要信号传导通路[11],在骨形成和吸收的动态平衡中发挥重要作用:成骨细胞及骨髓基质细胞表达sRANKL,与破骨细胞前体细胞或破骨细胞表面上的RANK结合后,促进破骨细胞分化和激活;成骨细胞及骨髓基质细胞则分泌OPG与sRANKL竞争性结合,阻止sRANKL与RANK结合,从而抑制破骨细胞活性[12]。饥饿素有效降低DU暴露后细胞sRANKL的浓度,使得破骨细胞分化和激活受到抑制;同时升高OPG的浓度,抑制破骨细胞活性,总体上使得sRANKL/OPG显著降低,从而抑制破骨细胞活性,增强成骨细胞活性,减少骨吸收增加骨生成。
本研究探究了饥饿素对DU中毒后细胞氧化应激的影响。氧化应激对成骨细胞的作用表现为抑制细胞增殖、阻碍细胞分化成熟、抑制成骨细胞分泌骨基质及骨基质的矿化,导致成骨细胞活性下降甚至死亡[13]。其中,CAT不但能阻止H2O2转变为羟自由基(·OH),还能使之分解为H2O和O2,从而降低活性氧自由基的含量,保护细胞免受氧化损伤[14]。DU暴露后细胞CAT水平明显升高,饥饿素有效提升DU暴露后细胞CAT水平,使得H2O2迅速分解为H2O和O2,有效降低细胞内羟自由基水平,从而保护细胞免受氧化损伤。最终,在荧光显微镜下观察到细胞ROS变化情况:正常情况下细胞ROS水平低,不易观察,DU暴露后细胞ROS显著上升,荧光显微镜视野下清楚观察到ROS情况,饥饿素有效降低DU暴露后细胞内ROS水平,并且随着饥饿素浓度升高ROS水平不断降低。饥饿素显著降低DU中毒后细胞氧化应激,使细胞减少氧化损伤。
综上所述,饥饿素有效提高DU暴露后MC3T3-E1细胞的存活率,降低细胞ROS水平减缓细胞氧化应激,调节OPG/RANKL系统及骨代谢,降低骨损伤,起到显著保护作用。
[参考文献]
[1] Priest ND.Toxicity of depleted uranium[J].Lancet,2001,357(9252):244-246.
[2] 朱国英,仲伟鉴,项希桥,等.贫铀片嵌入大鼠肌肉对骨代谢和骨矿盐损伤效应研究[J].复旦学报(医学版),2007,34(6):821-827.
[3] 刘聪,李蓉.Ghrelin与炎症性疾病研究进展[J].重庆医学,2014,43(4):489-491.
[4] Wang Z,Yang WL,Jacob A,et al.Human ghrelin mitigates intestinal injury and mortality after whole body irradiation in rats[J].PLoS One,2015,10(2):1-18.
[5] Delhanty PJ,van der Eerden BC,van Leeuwen JP.Ghrelin and bone[J].Biofactors,2014,40(1):41-48.
[6] Hao Y,Ren J,Liu C,et al.Zinc protects human kidney cells from depleted uranium-induced apoptosis[J].Basic Clin Pharmacol Toxicol,2014,114(3):271-280.
[7] Bao Y,Wang D,Li Z,et al.Efficacy of a novel chelator BPCBG for removing uranium and protecting against uranium-induced renal cell damage in rats and HK-2 cells[J].Toxicol Appl Pharmacol,2013, 269(1):17-24.
[8] Briner W.The toxicity of depleted uranium[J].Int J Environ Res Public Health,2010,7(1):303-313.
[9] 陈爱宝,龚琦,刘强,等.密骨胶囊对血清抗酒石酸酸性磷酸酶和Ⅰ型胶原C末端肽的影响[J].实用骨科杂志,2012,18(6):530-532.
[10] 郭勇,郭春,闫玉仙,等.周期性张应变对破骨前体细胞和破骨细胞增殖和抗酒石酸酸性磷酸酶的影响[J].医用生物力学,2012,27(3):299-304.
[11] Ominsky MS,Li X,Asuncion FJ,et al.RANKL inhibition with osteoprotegerin increases bone strength by improving cortical and trabecular bone architecture in ovariectomized rats[J].Bone Miner Res,2008,23(5):72-82.
[12] 陈少龙,赵良功,滕元君,等.周期性和持续性流体剪切力对成骨细胞OPG、RANKL蛋白表达的影响[J].中国医学物理学杂志,2015,32(1):120-123.
[13] Fatokun AA,Stone TW,Smith RA.Hydrogen peroxide-induced oxidative stress in MC3T3-E1 cells:The effects of glutamate and protection by purines[J].Bone,2006,39(3):542-551.
[14] 赵学发,杨名慧,葛正龙.紫外线照射对SD大鼠晶状体抗氧化酶活性的影响[J].现代医药卫生,2015,31(8):1131-1133.
(编辑:左艳芳)
Protective role of ghrelin in depleted uranium-induced damage of MC3T3-E1 cells
HAO Yu-hui,HUANG Jia-wei,LIU Cong,LI Rong
(Institute of Combined Injury,College of Preventive Medicine,Third Military Medical University,Chongqing 400038,China)
Abstract:ObjectiveTo evaluate the impact of ghrelin on depleted uranium (DU)-induced damage of the osteoblast MC3T3-E1. MethodsMC3T3-E1 cells were treated with different doses of ghrelin for 1 h before DU (500 μM) treatment. After 24 hours,the cell viability,intracellular tartrate-resistant acid phosphatase (StrACP),alkaline phosphatase (AKP),osteoprotegerin (OPG),solvable receptor activator of nuclear factor-κB ligand (sRANKL),catalase (CAT) and reactive oxygen species (ROS) were measured. ResultsAfter DU exposure,ghrelin pretreatment increased the cell viability and CAT levels,and reduced intracellular StrACP,AKP,sRANKL/OPG and ROS in a dose-dependent manner. ConclusionThrough maintaining the balance of OPG/RANKL and reducing the oxidative stress,ghrelin could protect against DU-induced damage of MC3T3-E1 cells.
Keywords:ghrelin;depleted uranium;osteoblast;reactive oxygen species
[中图分类号]R827.3
[文献标识码]A
[文章编号]1672-5042(2015)06-0595-04
[收稿日期]2015-03-05[修回日期] 2015-06-15
[基金项目]“十二五”国家科技支撑计划项目(2013BAK03B05-02);国家自然科学基金面上项目(81472913);国家重点实验室自主研究课题(SKLZZ201503)
doi:10.11659/jjssx.03E015064
