改性粘土对浒苔(Ulva prolifera)微观繁殖体去除效果及萌发的影响*
2015-03-08宋秀贤俞志明
李 靖 孙 雷 宋秀贤 俞志明
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071; 2. 中国科学院大学 北京 100049;3. 中国海洋大学 青岛 266003)
2007年以来由浒苔引发的绿潮在中国黄海沿岸连年暴发, 引起了世界媒体包括海洋科学界的高度关注(乔方利等, 2011)。2008年7月中旬第29届奥运会开幕前夕, 600km2的绿潮在青岛沿岸爆发, 地方政府动用万余人清除在关键海域漂浮及在海岸堆积的绿藻, 清除量约为80万吨(乔方利等, 2008)。2013年6月 26日国家海洋局北海分局在黄海中南部海域(119°11′—124°0′E, 34°23′—36°42′N)发现绿潮, 总覆盖面积约 710km2, 总分布面积约 25700km2(a)。2014年 06 月 23 日, 在(119°16'—122°8'E, 32°48'— 36°40'N)海域发现绿潮, 覆盖面积约 481km2, 分布面积约37530km2(b)。
绿潮是大型海洋绿藻在潮间带和浅海海域大量繁殖造成生物量积累的现象(Anderson et al, 2002)。形成绿潮的藻类通常包括石莼属(Ulva)、硬毛藻属(Chaetomorpha)、刚毛藻属(Cladophora)的一些种类。在过去的三十年中, 绿潮在全世界的近海、河口等区域时有暴发, 美国(Nelson et al, 2008)、法国(Charlier et al, 2007)、日本(Hiraoka et al, 2004)、菲律宾(Largo et al, 2004)、南非(Anderson et al, 1996)等国均有报道,而且其暴发规模和频率均有逐渐上升的趋势(Liu et al, 2013) , 大规模绿藻的暴发正在演化成为一种持久性的海洋生态灾害。绿潮发生会造成其他生物生物量的减少、降低海草床(seagrass beds)的重建能力。同时,绿藻死亡、沉降和分解时会消耗培养液中大量溶解氧,将导致或加剧低氧区的形成(Ye et al, 2011), 造成区域内生物多样性降低以及无脊椎动物、鱼类甚至海洋哺乳动物的死亡。此外, 绿潮的暴发也给当地的旅游业、水产养殖业、渔业、航海安全等海洋产业在不同程度上造成损失。
近年来, 发生在我国黄海的大规模绿潮引起政府部门、公众和有关研究者的关注, 其中漂浮聚集到青岛近海的绿藻经鉴定为绿藻门、石莼目、石莼科、石莼属的浒苔(Ulva prolifera)(Wang et al, 2010, Zhao et al, 2013)。目前, 对浒苔的研究多集中于其生活史、黄海绿潮成因等方面, 对控制浒苔快速繁殖、防止或降低绿潮灾害发生的方法研究未见报道。
改性粘土技术是一种成本低、快速有效、对环境无负面影响的有害藻华应急消除方法(Anderson,1997; Anderson et al, 2001), 在我国已成功应用于2005年全运会、2008年奥帆赛、2011年世界大运会等诸多重要国内外赛事水域的藻华应急处置中(张雅琪等, 2013)。浒苔的繁殖方式复杂多样, 其生活史有孢子体和配子体两个世代(王建伟等, 2006; 王晓坤等,2007; Lin et al, 2008), 不同世代繁殖过程中释放出的雌雄配子、孢子以及配子接合形成的合子体积微小且近似, 长 6.5—12μm, 宽 2.5—5.3μm(王晓坤等, 2007),被通称为微观繁殖体(Callow et al, 1997)。本研究中将浒苔微观繁殖体视为一种球形微藻, 考察了改性粘土对其絮凝去除效果以及萌发率的影响, 研究结果将对有效防控绿潮灾害具有重要指导意义和应用前景。
1 材料与方法
1.1 实验材料
改性粘土的制备参见文献(俞志明等, 1994)。浒苔样品采集自青岛第一海水浴场潮间带。取回的浒苔用灭菌海水冲洗后, 放入经高压灭菌天然海水配制的 f/2培养液中暂养, 培养温度 20±1°C, 光照度3000lx左右, 光暗比L∶D=12h∶12h。浒苔微观繁殖体的诱导方法参见文献(张晓红, 2011)。
1.2 去除实验
通过诱导获取密度为4.8×105cell/mL的浒苔微观繁殖体培养液, 分别取50mL上述培养液加入8支具塞比色管中。配制浓度为 50g/L的改性粘土储备液,分别取0、0.1、0.2、0.3、0.4、0.5、1.0、2.0mL改性粘土储备液加入比色管, 并迅速混匀, 使其在培养液中的最终浓度依次为 0、0.1、0.2、0.3、0.4、0.5、1.0、2.0g/L。加入改性粘土后的15min、30min、1h、2h、3h、4h, 从各比色管中上层取1mL培养液至离心管中,加入10μL卢戈氏液固定, 用血球计数板计数。
1.3 萌发实验
去除实验结束后, 首先从每个比色管的上层取适量体积培养液至 24孔板中, 然后将比色管中上层培养液和沉降后的絮体重新混合, 再取出适当体积至 24孔板中。为方便萌发后的计数, 每个样品设置不稀释、稀释 10倍、稀释 100倍三种浓度梯度, 培养温度(20±1)°C, 光照度3000lx左右, 光暗比L∶D=12h∶12h, 3d后观察浒苔微观繁殖体的萌发情况。
萌发率(Germination rate, R)的计算公式为:
其中, x为显微镜下多个视野中观察到的萌发数目; n为观察的视野个数; D为培养皿的底面直径; d为显微镜下一个视野的直径, 等于目镜视场数/物镜倍率; N为每毫升培养液中微观繁殖体的个数; V为每个培养皿中所加入的培养液体积(mL)。
2 结果与讨论
2.1 改性粘土去除浒苔微观繁殖体的动力学变化规律
本实验诱导收集到的浒苔微观繁殖体密度为4.8×105cell/mL。结果显示, 添加改性粘土 1h内浒苔微观繁殖体密度快速降低, 之后趋于平缓, 4h内絮凝沉降基本完成。
添加改性粘土后浒苔微观繁殖体密度和去除率随时间的变化情况如图1所示。由于浒苔微观繁殖体附着和自然沉降的存在, 未添加改性粘土的对照组3h时其在培养液中的密度降为4.0×105cell/mL, 微观繁殖体密度下降比率为16.7%。添加0.5g/L改性粘土浓度组, 1h时微观繁殖体密度降至2.0×105cell/mL, 1h去除率为 58.3%; 3h时微观繁殖体密度降至 0.6×105cell/mL, 3h去除率为87.5%。添加1.0g/L改性粘土组, 1h时微观繁殖体密度迅速降至0.5×105cell/mL,1h去除率为 89.6%; 3h后微观繁殖体密度降至了0.15×105cell/mL, 3h去除率为96.9%。
从图1中各曲线的斜率可以直观的看出, 随着改性粘土浓度的提高, 不同时间点浒苔微观繁殖体的去除速率都有所提高。本研究中将浒苔微观繁殖体看成一种球形微藻, 根据以往的研究(俞志明等, 1995)可知粘土/改性粘土颗粒与赤潮生物的絮凝作用及絮凝速率受控于单位体积中粘土-细胞絮凝物、微藻生物和粘土颗粒的数目及生成絮凝物的有效碰撞所占总碰撞次数的比例, 通过提高改性粘土的浓度即可提高絮凝速率, 本研究中图1结果即验证了该结论。此外, 随着絮凝过程的继续, 培养液中的浒苔微观繁殖体及改性粘土颗粒相应减少, 从而絮凝速率也会减慢, 最终趋于在低水平保持稳定。
不同时间段内改性粘土对浒苔微观繁殖体的去除率见图 2。不添加改性粘土时, 浒苔微观繁殖体具有一定的自沉降/固着速率, 此速率在不同的时间段内均维持在较低水平。添加不同浓度改性粘土后, 1h内去除率均显著高于 1—2h、2—3h及 3—4h(P<0.05)。2—3h与3—4h内去除率无显著差异, 且与未添加改性粘土的对照组十分接近, 说明 4h内絮凝沉降已基本完成, 因此, 本研究中选取添加改性粘土后 4h考察其对浒苔微观繁殖体的去除效果。

图1 不同改性粘土浓度下培养液中浒苔微观繁殖体密度随时间的变化Fig.1 Changes in Ulva prolifera microscopic propagule density with time under different concentrations of modified clay
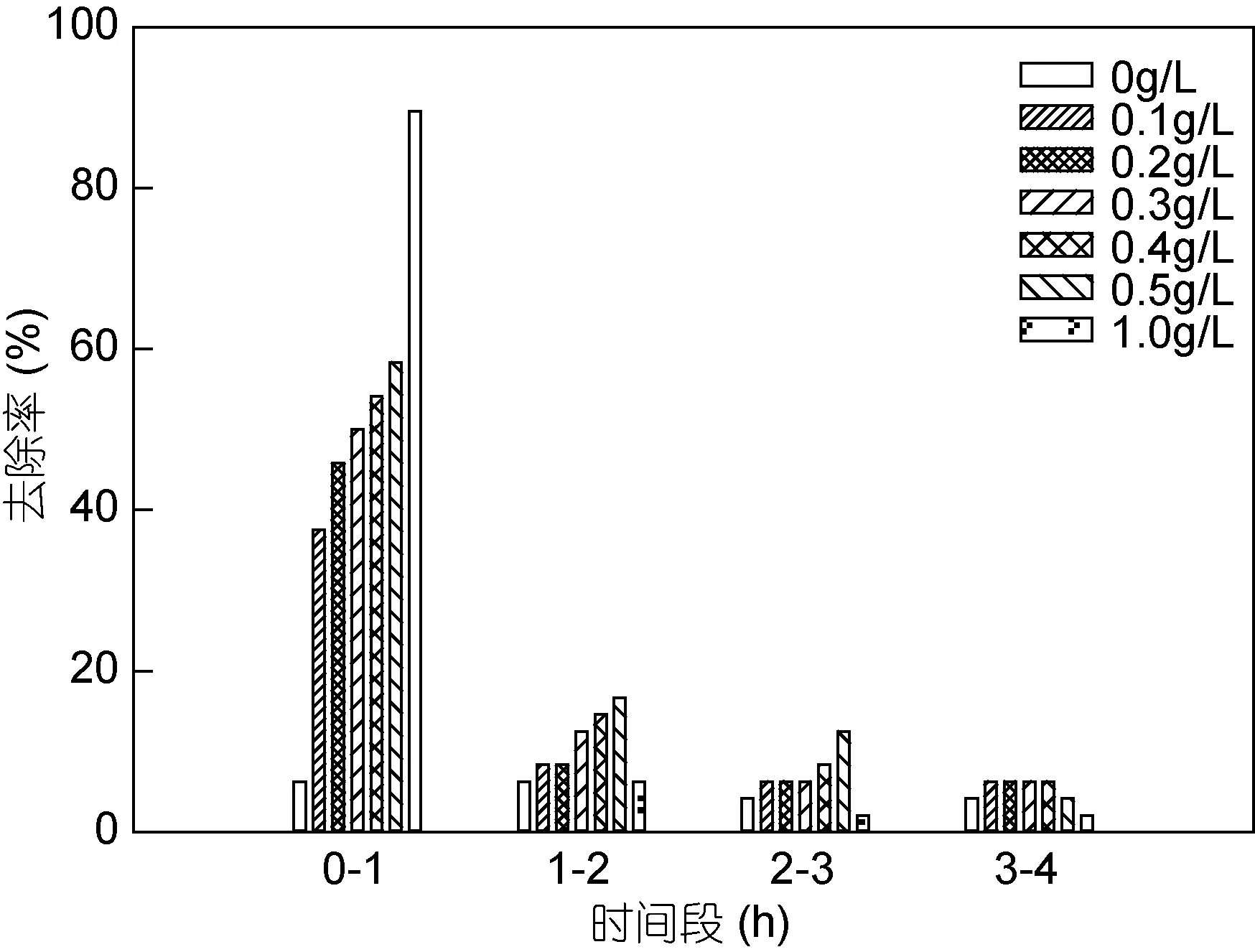
图2 不同浓度的改性粘土在不同时间段对浒苔微观繁殖体的去除速率Fig.2 Efficiency of removal on microscopic propagules with modified clay in different concentrations and time
2.2 改性粘土对浒苔微观繁殖体的去除效果
本研究使用初始密度为4.8×105cell/mL的浒苔微观繁殖体培养液进行去除实验, 发现改性粘土对浒苔微观繁殖体的去除效果与相似粒径的球形微藻类似, 如图 3所示, 随着改性粘土浓度的提高, 浒苔微观繁殖体的荧光值快速降低, 去除率逐渐提高。不添加改性粘土的对照组 4h后密度降至 3.8×105cell/mL,说明实验中浒苔微观繁殖体存在少量附着和自然沉降现象; 添加 0.4g/L改性粘土的微观繁殖体密度由开始的4.8×105cell/mL降至8.0×104cell/mL, 去除率达到 83.3%; 添加 0.5g/L的改性粘土, 密度降至4.2×104cell/mL, 去除率达到91.3%。
改性粘土对微藻的絮凝效果主要通过静电作用和范德华作用实现, 与粘土的种类、浓度及改性方式有着密切的关系, 同时也与微藻的种类、大小、表面电位及胞外物质的性质有关(俞志明等, 1994)。本实验采用的聚合氯化铝(PAC)改性高岭土可高效去除微藻生物的原因, 首先是改性后粘土表面的负电位变成正电位, 与呈负电位的藻华生物细胞之间由相互排斥转变为吸引, 另外, PAC高分子量、长分子链的特点, 使其对藻华生物细胞的作用半径增大, 桥联作用也增加了粘土与藻华生物细胞之间的范德华作用(俞志明等, 1994)。以往研究表明, 一定浓度的改性粘土对裸甲藻(Gymnodinium aerucyinosum Stein)、三角褐指藻(Phaeodactylum tricornutum Bohlin)、赤潮异弯藻(Heterosigma akashiwo)、中肋骨条藻(Skeletonema costatum)、微型原甲藻(Prorocentrum minimum)、褐潮藻(Aureococcus anophagefferens)等均有良好的去除效果(俞志明等, 1994; 曹西华等, 2003; 张雅琪等,2013)。浒苔微观繁殖体(包括孢子、配子、合子)个体长 10μm 左右, 宽 5μm 左右, 大小与微藻细胞相仿,且表面分泌的糖蛋白使其易发生附着(王建伟等,2006; 王晓坤等, 2007)。此外, 与上述几种微藻类似,使用 Zeta电位仪测得试验用微观繁殖体培养液的电位为负值, 因此, 表面呈正电性的改性粘土对浒苔微观繁殖体有较好的絮凝效果。

图3 添加不同用量改性粘土4h后微观繁殖体密度以及去除率的变化情况Fig.3 Changes in the microscopic propagule density and removal rate 4 hours after addition of modified clay
2.3 改性粘土对浒苔微观繁殖体萌发的影响
实际应用中, 大部分的改性粘土-微藻絮凝物沉降到海底, 有少部分可能会在海流和水团的作用下与上层水体重新混匀, 使被絮凝的微藻(本文中为浒苔微观繁殖体)重新释放到水中。故本研究在改性粘土去除实验后, 分别测定了上层培养液中微观繁殖体的萌发率, 以及上层培养液与絮凝物重新混匀的培养液中微观繁殖体的萌发率(见图 4)。实验结果表明, 随着改性粘土浓度从0g/L提高到1.0g/L, 上层培养液中浒苔微观繁殖体的萌发率由 58%降至 1.6%;而在重新混匀的培养液中, 微观繁殖体的萌发率由57%降至6.5%。可见改性粘土的使用能够有效降低微观繁殖体的萌发率, 重新混合之后萌发率相比上层培养液有所提高, 但是在改性粘土的浓度达到1.0g/L时, 依然能够起到很好的抑制萌发的作用。
在改性粘土的作用下, 大部分的浒苔微观繁殖体絮凝沉降至培养液底层, 故上层培养液中含有的繁殖体数目相对较少。对比图3和图4可以发现, 随着改性粘土的提高, 上层培养液中浒苔微观繁殖体的萌发率与其密度的下降趋势基本一致。因此, 上层培养液中浒苔微观繁殖体萌发率降低的主要原因,可以归结为改性粘土通过其絮凝沉降作用去除了培养液中大部分的微观繁殖体。
而对于重新混匀之后的培养液, 浒苔微观繁殖体萌发率随改性粘土浓度而变化(如图 4)的原因与形成絮体的致密性有关。在改性粘土用量较低时, 形成的絮凝体强度、致密性较低, 在被重新混匀的过程中那些被改性粘土絮凝沉降的浒苔微观繁殖体容易摆脱絮凝体的束缚, 重新回到培养液中, 继而萌发, 这可能是导致低浓度改性粘土添加组重新混合之后萌发率相对较高的原因。随着改性粘土浓度的增加, 絮凝体的强度和致密性均相对提高, 被絮凝的浒苔微观繁殖体难以脱离其束缚, 由图4可见在改性粘土用量为1.0g/L时, 两种取样方法中萌发率的差异并不明显。
此外, 大型藻类微观繁殖体的释放、萌发和生长受到光照、温度、盐度、营养盐等一系列因素的影响。Sousa等(2007)的研究发现, 微观繁殖体的萌发率和生长速度在一定范围内随着光照强度的提高而增加,与培养液中可溶性磷酸盐的浓度也有明显的正相关性。改性粘土将微观繁殖体絮凝到实验容器底部, 使其接受到光照的强度大大降低; 沉降絮体的再悬浮也会降低培养液的透光度。同时, 改性粘土对培养液中的营养盐, 特别是可溶性磷酸盐具有较强的吸附作用(俞志明等, 1995), 早在 1940年, Murphy(1940)就发现高岭土对溶液中的磷酸盐有很强的去除能力,在pH为7—8时, 高岭土对磷酸盐的吸附能力为91µg P/g(Edzwald et al, 1976), 本实验室以往研究也表明0.4g/L的改性粘土使培养液中的溶解无机磷降低85%(卢光远等, 2014)。另外, 微观繁殖体中的配子需要结合成合子才能正常萌发成为一株浒苔(Lin et al,2008), 而改性粘土的絮凝作用降低或者消除了微观繁殖体的活动能力, 使雌雄配子接合的几率大大降低。综合以上几方面的影响, 改性粘土对浒苔微观繁殖体的萌发起到明显的限制作用。

图4 上层培养液和重新混匀的培养液中浒苔微观繁殖体的萌发率Fig.4 Rates of propagules germination in upper water column and remixed water column
3 小结
添加适当浓度的改性粘土可以在4h内将培养液中大部分的浒苔微观繁殖体沉降至容器底部, 并且明显降低其萌发率。0.4g/L的改性粘土可以从初始密度为4.8×105cell/mL的培养液中去除80%以上的微观繁殖体, 1.0g/L的改性粘土可使其萌发率由60%左右降至低于6.5%。
而以往的研究表明黄海绿潮灾害的持续爆发与浒苔以复杂的繁殖方式在海洋中散布大量的微观繁殖体有关(Ye et al, 2011; Liu et al, 2013)。即便在非繁殖季节, 藻体破裂同样能够造成大量孢子的产生和释放(Nordby, 1977)。因此, 在相关海域观测到浒苔微观繁殖体集中释放时, 如能根据其实测密度喷洒适当量的改性粘土, 此方法或可成为去除海水中的微观繁殖体, 限制浒苔萌发, 消除或者减轻绿潮灾害,保障沿海经济持续稳定发展的有效手段。
此外, 浒苔在萌发初期(例如 2—8细胞状态时),个体也十分微小, 可以推测改性粘土对其亦会具有良好的去除效果, 同时限制其进一步生长, 该方面的研究仍需进一步的实验验证。
王建伟, 林阿朋, 李艳燕等, 2006. 浒苔(Enteromorpha prolifera)藻体发育的显微观察. 生态科学, 25(5): 400—404
王晓坤, 马家海, 叶道才等, 2007. 浒苔(Enteromorpha prolifera)生活史的初步研究. 海洋通报, 26(5): 112—116
卢光远, 宋秀贤, 俞志明等, 2014. 改性黏土絮凝海洋原甲藻对水体中氮、磷的影响研究. 中国环境科学, 34(2):492—498
乔方利, 马德毅, 朱明远等, 2008. 2008年黄海浒苔爆发的基本状况与科学应对措施. 海洋科学进展, 26(3): 409—410
乔方利, 王关锁, 吕新刚等, 2011. 2008与2010年黄海浒苔漂移输运特征对比. 科学通报, 56(18): 1470—1476
张晓红, 2011. 温度, 盐度等环境因子对浒苔(Enteromorpha prolifera)及繁殖体生长的影响. 青岛: 国家海洋局第一海洋研究所硕士学位论文
张雅琪, 俞志明, 宋秀贤等, 2013. 改性黏土对褐潮生物种Aureococcus anophagefferens的去除研究. 海洋学报,35(3): 197—203
俞志明, 马锡年, 谢 阳, 1995. 粘土矿物对海水中主要营养盐的吸附研究. 海洋与湖沼, 26(2): 208—214
俞志明, 邹景忠, 1994. 一种提高粘土矿物去除赤潮生物能力的新方法. 海洋与湖沼, 25(2): 226—232
曹西华, 俞志明, 2003. 有机改性粘土去除有害赤潮藻的研究.应用生态学报, 14(7): 1169—1172
Anderson D M, 1997. Turning back the harmful red tide. Nature,388(6642): 513—514
Anderson D M, Bricelj V M, Cullen J J et al, 2001. Monitoring and management strategies for harmful algal blooms in coastal waters. Unesco, UN, 182
Anderson D M, Glibert P M, Burkholder J M, 2002. Harmful algal blooms and eutrophication: Nutrient sources,composition, and consequences. Estuaries, 25(4): 704—726 Anderson R J, Monteiro P M S, Levitt G J, 1996. The effect of localised eutrophication on competition between Ulva lactuca (Ulvaceae, Chlorophyta) and a commercial resource of Gracilaria verrucosa (Gracilariaceae, Rhodophyta).Hydrobiologia, 326—327: 291—296
Callow M E, Callow J A, Pickett-Heaps J D et al, 1997. Primary adhesion of Enteromorpha (Chlorophyta, Ulvales)propagules: Quantitative settlement studies and video microscopy. Journal of Phycology, 33(6): 938—947
Charlier R H, Morand P, Finkl C W et al, 2007. Green tides on the Brittany coasts. Environmental Research, Engineering &Management, 3(41): 52—59
Edzwald J K, Toensing D C, Leung M C Y, 1976. Phosphate adsorption reactions with clay minerals. Environmental Science & Technology, 10(5): 485—490
Hiraoka M, Shimada S, Uenosono M et al, 2004. A new green-tide-forming alga, Ulva ohnoi Hiraoka et Shimada sp.Nov. (Ulvales, Ulvophyceae) from Japan. Phycological Research, 52(1): 17—29
Largo D B, Sembrano J, Hiraoka M et al, 2004. Taxonomic and ecological profile of “green tide” species of Ulva (Ulvales,Chlorophyta) in central Philippines. Hydrobiologia,512(1—3): 247—253
Lin A P, Shen S D, Wang J W et al, 2008. Reproduction diversity of Enteromorpha prolifera. Journal of Integrative Plant Biology, 50(5): 622—629
Liu F, Pang S J, Chopin T et al, 2013. Understanding the recurrent large-scale green tide in the Yellow Sea: Temporal and spatial correlations between multiple geographical,aquacultural and biological factors. Marine Environmental Research, 83: 38—47
Murphy H F, 1940. Clay minerals and phosphate availability: I.Adsorption of phosphate ions by clay minerals. Proceedings of the Oklahoma Academy of Science, 20: 79—81
Nelson T A, Haberlin K, Nelson A V et al, 2008. Ecological and physiological controls of species composition in green macroalgal blooms. Ecology, 89(5): 1287—1298
Nordby Ø, 1977. Optimal Conditions for Meiotic Spore Formation in Ulva Mutabilis Føyn. Botanica Marina, 20(1):19—28
Sousa A I, Martins I, Lillebø A I et al, 2007. Influence of salinity,nutrients and light on the germination and growth of Enteromorpha sp. spores. Journal of Experimental Marine Biology and Ecology, 341(1): 142—150
Wang J F, Jiang P, Cui Y L et al, 2010. Molecular analysis of green-tide-forming macroalgae in the Yellow Sea. Aquatic Botany, 93(1): 25—31
Ye N H, Zhang X W, Mao Y Z et al, 2011. “Green tides” are overwhelming the coastline of our blue planet: taking the world's largest example. Ecological Research, 26(3):477—485
Zhao J, Jiang P, Liu Z Y et al, 2013. The yellow sea green tides were dominated by one species, Ulva (Enteromorpha)prolifera, from 2007 to 2011. Chinese Science Bulletin,58(19): 2298—2302
