IL-1β诱导支气管上皮细胞高迁移率族蛋白1主动释放*
2015-03-08谭小玉侯长春陈俊健刘唐娟周鸿江
谭小玉,侯长春,陈俊健,黎 雨,刘唐娟,周鸿江
(广西医科大学第一附属医院西院呼吸内科,南宁530007)
慢性气道炎症是支气管哮喘、慢性阻塞性肺疾病(COPD)等慢性气道疾病的核心病理生理学改变,IL-1β是已发现的启动和维持炎症最主要的因子之一[1]。研究发现,IL-1β在哮喘患者的肺泡灌洗液和肺活检标本中显著增高,支气管上皮细胞是主要来源[2],但IL-1参与气道炎症机制未完全明了。气道上皮细胞在气道及肺部固有免疫和获得性免疫过程中扮演着重要角色,研究表明气道上皮细胞可通过释放肿瘤坏死因子-α(TNF-α)、胸腺基质淋巴细胞生成素(TSLP)等炎症因子参与哮喘、COPD等慢性气道疾病炎症过程[3]。高迁移率族蛋白1(high mobility group protein B1,HMGB1)在内毒素血症作为晚期炎症介质发挥促炎作用,众多研究也表明HMGB1参与多种局部性和全身性炎症性疾病的炎症过程[4-5]。有研究证明,HMGB1在哮喘和COPD患者诱导痰、肺活检标本中显著增加,与肺功能严重程度呈显著正相关,表明HMGB1是参与慢性气道炎症发生、发展一种重要炎症介质[6-7]。本研究探讨IL-1β能否诱导支气管上皮细胞的HMGB1表达和释放,以增加对IL-1β参与慢性气道疾病发病机制的理解,现报道如下。
1 材料与方法
1.1 材料选用 健康人支气管上皮细胞(HBE)135-E6E7(美国ATCC,CRL-2741TM);胞核蛋白提取试剂盒(武汉博士德公司);Human HMGB1ELISA kit(ground biotechnology diagnosticate,USA)。
1.2 方法
1.2.1 培养 HBE135-E6E7 用含10%胎牛血清,100U/mL青霉素,100μg/mL的链霉素的RPMI-1640培养基,37℃、5%CO2培养箱培养,80%~90%融合后,2~3d传一代。HBE细胞胰酶消化后,按2.5×104个/cm2的密度传至6孔板、24孔板、96孔板,继续培养,细胞刺激前24h换成角质化无血清培养基培养。分别加入不同浓度IL-1β。
1.2.2 四唑盐(MTT)比色法检测细胞活力 传至96孔板的HBE,加入0.1、1.0、10.0ng/mL不同浓度的IL-1β,同时以未加任何处理因素的HBE作为对照组,每个浓度设8个复孔。培养24h后,每孔加入浓度为5mg/mL的20μL MTT,37℃、5%CO2培养箱内孵育4h,弃培养液,加入150μL二甲基亚砜(DMSO)振荡仪振荡至晶体颗粒溶解,在酶标仪上测定490nm的吸光度值(A值),细胞活力=(加IL-1β组A值-不加细胞组A值)/(不加IL-1β对照组A值-不加细胞组A值)×100%。
1.2.3 实时荧光定量PCR(RT-PCR) 采用异硫氰酸胍法提取总RNA。将IL-1β处理或对照的HBE(6孔板)加入TRIzol(invitrogen)1mL吹匀,然后经过氯仿萃取,异丙醇沉淀,70%乙醇冲洗沉淀后,以焦碳酸二乙酯(DEPC)水溶解。用分光光度计测量RNA浓度,以1μg总RNA为底物,加入20μL RT反应体系中进行反转录合成cDNA(按format;thermo scientific说明书进行),-20℃冻存备用。Real-time PCR反应中所用的引物:HMGB1引物:上游:5′-TGT CCA CAC ACC CTG CAT ATT G-3′,下 游:5′-AAT CCC ATG GTG TGA CAG AAT GGA-3′,序列长度为446bp;β-actin:上游5′-AAG AGA GGC ATC CTC ACC CT-3′和下游5′-TAC ATG GCT GGG GTG TTG AA-3′,序列长度为324bp。RT-PCR反应条件:95℃变性5min,95℃15s,60℃45s,72℃30s,共40个循环。采用SYBR Premix EX Taq(Takana)荧光,整个RT-PCR过程在ABI 7900荧光定量PCR仪上完成,荧光信号使用SDS软件分析。每组实验重复3次。
1.2.4 免疫蛋白印迹检测IL-1β刺激HBE总蛋白、胞核、胞浆HMGB1表达 按胞质和胞核蛋白提取试剂盒(武汉博士德公司)说明书步骤提取胞质胞核蛋白,简述如下:收集处理后的细胞,加入100μL预冷的缓冲液A[10mmol/L 4-羟乙基哌嗉乙磺酸(HEPES),pH 7.9;10mmol/L KCl;0.1mmol/L EDTA;0.1mmol/L 乙 二 酸 醇 双 (2-氨 基 乙 基 醚 )四 乙 醉(EGTA);1mmol/L 二硫苏糖醇(DTT);0.5mmol/L 苯甲基磺酰氟(PMSF)]剧烈震荡30s后,冰上静置15min破坏细胞膜,2 000×g离心10min,上清液部分即为胞质蛋白,沉淀,加入15μL预冷的缓冲液 B (20mmol/L HEPES,pH 7.9;0.4 mol/L NaCl;1mmol/L EDTA;1mmol/L EGTA;1mmol/L DTT;1mmol/L PMSF)冰上静置30min,每隔5min剧烈振荡1次,破坏核膜,4℃下15 000×g离心5min,上清液含核蛋白组分。BCA法蛋白质定量置-80℃冰箱保存备用。经10%十二烷基-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离1.5h、转膜1.5h到硝酸纤维素膜(Pall公司)和5%脱脂奶粉室温封闭1h后,依次加入兔抗HMGB1,β-actin单克隆抗体(Abcam 1∶1 000)1%TBST 4℃过夜、辣根过氧化酶耦联的兔抗羊 (中衫金桥,1∶6 000),ECL化学发光法显影,Quantity One凝胶成像系统观察分析条带灰度值。
1.2.5 双抗体夹心ELISA法检测培养基中HMGB1 严格按照Human HMGB1ELISA Kit的说明书操作。将50μL标准品和上清液加入抗体包被的96孔板内,在上清液样本孔中分别加入50μL酶标记溶液后充分混匀;置于温箱内37℃孵育60min;用1×PBS手工洗板清洗5次;每孔各加50μL反应液A和B;盖起微孔板37℃孵育15min,每孔加50μL终止液终止反应,30min后用酶标仪测定每孔的吸光度值(450nm),依据标准曲线计算上清液样本蛋白浓度。实验重复3次。
1.2.6 免疫荧光观察IL-1β刺激后对HBE HMGB1的移位的影响 在支气管上皮细胞爬片后,4%多聚甲醛固定15min,0.1%Triton-100处理10min,每片滴50μL 5%BSA封闭,37℃,30min;滴加 HMGB1一抗(1∶100稀释)37℃,90min,PBS冲洗3次;避光滴加荧光二抗,37℃,60min,PBS冲洗;50%甘油封片,荧光显微镜下观察、照相。
1.3 统计学处理 采用SPSS16.0统计软件进行处理,计量资料用±s表示,组间比较采用单因素方差分析,多组间比较采用SNK法,以P<0.05为差异有统计学意义。
2 结 果
2.1 MTT比色法检测不同浓度IL-1β对细胞活力的影响分别用0、0.1、1.0、10.0ng/mL浓度IL-1β刺激 HBE 24h,各组细胞活力分别为100.0%、95.6%、100.3%、105.2%(图1)。与对照组比较,各浓度的IL-1β对HBE活力影响差异无统计学意义(P>0.05)。

图1 不同浓度IL-1β对HBE细胞活力影响(n=8)
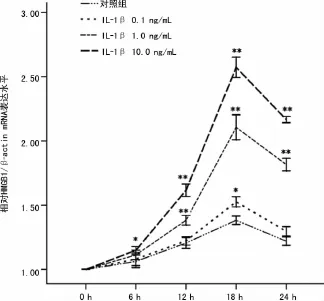
图2 IL-1β上调了HBE的HMGB1的mRNA表达水平
2.2 IL-1β对支气管上皮细胞HMGB1mRNA和蛋白表达影响 支气管上皮细胞组成性表达HMGB1,对照组HBE的HMGB1mRNA表达水平在18h最高(图2)。IL-1β以浓度和时间依赖方式增加了HBE的HMGB1mRNA表达水平,最显著的差异性发生在IL-1β10ng/mL刺激HBE 18h时,约为对照组2.5倍(2.78±0.08vs.1.35±0.04)。IL-1β0.1ng/mL只是在18h轻度增加了 HMGB1mRNA表达。IL-1β1.0、10.0ng/mL刺激HBE 24h,HBE的 HMGB1蛋白表达水平升高,IL-1β10ng/mL更明显,见图3。
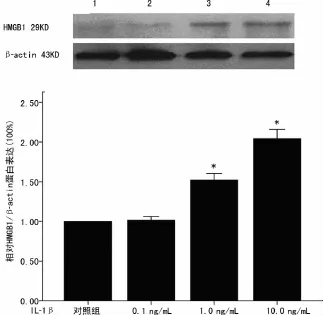
图3 IL-1β上调了HBE的HMGB1的蛋白表达水平
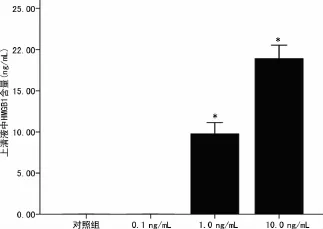
图4 ELISA检测不同剂量IL-1β对HBE释放HMGB1的影响
2.3 IL-1β对支气管上皮细胞 HMGB1释放的影响 0、0.1、1.0、10.0ng/mL IL-1β刺激 HBE 24h后上清液 HMGB1蛋白含量分别为(9.77±1.03)ng/mL及(18.90±1.34)ng/mL,统计分析发现对照组和0.1ng/mL IL-1β刺激组细胞上清液HMGB1含量低于试剂盒检测下限。1.0ng/mL和10.0ng/mL IL-1β刺激HBE 24h后HMGB1蛋白含量明显增加,10.0 ng/mL IL-1β更加显著(P<0.05),IL-1β对 HBE HMGB1的释放有剂量依赖性(图4)。本研究也观察了IL-1β影响HMGB1分泌释放有时间依赖性,10.0ng/mL IL-1β刺激HBE 0、6、12h及24h后上清液中HMGB1蛋白含量分别为(11.60±0.83)ng/mL、(19.80±0.89)ng/mL,统计学分析后发现:10.0ng/mL IL-1β刺激支气管上皮细胞6h后,细胞上清液中HMGB1含量无变化,而当刺激时间延长至12h和24 h,上清液中HMGB1含量明显增加(P<0.05),见图5。
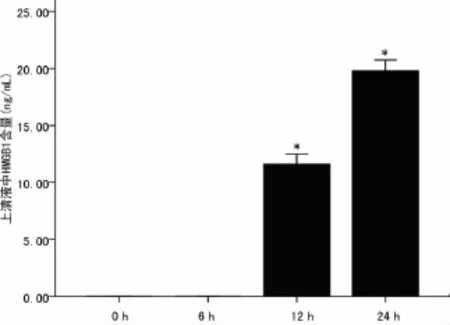
图5 在不同时间点IL-1β(10.0ng/mL)对 HBE细胞培养上清液HMGB1水平的影响
2.4 IL-1β对HBE胞质和胞核HMGB1含量影响 通过蛋白免疫印迹方法检测发现IL-1β(10.0ng/mL)刺激 HBE 24h后,发现胞核蛋白有减少,而细胞胞质蛋白相应明显增加,这进一步印证了IL-1β诱导了HBE的HMGB1的释放(图6)。免疫荧光发现HMGB1高丰度表达于未受刺激HBE的细胞核,少量表达于细胞质,免疫荧光进一步证实IL-1β刺激HBE,HMGB1从胞核中转位出来,见图7。
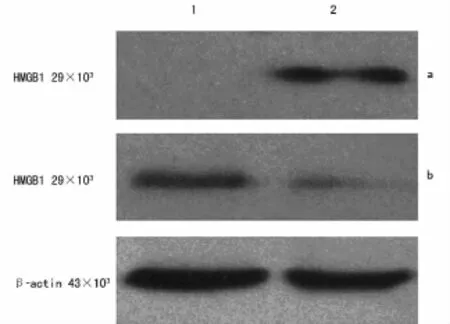
图6 IL-1β(10.0ng/mL)对 HBE细胞质和细胞核HMGB1表达的影响
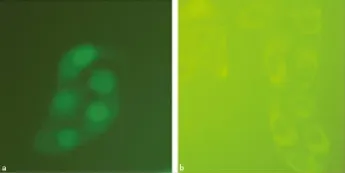
图7 免疫荧光观察IL-1β对HBE HMGB1表达及移位的影响
3 讨 论
HMGB1在非应激状态下主要定位细胞核内,在细胞因子、损伤等应激状态下,HMGB1可以被主动释放到胞外,发挥其胞外促炎症等效应[5]。研究发现H2O2可以诱导支气管上皮细胞HMGB1的主动释放[8]。本研究在体外研究发现,IL-1β可以浓度和时间依赖性地增加支气管上皮细胞HMGB1表达,并促进HMGB1从胞核向胞浆转位和主动释放到胞外。
研究证明IL-1β是启动和维持机体内炎性反应最重要的细胞因子之一[1],是一种典型的多功能细胞因子。IL-1β可以促进单核细胞、中性粒细胞等多种免疫细胞和组织细胞炎症因子释放,亦可以促进骨髓修复,有利于癌症治疗。IL-1β在稳定期COPD患者中产生增多,在COPD急性加重期进一步升高[9],IL-1β在哮喘患者支气管上皮细胞、巨噬细胞和肺泡灌洗液中表达也增加[2]。Lappalainen等[10]通过IL-1β转基因动物模型证明高表达IL-1β可以引起肺泡间隔扩大、气管壁增厚、黏液分泌增加、肺间质纤维化等,这些符合支气管哮喘和COPD病理学改变。初步揭示IL-1β诱导肺部这些病变与增加中性粒细胞趋化因子CXCL1、CXCL2和基质金属蛋白酶(MMP-9和MMP-12)有关,但是否存在其他机制尚不明确。
HMGB1是细胞核内非组蛋白染色质蛋白,核内主要参与稳定染色质结构与功能并协调基因转录调控。HMGB1作为损伤相关分子模式(DAMPs)分子通过释放到胞外发挥促炎症作用成为近年来该分子研究的热点[11]。单核细胞、巨噬细胞、中性粒细胞等炎症细胞在各种外界刺激因素或应激下HMGB1可以从细胞中释放出来,促进炎性反应。在脓毒血症和关节炎等炎症过程中,HMGB1可以通过募集中性粒细胞,促进内皮细胞表达黏附分子,促进树突状细胞成熟等途径参与促炎反应[11]。
HMGB1在真核生物细胞核中广泛高丰度表达,在肺部HMGB1被发现主要高表达于支气管上皮细胞和肺泡巨噬细胞[12],OVA致敏哮喘小鼠模型进一步被证实HMGB1主要定位于支气管上皮细胞[13]。这些结果高度提示支气管上皮细胞是肺部HMGB1主要来源,这也是本研究选择支气管上皮细胞作为研究靶点的主要原因。本研究首先通过MTT法证实实验选用浓度的IL-1β对支气管上皮细胞无毒性,而且IL-1β的剂量也接近于体内生理量和哮喘、COPD患者肺内表达量。本研究发现IL-1β不仅能诱导HMGB1表达,还可促进HMGB1的转位和主动释放,进一步验证了气道上皮细胞是作为DAMPs分子HMGB1的重要来源。本研究发现的IL-1β促进HMGB1的主动释放类似于既往的研究,均具有一定时间和浓度依赖性[8]。更重要的是,大量的研究证实HMGB1在哮喘和COPD、慢性肺源性心脏病发病中起作用,因而被诱导释放HMGB1可能是IL-β介导慢性气道炎症的新机制之一[6-8,13-15]。IL-β不仅可以通过增加 CXCL1、CXCL2和基质金属蛋白酶来加剧气道炎症,通过诱导释放HMGB1也可能是另一条重要途径。
目前气道上皮细胞HMGB1释放的机制涉及相关的信号通路的活化尚不清楚,而释放到局部气道腔能否与IL-1β形成复合物也是值得探讨的问题,因为HMGB1-IL-1β复合物促炎症功能远大于单一的HMGB1或IL-1β。这些是本研究课题组接下来探讨的方向,将进一步研究。
[1] Dinarello CA.Biologic basis for interleukin-1in disease[J].Blood,1996,87(6):2095-2147.
[2] Sousa AR,Lane SJ,Nakhosteen JA,et al.Expression of interleukin-1beta (IL-1beta)and interleukin-1receptor antagonist(IL-1ra)on asthmatic bronchial epithelium[J].Am J Respir Crit Care Med,1996,154(4Pt 1):1061-1066.
[3] Kato A,Schleimer RP.Beyond inflammation:airway epithelial cells are at the interface of innate and adaptive immunity[J].Curr Opin Immunol,2007,19(6):711-720.
[4] Wang H,Bloom O,Zhang M,et al.HMG-1as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248-251.
[5] Yang H,Wang H,Czura CJ,et al.The cytokine activity of HMGB1[J].J Leukoc Biol,2005,78(1):1-8.
[6] Hou C,Zhao H,Liu L,et al.High mobility group protein B1(HMGB1)in Asthma:comparison of patients with chronic obstructive pulmonary disease and healthy controls[J].Mol Med,2011,17(7/8):807-815.
[7] Ferhani N,Letuve S,Kozhich A,et al.Expression of highmobility group box 1and of receptor for advanced glycation end products in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2010,181(9):917-927.
[8] 侯长春,赵海金,李文军,等.过氧化氢诱导支气管上皮细胞高迁移率族蛋白1主动释放[J].南方医科大学学报,2010,32(8):1131-1134.
[9] Chung KF.Cytokines in chronic obstructive pulmonary disease[J].Eur Respir J 2001,34(Suppl 1):S50-59.
[10] Lappalainen U,Whitsett JA,Wert SE,et al.Interleukin-1beta causes pulmonary inflammation,emphysema,and airway remodeling in the adult murine lung[J].Am J Respir Cell Mol Biol,2005,32(4):311-318.
[11] Lotze MT,Tracey KJ.High-mobility group box 1protein(HMGB1):nuclear weapon in the immune arsenal[J].Nat Rev Immomunol,2005,5(4):331-342.
[12] Hamada N,Maeyama T,Kawaguchi T,et al.The role of high mobility group box1in pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2008,39(4):440-447.
[13] 付亮,蔡绍曦,赵海金,等.N-乙酰半胱氨酸对哮喘小鼠肺组织HMGB1、RAGE表达的影响[J].南方医科大学学报,2008,28(5):692-699.
[14] Shim EJ,Chun E,Lee HS,et al.The role of high-mobility group box-1 (HMGB1)in the pathogenesis of asthma[J].Clin Exp Allergy,2012,42(6):958-965.
[15] 其美卓嘎,仓姆拉,李献,等.HMGB1在高原慢性肺源性心脏病急性发病过程中的检测及意义[J].重庆医学,2007,36(10):909-911.
