多氯联苯降解菌所产联苯双加氧酶的酶学性质
2015-03-07彭书传
赵 翔, 方 丽, 彭书传, 吴 克
(1.合肥工业大学 资源与环境工程学院,安徽 合肥 230009;2.合肥学院 生物与环境工程系,安徽 合肥 230601)
0 引 言
多氯联苯(polychlorinated biphenyls,简称PCBs)是德国科学家H·施米特和G·舒尔茨于1881年首次在实验室以联苯为原料在金属催化剂的作用下高温氯化生成的一类物质[1],其性质与DDT类似,分子式为(C12H10)nCln。PCBs具有持久性,一旦排放到环境中就很难被降解和分解[2];还有生物蓄积性[3]、挥发性与远距离迁移性[4]以及高毒性[5]。人们开始研究怎样检测、分离和降解PCBs[6]。
多氯联苯好氧降解包括上下游2步[7]:上游途径中PCBs氧化开环转化为氯代苯甲酸和五碳烯酸;下游途径中氯代苯甲酸继续降解,最后进入三羧酸循环。微生物对多氯联苯的降解,主要是通过其所产酶的催化氧化起作用,其中联苯双加氧酶在降解过程中起了主要作用[8]。这种酶通过催化氧原子在联苯苯环上发生反应生成儿茶酚,然后导致苯环发生开环反应。
本文以课题组保藏菌种多氯联苯降解菌枯草杆菌WF1为研究对象,对其生成的联苯双加氧酶进行了酶学性质的研究,主要包括联苯双加氧酶在细胞中的定位,温度、pH值、种龄及金属离子对酶活力的影响,以及其酶解反应动力学特征。
1 材料与方法
1.1 微生物及其培养基
微生物:多氯联苯降解菌为本课题组保藏菌种,命名为枯草杆菌WF1。
无 机 盐 培 养 基:KH2PO40.5g/L、K2HPO40.5g/L、MgSO40.2g/L、CaCl20.1g/L、NaCl 0.2g/L、(NH4)2SO41.0g/L,联苯0.5g/L,pH值为7.0。固体培养基中加入2%琼脂。
降 解 培 养 基:KH2PO40.5g/L、K2HPO40.5g/L、MgSO40.2g/L、CaCl20.1g/L、NaCl 0.2g/L、(NH4)2SO41.0g/L,2,3′,4′,5-四氯联苯-正己烷溶液0.5mg/L,pH 值为7.0。
培养基(不加联苯)均在121℃、0.1MPa下灭菌20min后使用,联苯经过紫外灭菌后再加入到培养基中。
1.2 分析方法
蛋白质含量测定采用考马斯亮蓝G-250法[9]。
酶活分析方法的建立:多氯联苯的降解是由联苯双加氧酶主导的,2,3-二羟基联苯双加氧酶催化2,3-二羟基联苯生成2-羟基-6-氧-6-苯基-2,4-二烯酸(HOPDA)的过程,此物质在434nm处有最大吸收。因此,用紫外-可见分光光度计测定反应体系中产物在434nm处的吸光值,以此来测定酶活力。
1.3 实验方法
1.3.1 粗酶液的制备方法
将菌体在无机盐培养基中培养后投入到降解培养基中,以35℃、150r/min培养48h后,于4℃、11 000r/min离心10min,收集上清液得到胞外粗酶液。菌体用磷酸缓冲液(25mmol/L,pH=7.4)震荡清洗2次后悬浮,在冰浴中用超声波细胞破碎仪破碎细胞30min,最后于4℃、22 000r/min离心20min,收集上清液,即得到胞内粗酶液[10-15]。
1.3.2 PCBs降解酶在细胞中的定位
分别检测菌株发酵培养基上清液和菌体中的PCBs降解酶活性,以确定菌株PCBs降解酶属于胞内酶还是胞外酶。
1.3.3 PCBs降解酶酶活力影响因素
分别研究环境温度、pH值、种龄及重金属离子对酶活力大小的影响,以确定酶促反应的最适条件。
(1)温度对酶活的影响。分别在15、25、35、45、55、65℃下发酵培养2d,并在25、30、35℃下分别保温1h,在35℃水浴中测定酶活,以35℃培养2d保温0h的酶活为基准(100%)。
(2)pH值对酶活力的影响。分别在pH值为 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0 下 于35℃水浴中保温0、1、2h,测定酶活,以在pH=7.5下保温0h的酶活作为基准(100%)。
(3)种龄对酶活的影响。分别将种龄为12、24、36、48、60、72h的种子培养液接种进液体降解培养基中,测定PCBs降解酶的酶活,以种龄为72h的降解培养液的酶活作为基准(100%)。
(4)金属离子对酶活的影响。在液体降解培养基中分别加入相同质量浓度的 Na+、K+、Fe2+、Mg2+、Cu2+和 Ca2+,在相同条件下以不含以上金属离子的培养基作对照,摇瓶发酵72h,测定酶活。
(5)PCBs降解酶的动力学研究。酶液量对反应速度的影响:分别移取5份2mL PCBs溶液在35℃水浴中保温5min,各加入粗酶2、4、6、8、10mL,计时2min,然后加入NaOH溶液终止反应。底物浓度对反应速度的影响:分别加入2、4、6、8、10mLPCBs溶液于35℃水浴中保温5min,加入粗酶液2mL,计时2min,然后加入NaOH溶液终止反应。
2 结果与讨论
2.1 PCBs降解酶在细胞中的定位
检测PCBs降解酶在菌株WF1降解培养基上清液和菌体内的活性,结果得到胞外提取液的相对酶活为17%,而胞内提取液的相对酶活为82%。菌株WF1的液体降解培养基中上清液部分几乎检测不出活性,而菌体能检测出较高的酶活,由此推断菌体产生的降解PCBs的代谢酶属于胞内酶。
2.2 温度对酶活力的影响
不同温度对产PCBs降解酶的酶活及PCBs降解酶在不同温度条件下的稳定性如图1所示。结果表明,菌株WF1所产PCBs降解酶的最适温度在25~45℃,35℃时为最高,25、35、45℃下发酵液中提取的粗酶液在25、30、35℃中保温1h后的相对酶活都在50%左右。65℃条件下培养所产的PCBs降解酶相对酶活力均在20%以下,在30℃保温1h后相对酶活只有11%。

图1 温度对酶活力及其稳定性的影响
2.3 pH值对酶活力的影响
酵体系中的pH值过低或过高对酶的催化都有不利影响,甚至使酶失活[16]。pH值对酶活力及其稳定性的影响如图2所示,菌株WF1的最适产PCBs降解酶pH值在6.5~8.0左右,且在弱碱性环境下的相对酶活力比弱酸性环境要高。菌株WF1产酶的pH值稳定性也相对较好,在pH值为7.0~8.0范围内保温1h后能保持79%以上的活力,2h后仍能保持76%的活力,而pH值在小于6.5和大于8.0时酶活下降速度较快。
因此,可以通过缓冲溶液或者改变培养基的成分与比例等方法,对培养基的pH值进行适当的调节和控制,以满足细胞生长和产酶的需求。
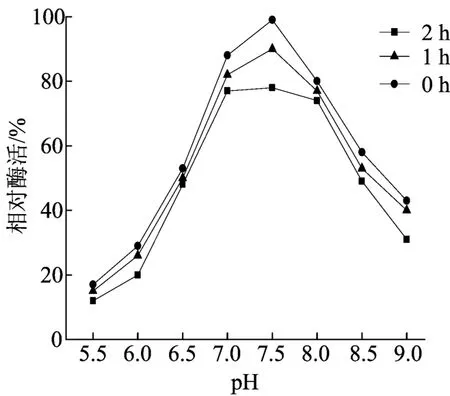
图2 pH值对酶活力及其稳定性的影响
2.4 种龄对酶活力的影响
种龄对酶活力的影响如图3所示,当菌体WF1种子培养72h后接入降解培养基,所获得的酶活相对较高。种龄的优化有利于掌握最佳发酵时间。种龄,指种子的生长年龄。种龄太短,用来接种发酵时,种子还处在延滞期或刚进入对数期,会导致前期菌体生长缓慢,发酵周期延长,甚至会造成异常发酵[17]。种龄太长,种子处在稳定期后期或衰亡期,接种后也会导致子代培养物的延滞期增长,因此选择合适的种龄进行接种就显得极为重要。一般选择对数生长期的后期或刚刚进入稳定期的菌体作为种子,此时整个群体的生理特性较为一致,菌体生长极为旺盛,细胞各成分平衡增长,可以很快适应新的环境,而且可以最大限度地提高细胞的干质量[18]。

图3 种龄对酶活力的影响
2.5 金属离子对酶活力的影响
金属离子是微生物生长代谢过程中非常重要的一类营养物质,它们在有机体内的生理作用很多,如参与酶的组成、构成酶的最大活性、调节与维持细胞的渗透压平衡、维持细胞结构的稳定性,控制细胞的氧化还原电位等[19-22]。不同金属离子对酶活力的影响不同,它们对酶的结构和功能所起的作用也不相同。具体情况见表1所列。Na+能显著提高酶活,K+基本没有影响,Mg2+、Ca2+、Fe2+和Cu2+则均有不同程度的抑制作用。
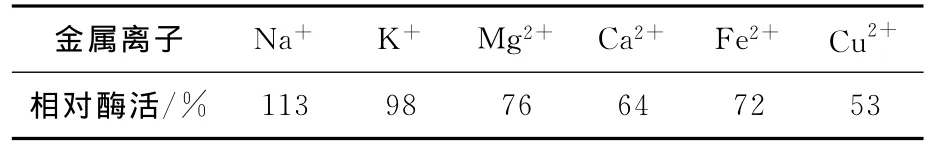
表1 金属离子对酶活力的影响
2.6 PCBs降解酶的动力学研究
2.6.1 酶液量对反应速度的影响
PCBs初始质量浓度为0.218mg/L,不同的酶液量对反应速度rp的影响见表2所列。rp=(ρ0-ρ反应后)/t。其中,ρ0为初始 PCBs质量浓度;ρ反应后为反应后PCBs质量浓度;t为反应时间。
以反应速度rp对酶液量做图以了解PCBs降解酶酶液量的影响。所得拟合方程为:

随着酶量的增加,反应速率成线性增加,表明联苯双加氧酶降解PCBs的反应速率与酶的质量浓度呈一级关系。
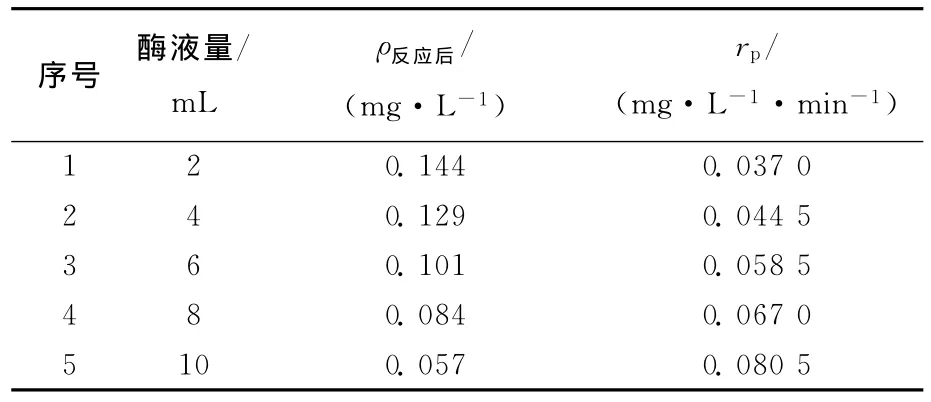
表2 酶液量对反应速度rp的影响
2.6.2 底物质量浓度对反应速度的影响
以PCBs作为唯一底物时其质量浓度变化对反应速率rp的影响见表3所列,做图如图4所示。
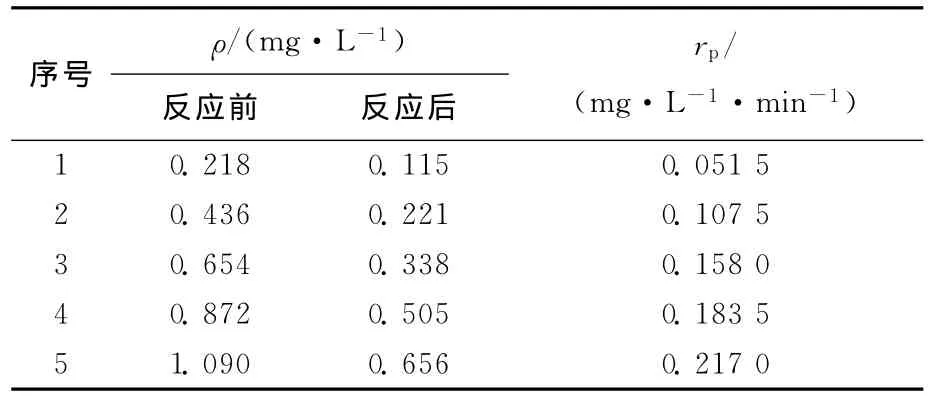
表3 底物质量浓度对反应速度rp的影响
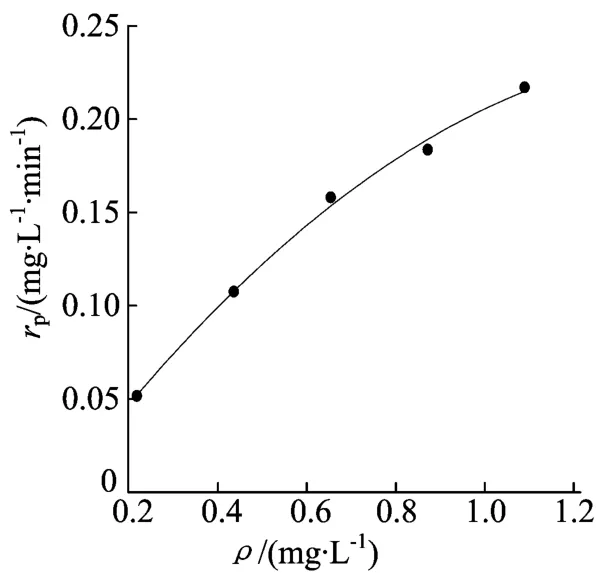
图4 底物质量浓度对反应速度rp的影响
由图4可以看出,以PCBs为唯一底物时,在酶浓度不变的情况下,酶促反应速度与底物质量浓度呈典型的双曲线关系。因此,可以用米氏(Michaelis-Menten)方程来模拟联苯双加氧酶降解PCBs的酶促反应过程。建立模型如下:
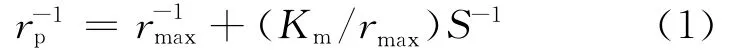
其中,rmax为酶浓度不变的情况下,酶被底物饱和所达到的最大反应速度;Km为米氏常数,当反应速度为最大反应速度1/2时所对应的底物质量浓度;S为底物质量浓度。
根据(1)式可得rmax=2.04mg/(L·min),Km=8.32mg/L。
3 结 论
(1)本实验在多氯联苯降解菌菌株 WF1中检测到联苯双加氧酶的活性,所产降解酶为胞内酶,确定其适宜反应温度为35℃,适宜pH值为7.5,且 Na+能提高酶活,K+基本没有影响,Mg2+、Ca2+、Fe2+和Cu2+则均有不同程度的抑制作用。
(2)对联苯双加氧酶降解多氯联苯的酶反应动力学研究表明,可以通过米氏方程+(Km/rmax)S-1为“模型”,确定其动力学特征参数,rmax和Km分别为2.04mg/(L·min)和8.32mg/L。
[1] 杨国兴.多氯联苯类(PCBs)及被其污染物质的安全处置[J].环境保护科学,1993,19(3):21-22.
[2] 金 军.多氯联苯毒性、分析方法和治理技术新进展[J].上海环境科学,1996,12(7):33-37.
[3] 余 刚,黄 俊,张彭义.持久性有机污染物:倍受关注的问题[J].环境保护,2001,23(4):37-40.
[4] 储少岗,徐晓白,童逸平.多氯联苯在典型污染地区环境中的分布及其环境行为[J].环境科学学报,1995,15(4):423-432.
[5] 蒋 可.环境中PCBs及其代谢物的测定[J].环境科学丛刊,1983,22(3):22-26.
[6] 瞿启云.β-环糊精/TiO2纳米颗粒复合物的制备及其对PCBs的吸附研究[J].合肥工业大学学报:自然科学版,2013,36(6):748-754.
[7] 吴 克,潘仁瑞,蔡敬民,等.微生物代谢环境难降解有机物的酶学研究进展[J].生物工程学报,2009,25(12):1871-1881.
[8] Furukawa K,Suenaga H,Goto M.Biphenyl dioxygenases:functional versatilities and directed evolution[J].J Bacteriol,2004,186(16):5189-5196.
[9] 陈毓荃.生物化学实验方法和技术[M].北京:科学技术出版社,2002:95-98.
[10] Singer A C.Integrated system enhancement for polychlorinated biphenyls bioremediation[D].California:University of California,2000.
[11] Master E R,Lai V W M,Kuipers B,et al.Sequential an-aerobic-aerobic treatment of soil contaminated with weathered Aroclor 1260[J].Environmental Science & Technology,2002,36(1):100-103.
[12] Hill G A,Milne B J,Nawroeki P A.Cometabolic degradation of 4-CP byAlcaligeneseutrophus[J].Appl Microbiol Biotechnol,1996,46:3-8.
[13] Bedard D L,May R J.Characterization of the polychlorinated biphenyls(PCBs)in the sediments of woods pond:evidence for microbial dechlorination of Aroclor 1260in situ[J].Environmental Science & Technology,1996,30:237-245.
[14] Brunner W,Sutherland F H,Focht D D,et al.Enhanced biodegradation of polychlorinated biphenyls in soil by analog enrichment and bacterial inoculation[J].Environmental Quality,1985,14:324-328.
[15] Yang Chufang,Lee C M,Wang C C.Isolation and physio-logical characterization of the pentachlorophenol degrading bacteriumSphingomonaschlorophenolica[J].Chemosphere,2006,62:709-714.
[16] 薛培俭,姜绍通,李兴江,等.发酵秸秆糖产丁二酸放线杆菌的CO2固定关键酶特性分析[J].合肥工业大学学报:自然科学版,2010,33(7):1066-1069.
[17] 王 涛,万红贵,蔡 恒,等.毕赤酵母发酵产木聚糖酶条件研究[J].中国酿造,2009,28(7):86-89.
[18] 田运佳.植酸酶生产过程主要影响因素研究[D].石家庄:河北科技大学,2010.
[19] Ferchak J D,Pye E K.Effect of cellobiose,glucose,ethanol,and metal ions on the cellulase enzyme complex ofThermomonosporafusca[J].Biotechnology & Bioengineering,1983,25(12):2865-2872.
[20] 李金花,程远征,张洪林.纤维素降解过程中金属离子作用的研究[J].临沂师范学院学报,2005,27(3):30-32.
[21] Rajagopal S V,Kumar K S,Sankar A U,et.al.Production and characterisation of cellulase byStreptobacillusspecies-aps-8[J].Journal of Pure and Applied Microbiology,2007,1(2):231-236.
[22] 程旺开.金属离子对纤维素酶活性影响的研究[J].安徽农学通报,2011,17(5):27-28.
