微小隐孢子虫类钙调蛋白基因的克隆与原核表达
2015-03-06杨晓娇米荣升王晓娟王向佩刘宇轩雷晓思陈兆国
杨晓娇,周 鹏,米荣升,黄 燕,石 凯,2,王晓娟,3,王向佩,3,刘宇轩,雷晓思,2,陈兆国*
(1.中国农业科学院上海兽医研究所,农业部动物寄生虫学重点实验室,农业部动物产品质量安全生物性危害因子风险评估实验室(上海),上海 200241;2. 四川农业大学动物医学院,四川雅安 625014;3.吉林农业大学动物科学技术学院,吉林长春 130118)
微小隐孢子虫类钙调蛋白基因的克隆与原核表达
杨晓娇1,周 鹏1,米荣升1,黄 燕1,石 凯1,2,王晓娟1,3,王向佩1,3,刘宇轩1,雷晓思1,2,陈兆国1*
(1.中国农业科学院上海兽医研究所,农业部动物寄生虫学重点实验室,农业部动物产品质量安全生物性危害因子风险评估实验室(上海),上海 200241;2. 四川农业大学动物医学院,四川雅安 625014;3.吉林农业大学动物科学技术学院,吉林长春 130118)
为了对微小隐孢子虫(C.parvum)类钙调蛋白(CML)基因进行原核表达,分析重组表达蛋白的反应原性。以C.parvum卵囊cDNA为模板,用PCR方法扩增得到C.parvumCML基因。将CML基因连接到克隆载体pMD18-T,获得重组质粒pMD-CML,经限制性内切酶BamH Ⅰ和XhoⅠ双酶切后,连接到经相同内切酶酶切的表达载体pGEX-6p-1上,构建重组表达质粒,转化到大肠埃希菌BL21(DE3)中进行诱导表达。利用GST亲和树脂法纯化重组表达蛋白,对纯化的重组蛋白进行Western blot分析。结果表明,成功构建了重组原核表达质粒pGEX-CML,重组质粒转化菌经IPTG诱导后成功地表达出了分子质量约为51 ku的重组蛋白rCML,纯化的蛋白rCML能与感染兔隐孢子虫(C.cuniculus)的兔血清发生特异性反应,具有很好的反应原性。
微小隐孢子虫;类钙调蛋白基因;克隆;原核表达
隐孢子虫(Cryptosporidiumspp.)是一种细胞内机会性致病原虫,广泛寄生于包括哺乳类、禽类、爬行类和鱼类动物在内的170多种物种。在已经得到公认的20余种隐孢子虫种中[1],对婴幼儿和免疫功能低下或缺陷者危害最大的是微小隐孢子虫(Cryptosporidiumparvum)。
钙离子(Ca2+)作为一种重要的第二信使,可引起细胞内多种特异性反应应答,参与多种细胞活动。Ca2+要将信号传递下去,其下游的感受器是极其重要的。钙调蛋白(calmodulin proteins, CaM)是广泛存在于各种真核生物中的多功能蛋白,为Ca2+的受体蛋白,对生物体内多种Ca2+依赖的细胞功能和酶体系都有重要的调节作用[2]。在弓形虫中,Ca2+/CaM基本上参与了包括弓形虫自身运动、黏附宿主细胞、穿透、内在化、细胞内复制,甚至是由宿主细胞排出的全过程[3]。在微小隐孢子虫中,子孢子顶复器蛋白的释放需要依靠虫体细胞骨架和胞内Ca2+的参与,而子孢子顶复器蛋白的释放会影响子孢子侵袭宿主细胞[4]。CaM存在于脊椎和无脊椎、原生动物、植物各种组织的几乎所有真核细胞内。在脊椎动物中,CaM一般由148个氨基酸组成,相对分子质量约为16.7 ku,其序列在不同物种间高度保守。从外形上看,CaM形似哑铃,由两端的球状结构以及连接二者的长螺旋结构组成,其中球状的N末端和C末端分别由1对EF手性(EF-hands)构成,是结合Ca2+的结构域,因此,每个CaM都有4个Ca2+结合位点[5]。类钙调蛋白(calmodulin-like proteins, CML)与CaM具有相似的结构,也具有EF-hands结构域,研究CML对进一步了解生物体的生命活动机制具有重要意义。
在顶复门寄生虫中,对CML的研究报道很少,但在其他物种中有不少关于CML的报道。有文献报道[6],植物DNA病毒卫星抑制RNA沉默需要宿主CML抑制依赖于RNA的RNA聚合酶6(RNA-dependent RNA polymerase 6, RDR6)的表达。在拟南芥中,CML43在根尖的正常生长和植物免疫反应过程中发挥着Ca2+信号器的作用[7],而作为Ca2+信号器的CML39在促进幼苗发育的光信号转导过程中发挥着重要作用[8]。上皮特异性人钙调样蛋白(epithelial-specific human calmodulin-like protein, CALML3)在良性口腔黏膜细胞中高表达,但当口腔癌发生时,在浸润性癌细胞中CALML3的表达量呈显著下调趋势,这表明CALML3可能是口腔癌筛查新的敏感的标志物[9]。
本试验克隆了微小隐孢子虫CML基因,首次构建了其原核表达质粒,并进行了诱导表达与纯化,为研究隐孢子虫CML蛋白的特性与功能,观察其能否与Ca2+相互作用及作用机制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 载体、菌株、cDNA和血清 原核表达载体pGEX-6p-1由本实验室保存;克隆载体pMD18-T为宝生物工程(大连)有限公司产品;大肠埃希菌DH5α和BL21(DE3)为北京全式金生物技术有限公司产品;微小隐孢子虫卵囊cDNA、感染兔隐孢子虫(C.cuniculus)的兔阳性血清由本试验制备保存。
1.1.2 主要试剂 TaKaRa ExTaq、dNTP Mixture、限制性内切酶BamH Ⅰ和XhoⅠ、T4 DNA Ligase为宝生物工程(大连)有限公司产品;AxyPrep DNA凝胶回收试剂盒为Axygen公司产品;DNA Marker和蛋白Marker为Fermentas公司产品;胰蛋白胨、酵母提取物和脱脂奶粉为Oxoid公司产品;质粒小抽试剂盒为天根生化科技(北京)有限公司产品;辣根过氧化物酶标记的山羊抗兔IgG-HRP为ImB公司产品;过硫酸铵、30%丙烯胺酰胺为Bio-Bad公司产品;TEMED、SDS为Sigma公司产品;PVDF为GE Healthcare公司产品;High-Affinity GST·BindTMKits为Novagen公司产品; 20% IPTG为上海浩然生物技术有限公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank登录的微小隐孢子虫CML基因序列(登录号EAK87541)和表达载体pGEX-6p-1的酶切位点特性,应用Primer Premier 5.5软件设计一对特异性引物。在上游引物的5′端引入限制性内切酶BamH Ⅰ和保护性碱基序列,在下游引物的5′端引入限制性内切酶XhoⅠ和保护性碱基序列,其中上游引物CML F为:5′-CGCGGATCCATGTCAGAATCATCAAAT-3′(下划线处为BamH Ⅰ酶切位点);下游引物CML R为:5′-CCGCTCGAGTTACTAATTGAGAAGAGGT-3′(下划线处为XhoⅠ酶切位点)。
1.2.2 CML基因的扩增与克隆 以微小隐孢子虫卵囊cDNA为模板,利用CML F、CML R为引物扩增CML基因,其反应体系为:ddH2O 13 μL,10×PCR buffer(含Mg2+)2 μL,2.5 mmol/L dNTP Mixture 2 μL,TaKaRa ExTaq0.5 μL 100 μmol/L的CML F和CML R各0.25 μL,cDNA模板2 μL,总体积20 μL。反应条件为: 94 ℃ 8 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 7 min。PCR产物用12 g/L琼脂糖凝胶电泳后,用AxyPrep DNA凝胶回收试剂盒回收目的片段,连接到克隆载体pMD18-T上,转化到大肠埃希菌DH5α感受态细胞中。将经菌液PCR初步鉴定为阳性的克隆送上海英骏生物技术有限公司测序,鉴定正确后,提取重组质粒,命名为pMD-CML。
1.2.3 重组表达质粒的构建及鉴定 用BamH Ⅰ和XhoⅠ分别对pMD-CML重组质粒和pGEX-6p-1质粒进行双酶切,酶切产物经胶回收后,利用T4 DNA连接酶进行连接,连接产物转化DH5α感受态细胞。将转化后的菌液均匀涂布在含有氨苄青霉素的LB平板上,挑取单菌落,将经PCR、BamH Ⅰ和XhoⅠ双酶切鉴定为阳性的克隆送上海英骏生物技术有限公司测序。序列正确后,提取重组表达质粒,命名为pGEX-CML。
1.2.4 重组表达质粒的诱导表达与纯化 将重组表达质粒pGEX-CML转化到大肠埃希菌BL21(DE3)感受态细胞中,加入终浓度为1 mmol/L的IPTG,37 ℃诱导表达6 h,对表达产物进行SDS-PAGE分析。将表达菌超声破碎后进行离心,取上清,利用High-Affinity GST·BindTMKits进行纯化,用SDS-PAGE分析蛋白的纯度。
1.2.5 重组蛋白的Western blot分析 将纯化的重组蛋白进行SDS-PAGE分析,采用半干转印法将凝胶上的蛋白转印到PVDF膜上。经50 g/L脱脂奶粉封闭后,以感染C.cuniculus的兔阳性血清为一抗(1∶400),以辣根过氧化物酶标记的山羊抗兔IgG为二抗(1∶2 000稀释),对重组蛋白进行Western blot分析。
2 结果
2.1 CML基因的扩增
琼脂糖凝胶电泳结果显示,在大小约为660 bp处有一特异性扩增条带(图1),与预期663 bp大小相符。
2.2 重组质粒pMD-CML的鉴定
使用限制性内切酶BamH Ⅰ和XhoⅠ对重组质粒pMD-CML进行双酶切,得到与预期大小相符的663 bp和2 692 bp片段(图2)。将插入基因测序结果在NCBI上进行Blast搜索,结果显示该序列与GenBank登录的微小隐孢子虫Iowa type Ⅱ分离株CML基因序列的一致性为100%。
2.3 重组原核表达质粒pGEX-CML的鉴定
使用BamH Ⅰ和XhoⅠ对重组质粒pGEX-CML进行双酶切,得到大小分别为4 900 bp和663 bp的2条清晰的条带(图3),与预期大小相符。序列测定结果显示没有发生碱基突变,且插入方向正确。

图1 微小隐孢子虫CML基因的PCR扩增Fig.1 PCR amplification of Cryptosporidium parvum CML gene

图2 重组质粒pMD-CML酶切产物的电泳鉴定Fig.2 The electrophoresis identification of recombinant plasmids pMD-CML digested with restriction enzymes

图3 重组质粒pGEX-CML酶切产物的电泳鉴定Fig.3 The electrophoresis identification of recombinant plasmids pGEX-CML digested with restriction enzymes
2.4 重组质粒pGEX-CML的诱导表达及表达产物的纯化
重组原核表达质粒pGEX-CML转化菌经浓度为1.0 mmol/L IPTG诱导6 h,SDS-PAGE分析发现6株pGEX-CML转化菌均高效表达出了重组CML蛋白(recombinant CML, rCML),大小约为51 ku,不同菌株间的表达量差别不大;表达时相结果表明重组质粒pGEX-CML转化菌诱导表达超过6 h后,重组蛋白表达量几乎不再增加;表达形式检测结果说明,重组蛋白rCML以可溶性和包涵体两种形式存在(图4);表达产物经High-Affinity GST·Bind Resin纯化后,得到了较纯的重组蛋白rCML(图4)。
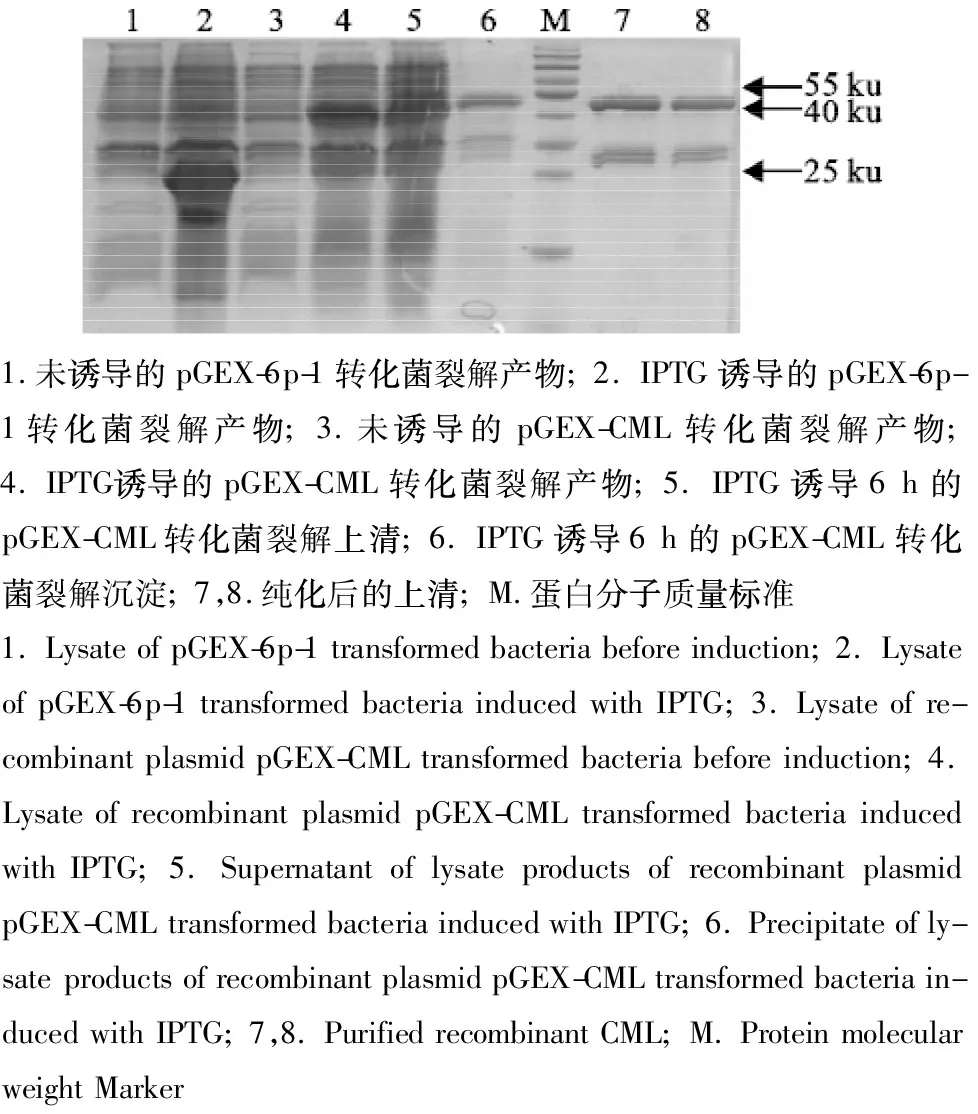
图4 重组质粒pGEX-CML转化菌表达及纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of pGEX-CML transformed bacteria expression products and purified recombinant CML proteins
2.5 重组蛋白rCML的Western blot分析
Western blot 结果显示,在分子质量约为51 ku的位置出现一个条带,而IPTG诱导的pGEX-6p-1转化菌在此位置没有出现相应条带(图5),表明纯化的目的蛋白能被感染C.cuniculus的兔血清特异性识别。

图5 纯化重组蛋白的Western blot分析Fig.5 Western blot analysis of purified recombinant CML protein
3 讨论
Ca2+在顶复门寄生虫的移行、侵袭和调节过程中发挥着重要作用。有研究证明,CaM可与恶性疟原虫蛋白激酶B(Plasmodiumfalciparumprotein kinase B,PfPKB)的N端发生相互作用,进而提高依赖磷酸化的激活作用,而胞内的Ca2+对Ca2+/calmodulin-PfPKB信号通路的激活是必要的,且能被虫体内储存的磷脂酶C(phospholipase C)所调节,最终,CaM与Ca2+在恶性疟原虫侵袭细胞的过程中发挥着重要的作用[10]。而关于微小隐孢子虫CML的报道很少,其特性和功能并不清楚,但它具有EF-hands结构域,具备与CaM相似的结构[11]。要研究CML的特性和功能,观察其能否与Ca2+结合,进而调节细胞的多种反应,需要对CML基因进行体外表达,因此,开展微小隐孢子虫CML基因的原核表达和重组蛋白的纯化是一项基础性工作,具有重要意义。
要获得具有表达水平高、可溶性表达和易于纯化的蛋白产物,选择一个合适的表达系统是很重要的环节。基因的表达系统主要包括真核和原核两大系统,但真核表达系统具有目的蛋白的表达水平低、费用高、周期长等缺点[12],所以本文选择原核表达系统,而原核表达系统主要为大肠埃希菌表达系统。
本试验采用pGEX-6p-1原核表达载体,它是一个高效表达载体,且该载体表达的重组蛋白含有GST[13],为后期使用High-Affinity GST·BindTMKits进行纯化提供了方便,然后通过构建pGEX-CML原核表达质粒,将其转化到大肠埃希菌BL21(DE3)感受态细胞,使用终浓度为1 mmol/L的IPTG进行诱导表达,菌体蛋白经SDS-PAGE分析表明,转化菌裂解产物的上清和沉淀都出现了明显区别于未诱导转化菌裂解物和诱导的空载体转化菌裂解物的蛋白条带,且上清和沉淀中的目的蛋白表达量都很大。由于上清中的目的蛋白是以可溶形式存在,有利于纯化,预期蛋白具有活性的可能较大,便于后续开展rCML与Ca2+相互作用研究,所以本试验选用了上清中的重组蛋白。经High-Affinity GST·Resin 亲和层析法对可溶表达的目的蛋白进行纯化,Western blot分析显示纯化的融合蛋白能被兔抗C.cuniculus血清识别,在分子质量约为51 ku处出现反应条带,与预期大小一致,而阴性对照没有相同的条带,表明rCML具有良好的反应原性,为下一步研究微小隐孢子虫CML的特性与功能,利用该蛋白及其编码基因开展隐孢子虫病的预防和治疗研究提供了基础。
[1] Fayer R. Taxonomy and species delimitation inCryptosporidium[J].Exp Parasitol,2010,124(1):90-97.
[2] 罗 梅,宾淑英,林进添.扶桑绵粉蚧钙调蛋白基因的原核表达与表达谱分析[J].西北农林科技大学学报:自然版,2013,41(12):138-142.
[3] Kieschnick H, Wakefield T, Narducci C A, et al.Toxoplasmagondiiattachment to host cells is regulated by a calmodulin-like domain protein kinase[J].J Biol Chem,2001,276(15):12369-12377.
[4] Chen X M, O'Hara S P, Huang B Q, et al. Apical organelle discharge byCryptosporidiumparvumis temperature, cytoskeleton, and intracellular calcium dependent and required for host cell invasion[J].Infect Immun,2004,72(12):6806-6816.
[5] 梁 婧, 张晓蓉, 许艳华.钙调蛋白的研究进展[J].临床口腔医学杂志,2010,26(8):500-501.
[6] Li F, Huang C, Li Z, et al. Suppression of RNA silencing by a plant DNA virus satellite requires a host calmodulin-like protein to repress RDR6 expression[J].PLoS Pathog,2014,10(2):e1003921.
[7] Bender K W, Dobney S, Ogunrinde A, et al. The calmodulin-like protein CML43 functions as a salicylic-acid-inducible root-specific Ca2+sensor in Arabidopsis[J].Biochem J,2014,457(1):127-136.
[8] Bender K W, Rosenbaum D M, Vanderbeld B, et al. The Arabidopsis calmodulin-like protein, CML39, functions during early seedling establishment[J].Plant J,2013,76(4):634-647.
[9] Brooks M D, Bennett R D, Weaver A L, et al. Human calmodulin-like protein CALML3: A novel marker for normal oral squamous mucosa that is downregulated in malignant transformation[J].Int J Dent,2013:592843.
[10] Vaid A, Thomas D C, Sharma P. Role of Ca2+/calmodulin-PfPKB signaling pathway in erythrocyte invasion byPlasmodiumfalciparum[J].J Biol Chem,2008,283(9):5589-5597.
[11] 杨晓娇,周 鹏,米荣升,等.微小隐孢子虫类钙调蛋白基因真核表达质粒的构建及在Hela细胞中的表达[J].中国兽医科学,2014,44(5):485-491.
[12] 李 杰,李前瑞,田婷婷,等.羊口疮病毒BL21和VIR基因原核表达及抗原性鉴定[J].动物医学进展,2013,34(3):1-6.
[13] 王 聪,张洪亮,黄 娟,等.水貂犬瘟热病毒受体SLAM的原核表达[J].动物医学进展,2013,34(2):68-71.
Cloning and Prokaryotic Expression ofC.parvumCalmodulin-like Protein Gene
YANG Xiao-jiao1,ZHOU Peng1,MI Rong-sheng1,HUANG Yan1,SHI Kai1,2,WANG Xiao-juan1,3,WANG Xiang-pei1,3,LIU Yu-xuan1,LEI Xiao-si1,2,CHEN Zhao-guo1
(1.LaboratoryofQualityandSafetyRiskAssessmentforAnimalProducts(Shanghai),MinistryofAgriculture,KeyLaboratoryofAnimalParasitology,MinistryofAgriculture,ShanghaiVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Shanghai,200241,China; 2.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Ya'an,Sichuan,625014,China; 3.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun,Jilin,130118,China)
In order to expressCryptosporidiumparvumcalmodulin-like protein (CML) gene inE.coliBL21(DE3) and analyze the antigenicity of the recombinant protein, CML gene was amplified by PCR with cDNA ofC.parvumoocysts. The amplified CML gene was cloned into pMD18-T vector and the DNA of recombinant pMD-CML plasmid was extracted. The plasmid was digested with double enzymes and the objective fragments were connected with pGEX-6p-1 which had been digested with same enzymes. After identifying by double restrict enzyme digestion and gene sequence analysis, the recombinant plasmids were transformed toE.coliBL21(DE3) cells and the transformed bacteria was induced to express with IPTG. Recombinant proteins were purified by High-Affinity GST·Bind Resin affinity chromatography. Antigenicity of the recombinant proteins was analyzed by Western blot. The results showed that the prokaryotic expression vector pGEX-CML was constructed successfully and an approximate 51 ku recombinant protein rCML was expressed successfully after inducing with IPTG. The purified recombinant protein could be recognized specifically by the sera from rabbit infected withC.cuniculus.
Cryptosporidiumparvum;calmodulin-like protein gene;cloning;prokaryotic expression
2014-05-03
国家科技重大专项项目(2012ZX10004220);中央级公益性科研院所基本科研业务费专项资金项目(2013JB13);家畜疫病病原生物学国家重点实验室开放基金课题(SKLVEB2013KFKT017);上海市科技兴农重点攻关项目[沪农科攻字(2005)第3-4号]
杨晓娇(1987-),女,河南夏邑人,硕士研究生,主要从事寄生虫分子生物学研究。*
S852.723;Q785
:A
:1007-5038(2015)01-0026-05
