稀土镁合金在生物医用材料领域的研究进展*
2015-03-06冯晓伟黎小辉戚文军李志成
冯晓伟,黎小辉,戚文军,李志成
1.广东省工业技术研究院(广州有色金属研究院),广东 广州 510650;2.中南大学材料科学与工程学院,湖南 长沙 410083
稀土镁合金在生物医用材料领域的研究进展*
冯晓伟1,2,黎小辉1,戚文军1,李志成2
1.广东省工业技术研究院(广州有色金属研究院),广东 广州 510650;2.中南大学材料科学与工程学院,湖南 长沙 410083
由于镁合金具有与人体骨接近的密度和弹性模量,再加上其生物可降解性及良好的生物相容性,因此,近年来受到了国内外广大科研工作者的极大关注.本文评述了添加稀土元素对镁合金的力学性能及腐蚀行为的影响,介绍了生物医用镁合金的降解特性及表面处理方法,并展望了可降解生物医用镁合金的应用前景和发展方向.
生物医用镁合金;生物降解;生物相容性;稀土元素
由于镁合金具有与人体骨相近的密度和弹性模量等诸多优良的力学性能,近年来已成为生物医用材料领域研究的热点之一.目前,金属骨植入材料都是不可降解的不锈钢或钛合金,当骨折患者的骨骼愈合后,需要进行二次手术将其取出,增加了患者的痛苦和经济负担.镁合金作为可降解骨植入材料的诱人前景已经引起了国内外学者的广泛关注[1-3].与目前临床正使用的各种金属植入材料相比,镁合金作为硬组织植入材料具有以下特点:(1)安全性:镁是人体内含量仅次于钙、钠和钾的常量元素,参与体内一系列新陈代谢过程,可促进新骨组织的生长,成人体内约1 mol的镁,其中近1/2储存在骨骼组织中.过量的镁可通过尿液排出体外,因此,镁以一定速率降解时不会对人体产生不良影响.(2)生物学特性:镁是一种能激活多种酶的重要元素,镁离子可催化或激活体内300多种酶,完成体内多种代谢过程,并在维持钾离子平衡方面起着重要的作用.镁还是能量转运、贮存和利用的关键元素,能调节RNA和DNA结构.因此,镁对于调节细胞的生长和维持膜结构有重要作用[4].(3)可降解性:镁具有很低的标准电极电位,在含氯离子的溶液中(如人体体液)易生成镁离子被周围机体组织吸收或通过尿液排出体外,因此,镁可以被人体体液完全降解.(4)力学相容性:常用的硬组织植入材料的物理性质与力学性能见表1,由表1可知,镁合金密度与人的骨密度相当,且具有很高的比强度和比刚度,镁合金的弹性模量为41~45 GPa,与其它植入材料相比更接近人体骨.
表1 常用硬组织植入材料的物理性质与力学性能对比
Table 1 Physical properties and mechanical properties of common hard tissue implant materials in comparison with those of human bone

植入材料密度/(g·cm-3)弹性模量/GPa压缩强度/MPa断裂韧性/MPa人体骨1.8~2.13~20130~1803~6镁合金1.74~1.9041~4565~10015~40钛合金4.4~4.5110~117758~111755~115钴-铬合金8.3~9.2230450~1000—不锈钢7.9~8.1189~205170~31050~200羟基磷灰石(HA)3.142~103400~9700.7
生物医用镁合金的不足之处:由于镁的化学性质极为活泼(标准电位为-2.37 V),并且在腐蚀介质中产生的氧化膜疏松多孔(PBR=0.8),导致镁及镁合金的耐蚀性较差,尤其是在含Cl-的人体生理环境中更是如此.镁合金在人体内的腐蚀一般为非均匀腐蚀,降解速度较快,通过合金化、加工工艺、表面改性等方法控制镁合金在人体中的降解速度对其作为人体植入材料的实际应用至关重要.镁属密排六方结构,常温下塑性和韧性较差,Biotronik公司的镁合金心血管支架结构有限元模型的分析结果表明,在心血管支架扩张过程中最大应变值达到20%,超过了目前商用镁合金的最大延伸率.Erinc等人[5]提出了一整套镁合金作为可降解骨科植入材料的性能标准:(1)在37 ℃模拟体液中的腐蚀速率应小于0.5 mm/a,保证有效服役期在90~180 d;(2)室温屈服强度高于200 MPa,伸长率大于10%(骨板等内固定受力件);而对于心血管支架材料,则要求更高的塑性与中等强度匹配,如伸长率大于20%,室温屈服强度高于200 MPa.因此,必须从合金材料的成分设计、塑性加工与成型工艺、微观组织及析出相分布等方面的综合调控,来实现镁合金降解行为的均匀可控.
1 稀土元素对生物医用镁合金的组织和力学性能的影响
稀土元素(RE)不仅可以提高合金的力学性能,还可以通过改变腐蚀层结构、强化阴极相控制、影响腐蚀的电化学过程,从而提高合金的抗腐蚀性能.Y,Nd及Gd等在镁中具有较大的极限固溶度,加入这些元素,可以对镁合金起到很好的固溶强化作用.一般而言,将稀土元素作为合金化元素加入,会促进Mg12RE,Mg3RE和Mg2RE金属间化合物的形成[6],这些金属间化合物使镁合金电偶腐蚀过程中阴极性减弱,降低了镁合金的微电偶腐蚀[7].稀土元素的存在也改善了表面膜和腐蚀层的结构和组成,抑制了腐蚀的进行.稀土镁合金主要分为:Mg-Al-RE系、Mg-RE-Zr系、Mg-Y-RE系、Mg-Sc、Mg-Gd、Mg-Dy及Mg-Sm系等.目前,欧洲已进入人体临床研究的心血管支架是以稀土镁合金WE43为基础进行开发的[8],国内开发的稀土镁合金有Mg-Zn-RE(Y[9]、Gd[10]、Dy)、JDBM[11]及Mg-Zn-Ca-RE等多个系列.
Yang等人[12-13]系统地研究了Mg-xDy(x=5,10,15,20)合金的力学性能和耐腐蚀性能.研究结果表明,Mg-10Dy具有中等拉伸和压缩屈服强度,并具有良好的塑性和耐腐蚀性.经固溶处理可使Dy在镁合金中的分布更加均匀,降低拉伸和压缩屈服强度,而塑性保持不变,并可极大地提高合金的耐腐蚀性能.在200 ℃下时效处理后,合金的屈服强度明显增强,塑性下降,生成的β′纳米相粒子可以增强合金的耐蚀性.
Hort等人[10]从Mg-RE二元合金出发,系统地研究了稀土元素的添加量与合金的微观组织和力学性能的关系,结果表明,由于Gd在镁合金中有很大的溶解度,添加Gd可对合金产生很好的固溶强化效果和可热处理性.随着Gd元素添加量的增加,固溶强化对合金强度的贡献显著增强.此外,在凝固和热处理过程中所形成的金属间化合物粒子对合金的力学性能也有一定程度的影响.
Castellani等人[14]研究了可降解的Mg-Y-Nd-HRE镁合金在动物体内骨/植入体界面的结合强度,评价了可降解镁合金在生物体内的固定效果.研究发现,在每个时间点(4~24周),可降解镁合金植入体的最大拔出力、剪切强度等指标均优于钛合金植入体,CT扫描显示,镁合金周围有更多的骨组织与植入体结合,且没有发现排异反应,这说明可降解镁合金比钛合金具有更好的骨/植入体界面结合强度及成骨能力.
2 稀土生物医用镁合金的可降解性能
生物镁合金作为可降解的硬组织修复植入体,在植入人体后,至少需要稳定存在十二周以上,让组织有充分的时间进行生长和愈合.由于镁的标准电位较低,化学性质活泼,表面形成的氧化物膜疏松多孔,不能对基体形成有效保护.根据PB(Pilling-Bedworth)原理,氧化过程中形成的氧化物膜的体积VMO(Volume Metal Oxide)大于生成这些氧化物膜所消耗的金属的体积VM时,生成的氧化物膜对基体金属才具有保护作用,而镁合金表面形成的氧化物膜(MgO)的PB比为0.84<1,因此,不能形成有效稳定的保护膜.
人体的体液是由有机酸、金属离子、阴离子以及蛋白质、酶和细胞等构成的复杂的电解质环境,pH值7.35~7.45,温度37 ℃[15].由于镁的标准电极电位极低(-2.37 V),因此,很容易在这种电解质环境中发生电化学腐蚀,主要的电化学反应过程有[16]:
(1)
阳极反应:
(2)
阴极反应:
(3)
腐蚀产物形成:
(4)
(5)
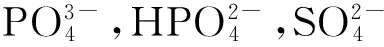
Witte[3]以聚乳酸为对照,考察了AZ31,AZ91,WE43以及自行开发的含4%Al,4%Li和2%RE(稀土的组成为51%Ce+22%La+16%Nd+8%Pu)的LAE442镁合金在动物体内的腐蚀行为和成骨反应.实验结果表明,所有埋植在豚鼠股骨髓内的镁合金棒都发生了生物降解反应.术后一周在镁合金棒周围观察到了皮下气泡,这些气泡在接下来的2~3周内逐渐消失,未观察到气泡对豚鼠有不利影响.实验观察到镁合金腐蚀层富含Ca和P,并与周围的骨组织直接接触.与参照组聚乳酸相比,镁合金棒周围呈现高的矿化附着速率和骨重量增加,将结果进行三维重构,发现18周后AZ91D合金基本降解,LAE442合金则保持较完整的外形.
Zhao等人[9]制备了Mg-Zn-Y-Zr合金,该合金中含有长周期有序结构组成相(LPSO).研究了LPSO的体积分数对其腐蚀速率的影响,发现高含量LPSO将加速腐蚀过程.作者提出了一种衡量降解速率的指标,即降解半衰期t0.5,降解半衰期t0.5提供了一种定量比较各种合金降解速率的可行参数.对于局部腐蚀而言,t0.5可用来衡量腐蚀电位和点蚀电位.与商业化的AZ31,WE43,ZK60和ZX60合金相比,Mg96.83Zn1Y2Zr0.17合金具有良好的力学性能,低的降解速率和良好的生物相容性.
3 稀土生物医用镁合金的表面改性
对镁及镁合金进行表面改性处理是使镁合金能够得到广泛应用最有力的方法.对镁及镁合金的表面处理主要是采用物理或化学方法在基体表面生成具有较强耐蚀性能的膜层而对基体加以防腐保护,从而达到提高和改善其耐蚀性能的目的.目前,已开发的镁合金表面处理方法较多,其中包括化学转化膜(通过发生化学反应或电化学反应,使基体金属的阳离子与溶液中的阴离子或原子结合,在金属表面形成一层薄膜)、碱热处理、阳极氧化(在适当的电解质溶液中,以待处理的金属为阳极,以不锈钢、铁、铬、镍或导电性溶液本身为阴极,在一定的电压和电流条件下,使阳极表面发生氧化,在金属表面获得阳极氧化膜层)、微弧氧化(在阳极氧化技术的基础上发展起来的表面陶瓷化技术,其实质是一种高电压氧化技术)和离子注入等.研究表明,通过在镁合金表面构筑生物活性涂层,不仅能提高其生物相容性,促使植入体与骨组织间形成直接的化学键结合,有利于植入体尽早稳定,缩短术后愈合期,而且可以延缓基体在体液中的腐蚀和降解速率.使用的涂层材料主要是生物活性陶瓷,也可以是生物活性聚合物,目前的研究主要集中在磷酸钙基生物陶瓷涂层上.
宗阳[11]采用微弧氧化和电脉冲化学沉积对Mg-3.0Nd-0.2Zn-0.4Zr(JDBM)镁合金进行表面改性,结果表明:经过电化学沉积羟基磷灰石(HA)涂层后的JDBM合金比未经表面处理的样品在模拟体液中的耐蚀性有了很大的提高.腐蚀产物以生物相容性较好的钙磷盐为主,表明涂层确实有良好的生物诱导作用.溶血实验结果表明,HA涂层能有效地提高JDBM合金的血液相容性.经过微弧氧化表面改性后的JDBM在Hank’s液中的耐蚀性能得到了一定的提高.但是由于微弧氧化涂层是多孔结构,不能有效地隔断JDBM基材与外部的腐蚀介质,只有通过在腐蚀介质中的初步腐蚀使微孔闭合,才能有效地提高试样在Hank’s液的耐腐蚀性能.F.Witte等人[20]研究了挤压态LAE442镁合金的裸合金及表面覆盖MgF2涂层的LAE442镁合金的体外降解速率.研究结果表明,MgF2涂层可有效降低镁合金的腐蚀速率,相邻骨骼中氟浓度没有升高,且没有皮下气泡出现,植入体与骨组织直接接触,无纤维胶囊,显示了MgF2涂层良好的耐蚀性和生物相容性.通过伽马射线检测发现,4周后MgF2涂层完全降解,6周后血液中合金元素含量减少.Rudd等人[21]采用Ce,La,Pr的硝酸盐对纯镁及WE43镁合金进行化学处理,在表面制备出稀土转化膜.将处理过的纯镁与WE43镁合金在pH=8.5的硼酸溶液中进行动态极化测试.结果表明,在Ce(NO3)3中处理5 min后的纯镁,阳极电流密度降低近100倍.在膜层浸泡实验的初期阶段腐蚀呈加剧的趋势,实验时间延长到10 h时,膜层的抗腐蚀性能提高了3倍.
4 结 语
可降解生物医用镁合金具有比强度和比刚度高以及与人体相匹配的力学性能特点,作为现有金属植入材料的替代品表现出巨大的优势和潜力,正成为生物医用材料研究的热点,引起了国内外同行们的广泛关注.由于人体环境的复杂性,不同的人体环境(如骨组织与心血管)对镁合金的要求不同,对生物医用镁合金材料各项性能的要求较高.此外,生物医用镁合金在人体内的降解速度以及降解过程中力学性能的动态变化均有待进一步深入研究,均匀腐蚀将有利于降解的可预期性,降解产物(磷化物、碳化物)对人体的影响也需深入探讨.随着研究的逐步深入,镁及镁合金作为生物医学植入材料在临床上将会得到更广泛的应用.
[1] STAIGER M P,PIETAK A M,HUADMAI J,et al. Magnesium and its alloys as orthopedic biomaterials:A Review[J].Biomaterials,2006,27:1728-1734.
[2] WITTE F.The history of biodegradable magnesium implants:A review[J].Acta Biomaterialia,2010,6:1680-1692.
[3] WITTE F,KAESE V,HAFERKAMP H, et al. In vivo corrosion of four magnesium alloys and the associated bone response[J]. Biomaterials,2005,26:3557-3563.
[4] WANG J Y,WICKLUND B H,GUSTILO R B,et al. Titanium, chromium and cobalt ions modulate the release of bone-associated cytokines by human monocytes/macrophages in vitro[J].Biomaterials,1996,17:2233-2240.
[5] ERINC M,SILLEKENS W H,MANNENS G,et al.Applicability of existing magnesium alloys as biomedical implant materials[C].Magnesium Technology,New York:TMS, 2009:209-214.
[6] ROKLIN L L.Magnesium alloy containing rare-earth metals:Structures and properties[M]. London and New York:Taylor & Francis, 2002.
[7] 姚素娟,李旺兴,杨胜,等.钇对AZ91镁合金微观组织及腐蚀性能影响的研究[J].中国稀土学报,2007,25(3):329-333.
[8] 姜海英,艾红军.生物可降解镁合金植入材料的医用特征[J].中国组织工程研究与临床康复,2011,15(34):6411-6415.
[9] ZHAO X, SHI L L, XU J.Mg-Zn-Y alloys with long-period stacking ordered structure:In vitro assessments of biodegradation behavior[J].Materials Science and Engineering:C,2013,33:3627-3637.
[10] HORT N, HUANG Y, FECHNER D, et al. Magnesium alloys as implant materials:Principles of property design for Mg-RE alloys[J]. Acta Biomaterialia,2010, 6:1714-1725.
[11] 宗阳.可降解骨内植入材料用镁合金JDBM表面改性的研究[D].上海:上海交通大学,2011.
[12] YANG Lei, HUANG Yuanding, PENG Qiuming. Mechanical and corrosion properties of binary Mg-Dy alloys for medical applications[J]. Materials Science and Engineering:B,2011,176:1827-1834.
[13] YANG Lei, HUANG Yuanding, FEYERABEND F, et al. Influence of ageing treatment on microstructure, mechanical and bio-corrosion properties of Mg-Dy alloys[J].Journal of the Mechanical Behavior of Biomedical Materials,2012,13:36-44.
[14] CASTELLANI C, LINDTNER R A, HAUSBRANDT P,et al. Bone-implant interface strength and osseointegration: Biodegradable magnesium alloy versus standard titanium control[J].Acta Biomaterialia,2011,7:432-440.
[15] 王猛,刘成龙,张春艳.蛋白质作用下医用金属材料的腐蚀行为研究进展[J].中国腐蚀与防腐学报,2011,31(1):10-18.
[16] 王勇,高家诚,张艳.纯镁在模拟体液中的腐蚀机理[J].中国有色金属学报,2007,17(12):1982-1984.
[17] 张汉茹,郝远.AZ91D镁合金在含Cl-溶液中腐蚀机理的研究[J].铸造设备研究,2007(3):19-24.
[18] YANG L,ZHANG E L.Biocorrosion behavior of magnesium alloy in different simulated fluids for biomedical application[J].Materials Science and Engineering:C,2009,29:1691-1696.
[19] XIN Y C, HUO K F, TAO H. Influence of aggressive ions on the degradation behavior of biomedical magnesium alloy in physiological environment[J].Acta Biomaterialia,2008,4:2008-2015.
[20] WITTE F, FISCHER J, NELLESEN J,et al. In vivo corrosion and corrosion protection of magnesium alloy LAE442[J].Acta Biomaterialia,2010,6:1792-1799.
[21] RUDD A L,BRESLIN C B,MANSFELD F.The corrosion protection afforded by rare earth conversion coatings applied to magnesium[J].Corrosion Science,2000,42(2):275-288.
Progress in rare earth Mg alloys for biomedical materials field
FENG Xiaowei1,2, LI Xiaohui2, QI Wenjun2, LI Zhicheng1
1.CollegeofMaterialsScienceandEngineering,CentralSouthUniversity,Changsha410083,China; 2.GuangdongGeneralResearchInstituteforIndustrialTechnology(GuangzhouResearchInstituteofNon-ferrousMetals),Guangzhou510650,China
Recent years has witnessed worldwide researchers’ great attention to Mg alloys, due to their excellent properties, such as biodegradation and good biocompatibility as well as density and elastic modulus comparable to those of human bone. The paper is a review of effect of rare earth (RE) elements addition on mechanical properties and corrosion behavior of Mg alloys, with an introduction to the degradation characteristics of and surface treatments for biomedical Mg alloys. Finally, an outlook for application prospects and direction of the biodegradable biomedical Mg alloys is shown.
biomedical Mg alloys; biodegradation; biocompatibility; rare earth elements
2014-08-19
广东省中国科学院全面战略合作项目(2011A090100004);广东省产学研重大项目(2010A090200078);天河区科技攻关项目(201406YG069)
冯晓伟(1990-),男,山东潍坊人,硕士研究生.
1673-9981(2015)01-0001-05
TG146.22
A
