Pin1抑制剂胡桃醌对乳腺癌细胞株MCF7Adr增殖、迁移及血管新生能力的影响
2015-03-04王红
王 红
(荆州市妇幼保健院药剂科,湖北 荆州 434020)
Pin1抑制剂胡桃醌对乳腺癌细胞株MCF7Adr增殖、迁移及血管新生能力的影响
王红
(荆州市妇幼保健院药剂科,湖北 荆州 434020)
摘要:目的研究Pin1抑制剂胡桃醌对乳腺癌细胞株MCF7Adr增殖、迁移及血管新生能力的影响。方法培养乳腺癌细胞株MCF7Adr,分别用不含药物的DMEM(对照组)、Pin1抑制剂胡桃醌处理(处理组),采用流式细胞法检测细胞周期、划痕实验检测细胞的迁移能力、Western-blot检测Cyclin E的蛋白含量、酶联免疫吸附法检测细胞上清液中血管内皮生长因子(VEGF)的水平。结果处理组的G2/M期比例高于对照组(t=21.848,P<0.01),G0/G1比例、S期比例低于对照组(t=6.234,6.658,均P<0.05),Cyclin E蛋白含量、(A0-A24)/A0值低于对照组(t=17.586,26.679,均P<0.01),处理组细胞的上清液中VEGFA、VEGFB、VEGFC水平低于对照组(t=15.237,13.894,16.382,均P<0.01)。结论Pin1抑制剂胡桃醌能有效抑制乳腺癌细胞株MCF7Adr的增殖、迁移和血管新生能力,Pin1抑制剂可作为乳腺癌治疗的备选药物。
关键词:乳腺癌;Pin1抑制剂;细胞周期;血管新生
Pin1(Peptidyl-Prolyl Cis/Trans Isomerase NIMA-interating)是一类在恶性肿瘤形成过程中发挥重要作用的肽脯氨酰顺反异构酶,也是近年来发现的恶性肿瘤治疗靶点。胡桃醌(Juglone)是从胡桃楸的新鲜根皮、枝皮、青果皮中分离出来的羟基萘醌类化合物,是通过高通量筛选方法发现的第1个Pin1的抑制剂[1]。鼻咽癌、宫颈癌、食管癌的体外研究均证实了胡桃醌对恶性肿瘤的抑制作用[2-4]。乳腺癌是女性发病率最高的恶性肿瘤,在临床治疗时多采用手术切除、化疗、生物治疗等综合疗法。常规的化疗药物具有较强的不良反应,且容易产生抗药性,整体的化疗效果并不理想[5]。本研究主要分析Pin1抑制剂胡桃醌对乳腺癌细胞株MCF7Adr增殖、迁移及血管新生能力的影响,现报道如下。
1材料与方法
1.1材料乳腺癌细胞株MCF7Adr购于中科院细胞库;杜尔伯科极限必需培养基(Dulbecco minimum essential medium,DMEM)和胎牛血清均购于美国Sigma公司;抗体购买于英国Abcam公司;离心管和细胞培养板购于美国Corning公司;Pin1抑制剂胡桃醌购于美国Sigma公司。
1.2方法
1.2.1细胞培养方法冻存在液氮罐中的细胞取出后迅速投入37 ℃水浴锅中震荡,离心后重悬细胞并种在15 cm2的培养瓶中培养,当细胞铺满培养瓶底面80%~90%时进行传代处理,分别接种于培养瓶和12孔培养板中。培养瓶中的细胞用于下一次传代,而12孔培养板中的细胞用于药物处理。
1.2.2细胞处理方法当12孔培养板中的细胞铺满70%~80%时,将培养基换为不含胎牛血清的DMEM并处理24 h,使每孔细胞生长同步化,而后用不含药物的DMEM处理(对照组)、30 μmol/L 胡桃醌处理(处理组)。药物处理24 h后进行相关检测。
1.2.3细胞周期测定胰酶消化细胞后离心,用含有10%胎牛血清的PBS溶液300 μL重悬细胞,加入700 μL无水乙醇固定过夜,第2日离心并用PBS清洗2遍,而后用碘化丙啶染色,上流式细胞仪检测细胞周期指标。
1.2.4细胞迁移能力测定采用划痕实验测定迁移能力,方法如下:药物处理前用200 μL移液管头在细胞板的中央做一划痕,立即在显微镜下观察并拍照记录,设定为0 h;药物处理24 h再次在显微镜下观察并拍照记录,设定为24 h。用Image J软件对0 h和24 h的图像进行分析,计算划痕的面积并分别记录为A0和A24,代入(A0-A24)/A0求出细胞的迁移能力。令对照组细胞的迁移能力为100,求出处理组细胞迁移能力的相对值。
1.2.5Western-blot检测按照RIPA裂解液和苯甲基磺酰氟化物100∶1的比例配制裂解液,在细胞孔中加入60 μL后充分裂解细胞、提取蛋白,离心后取上清按每份10.4 μL分装,并在每管中加入上样缓冲液4 μL、二巯基苏糖醇1.6 μL,置于100 ℃变性10 min。蛋白变性时,配置4%的浓缩胶和10%的分离胶,待变性结束将样本加入点样孔中进行垂直电泳(90 V、20 min,120 V、80 min)和电转膜(100 V、90 min)。转膜完成后取出硝酸纤维素膜(NC膜)并用5%脱脂牛奶封闭过夜(4 ℃),第2日取出NC膜,用TBST(含有Tris-HCl,NaCl,tween20这3种物质的缓冲液)洗涤3遍,根据marker指示的蛋白位置裁剪NC膜,分别孵育Cyclin E、actin第一抗体,过夜后取出NC并膜置于TBST溶液中洗涤3遍,而后用辣根过氧化物酶标记的第二抗体进行孵育,1 h后再次用TBST洗涤3遍,最后进行显影。计算蛋白条带的灰度值,以目的基因的灰度值/内参actin灰度值作为蛋白含量,令空白对照组的蛋白含量作为100,计算处理组目的基因的蛋白含量。
1.2.6血管内皮生长因子(vascular endothelial growth factor A,VEGFA)检测收集药物处理过的细胞上清液,采用上海邦奕公式的酶联免疫吸附试剂盒A(货号DRE11354)、VEGFB(货号DRE10433)、VEGFC(货号DRE10430)检测VEGF不同亚型的水平。
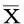
2结果
2.1细胞增殖情况处理组细胞的G0/G1比例为(34±7)%、S期比例(31±6)%,低于对照组的G0/G1比例(45±8)%、S期比例(45±9)%(t=6.234,P=0.018;t=6.658,P=0.015);处理组G2/M期比例为(36±6)%,高于对照组的G2/M期比例(10±3)%(t=21.848,P<0.01);处理组Cyclin E蛋白含量为(39±7)%,低于对照组的(100±23)%,差异有统计学意义(t=17.586,P<0.01)。见图1。
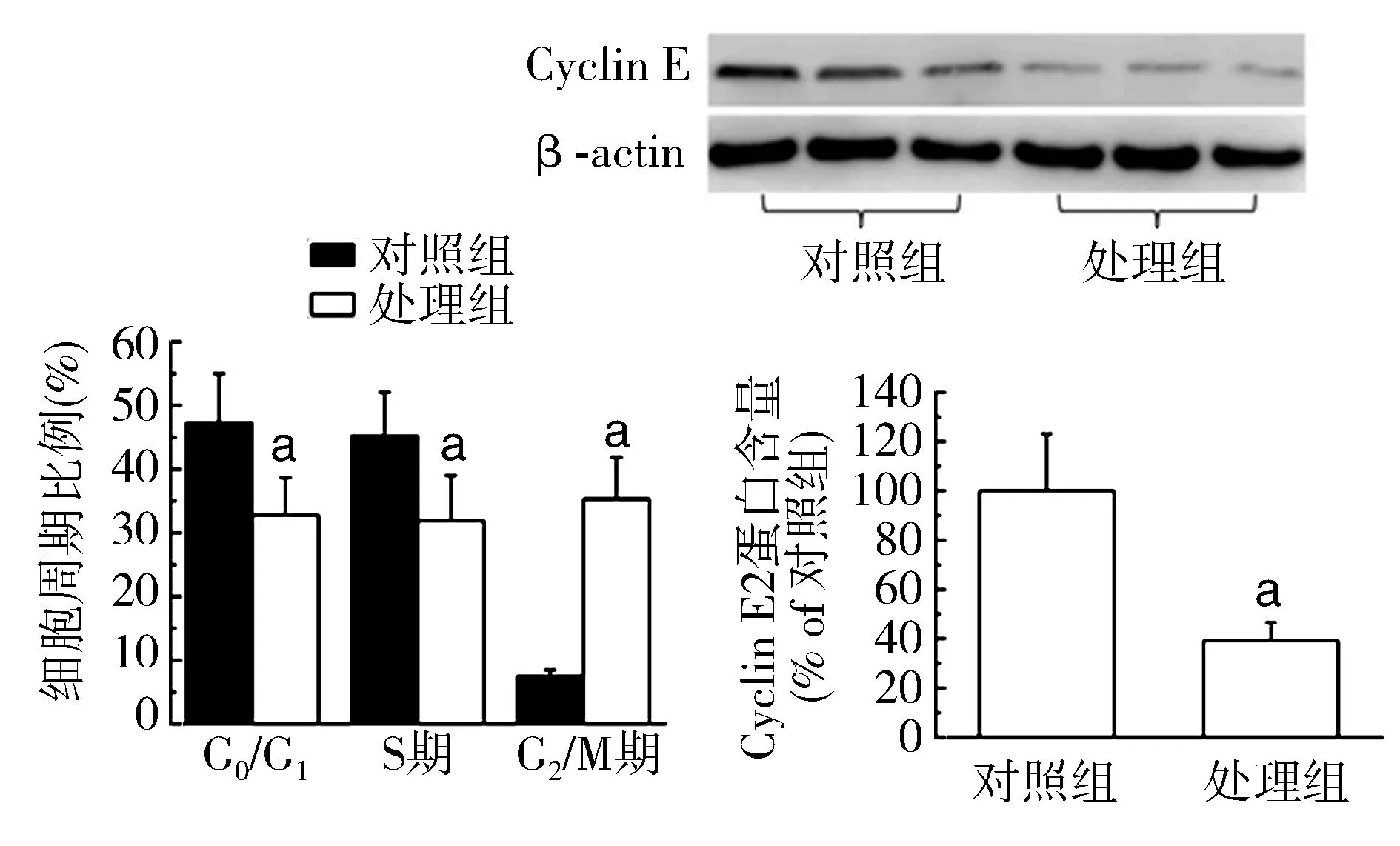
图1 不同处理条件下MCF7Adr细胞的细胞周期检测
2.2细胞迁移能力处理组的(A0-A24)/A0值为(25±4),低于对照组的(100±19),差异有统计学意义(t=26.679,P<0.01),见图2。
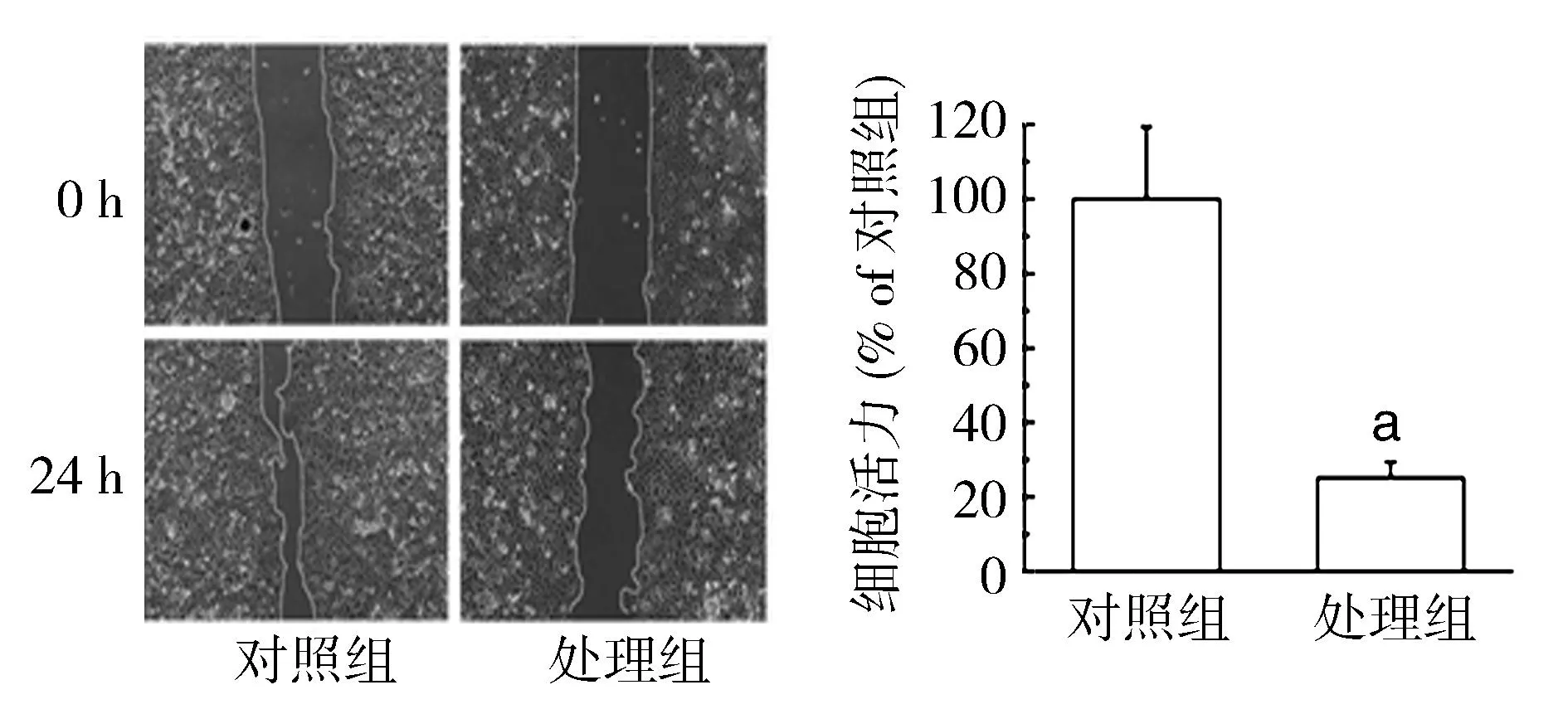
图2 不同处理条件下MCF7Adr细胞的迁移能力检测结果
2.3血管新生指标处理组的VEGFA、VEGFB、VEGFC水平低于对照组,差异有统计学意义(P<0.01),见表1。
表1两组细胞上清液中VEGF水平比较

(±s,ng/mg)
VEGF:血管内皮生长因子
3讨论
Pin1是一类肽脯氨酰顺反异构酶,能够特异性地识别磷酸化的丝/苏脯氨酰基序列,再由PPlase结构域使目标蛋白发生顺反异构反应,进而调节蛋白的生物学功能。近年来的研究发现,Pin1在食管癌、子宫内膜癌以及胃癌组织中均呈现高表达,且与疾病的预后情况密切相关[6-8]。c-Jun、c-myc、p53、核因子κB、Cyclin E等多种恶性肿瘤相关的蛋白均是Pin1的作用底物,Pin1高表达会激活肿瘤细胞无限增殖、浸润性生长等恶性生物学行为的产生,而Pin1选择性的抑制剂和siRNA均可以有效地抑制肿瘤生长。胡桃醌是通过高通量筛选方法发现的第一个Pin1的抑制剂,从胡桃楸的新鲜根皮、枝皮、青果皮中分离出来,对肽酰-脯氨酰同分异构酶家族成员均具有不可逆的抑制作用。目前,在鼻咽癌、宫颈癌、食道癌样本中进行的体外研究均证实了胡桃醌可以抑制恶性肿瘤细胞的增殖[9-10];而周金华等[11]在乳腺癌MCF-7细胞株中的研究显示,通过反义核酸敲低Pin1的表达后可以阻断乳腺癌细胞的细胞周期,是乳腺癌基因治疗的潜在靶点。
本研究采用Pin1抑制剂胡桃醌来处理乳腺癌细胞株MCF7Adr,并从细胞增殖、迁移以及血管新生情况3个方面分析了胡桃醌对恶性肿瘤的抑制作用。乳腺癌发生局部复发和远处转移的根本原因在于恶性肿瘤细胞的无限增殖以及浸润性生长。本研究通过比较处理组和对照组之间的增殖能力和迁移能力来反映恶性肿瘤细胞的无限增殖以及浸润性生长情况。通过流失细胞术检测细胞周期可显示,Pin1抑制剂胡桃醌可以使细胞增殖停滞于G2期,表现为G2/M期的比例显著增加、而G0/G1期和S期的比例显著减少,说明Pin1抑制剂胡桃醌能抑制乳腺癌细胞的增殖过程。通过划痕实验的结果分析可知,处理组的(A0-A24)/A0值显著低于对照组,说明Pin1抑制剂胡桃醌能有效抑制乳腺癌细胞的迁移过程。
细胞的增殖过程受到一系列细胞周期蛋白的调控,不仅直接表现为G0期细胞数目增多,也与细胞迁移能力的增强、浸润性生长细胞数目的增多密切相关[11]。在众多细胞周期蛋白中,Cyclin E是体内一类十分重要的细胞周期蛋白,在细胞增殖的G1/S期表达,通过与细胞周期蛋白依赖性激酶2(cyclin-dependent kinase,CKD2)结合并形成Cyclin E-CKD2复合物,CKD2激活后可调节细胞由G1期向S期过渡[12]。在恶性肿瘤细胞中,Cyclin E过度表达可使CKD2持续性激活,并促进肿瘤细胞的不断增殖[13]。通过Western-blot的方法检测Cyclin E蛋白含量来反映乳腺癌细胞的增殖能力可知,处理组的Cyclin E蛋白含量低于对照组,进一步说明Pin1抑制剂胡桃醌能通过下调细胞周期蛋白Cyclin E来抑制细胞增殖的过程。
事实上,乳腺癌细胞无限增殖、浸润性生长等恶性生物学行为的完成依赖局部新生血管形成所提供的氧气和养分[14]。在这一过程中,瘤体周围新生血管的形成可以带来耗能过程所需要的氧气、葡萄糖等[15]。近年来的研究认为,恶性肿瘤瘤体本身具有极强的内分泌功能,可以产生大量的细胞因子来介导血管新生的过程,其中VEGF是目前为止已知作用最为明确的一类促血管新生细胞因子,其水平可以直接反映肿瘤细胞新生血管的能力[16-17]。在本研究所培养的MCF7Adr细胞株中,VEGF在合成后分泌进入细胞上清液进而发挥生物学作用,通过检测上清液中VEGF三种亚型的水平可知,处理组的VEGFA、VEGFB、VEGFC水平低于对照组,说明Pin1抑制剂胡桃醌能显著抑制乳腺癌细胞株MCF7Adr的血管新生能力。
综上所述,Pin1抑制剂胡桃醌能有效抑制乳腺癌细胞株MCF7Adr的增殖、迁移和血管新生能力,Pin1抑制剂可作为乳腺癌治疗的备选药物。
参考文献
[1]张崇敬,张志辉,徐柏玲,等.Pinl及其抑制剂的研究进展[J].药学学报,2008,43(1):9-17.
[2]崔平,李蓉,刘英霞,等.Juglone对人鼻咽癌细胞株CNE-2Z细胞增殖及细胞周期的抑制作用[J].山东医药,2012,52(16):7-9.
[3]李玲,陈平,连鸿凯,等.Pinl抑制剂Juglone对食管癌EC1细胞增殖的抑制作用[J].世界华人消化杂志,2010,18(11):1147-1151.
[4]张巍,李妍,吕士杰,等.不同浓度的胡桃醌对宫颈癌HeLa细胞的细胞毒作用研究[J].上海中医药杂志,2012,46(6):101-103.
[5]张宗林.采用含蔥环类药物对乳腺癌患者化疗中的心肌毒性影响[J].中国医药导刊,2013,15(8):1392-1393.
[6]谷博,吉庆春,赵富周,等.食管鳞状细胞癌组织中Pin和mTOR蛋白的表达[J].郑州大学学报:医学版,2012,47(2):150-152.
[7]白志刚,韩威,马雪梅,等.PIN1在胃癌组织中的表达及其预后意义[J].临床肿瘤学杂志,2012,17(5):448-491.
[8]田焱,张怡,禹晶晶,等.肽基脯氨酰顺反异构酶在子宫内膜癌组织中的表达及与PR蛋白的关系[J].南方医科大学学报,2013,33(9):1403-1406.
[9]Krishnan N,Titus MA,Thapar R.The prolyl isomerase pin1 regulates mRNA levels of genes with short half-lives by targeting specific RNA binding proteins[J].PLoS One,2014,9(1):e85427.
[10]Khanal P,Kim G,Lim SC,etal.Prolyl isomerase Pin1 negatively regulates the stability of SUV39H1 to promote tumorigenesis inbreast cancer[J].FASEB J,2013,27(11):4606-4618.
[11]周金华,朱涛,李红雨,等.PIN1反义核酸对乳腺癌MCF27细胞增殖及周期的影响[J].肿瘤防治研究,2007,34(12):917-920.
[12]Moore JD,Potter A.Pin1 inhibitors:Pitfalls,progress and cellular pharmacology[J].Bioorg Med Chem Lett,2013,23(15):4283-
4291.
[13]Rajbhandari P,Schalper KA,Solodin NM,etal.Pin1 modulates ERα levels in breast cancer through inhibition of phosphorylation-dependent ubiquitination and degradation[J].Oncogene,2014,33(11):1438-1447.
[14]Lucchetti C,Caligiuri I,Toffoli G,etal.The prolyl isomerase Pin1 acts synergistically with CDK2 to regulate the basal activity of estrogen receptor α in breast cancer[J].PLoS One,2013,8(2):e55355.
[15]Aluise CD,Rose K,Boiani M,etal.Peptidyl-prolyl cis/trans-isomerase A1 (Pin1) is a target for modification by lipid electrophiles[J].Chem Res Toxicol,2013,26(2):270-279.
[16]李佳宇,膝月峨,刘云明,等.血管内皮生长因子C及其受体表达与乳腺癌淋巴结转移的相关性研究[J].中国医药导刊,2007,9(4):331-334.
[17]蒙玉刚,梁春燕,曾雅畅.血管内皮生长因子A和C在宫颈癌血清中的表达及临床意义[J].中国医药导刊,2013,15(8):1392-1393.
《医学综述》荣获“RCCSE中国核心学术期刊(A-)”
在第四届《中国学术期刊评价研究报告 (武大版)(2015-2016) 》中,《医学综述》被评为“RCCSE中国核心学术期刊(A-)”。
Effect of Pin1 Inhibitor Juglone on Proliferation,Migration and Angiogenic Ability of Breast Cancer Cell Line MCF7AdrWANGHong.(DepartmentofPharmacy,JingzhouWomenandChildren′sHospital,Jingzhou434020,China)
Abstract:ObjectiveTo study the effects of Pin1 inhibitor Juglone on proliferation,migration and angiogenic ability of breast cancer cell line MCF7Adr.MethodsBreast cancer cell line MCF7Adr were cultured and separately treated with DMEM without drug(control group),and Pin1 inhibitor Juglone (treatment group).Cell cycle was detected by flow cytometry,cell migration was detected by wound-healing assay,Cyclin E protein content was detected by Western-blot,and angiogenesis factor vascular endothelial growth factor (VEGF) in cell media were detected by enzyme linked immunosorbent assay.ResultsG2/M phase percentage of the treatment group was higher than that of the control group(t=21.848,P<0.01);G0/G1percentage,S stage percentage of the treatment group were lower than those of the control group(t=6.234,6.658,P<0.05);Cyclin E protein content,(A0-A24)/A0 of the treatment group were lower than those of the control group(t=17.586,26.679,P<0.01); VEGFA,VEGFB,VEGFC content in cell media of the treatment group were lower than those of the control group(t=15.237,13.894,16.382,all P<0.01).ConclusionPin1 inhibitor Juglone can effectively inhibit proliferation,migration and angiogenic ability of breast cancer cell line MCF7Adr;Pin1 inhibitors can be used as an alternative drug therapy for breast cancer.
Key words:Breast cancer; Pin1 inhibitor; Cell cycle; Angiogenesis
收稿日期:2014-08-18修回日期:2014-12-30编辑:伊姗
doi:10.3969/j.issn.1006-2084.2015.13.055
中图分类号:R730
文献标识码:A
文章编号:1006-2084(2015)13-2445-03
