三峡库区水样中重金属含量及其对斑马鱼胚胎发育的毒性评价
2015-03-03郭勇勇华江环杨丽华周炳升
郭勇勇 华江环 杨丽华 周炳升
(中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072)
三峡库区水样中重金属含量及其对斑马鱼胚胎发育的毒性评价
郭勇勇 华江环 杨丽华 周炳升
(中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072)
三峡库区水体污染对库区鱼类生存的影响尚不明晰, 因此测试库区水体中污染物含量及其对鱼类早期发育的影响对于库区生态渔业的安全发展具重要意义。研究于三峡库区坝前段典型区域设置3个采样点,用ICP-MS分析了原水中13种重金属的含量, 并将斑马鱼胚胎暴露于纤维膜过滤后的水样中, 测试其内分泌及发育毒性效应。结果表明, 三峡库区水样中 13种重金属的浓度均低于地表水环境标准规定的限值, 且3号采样点重金属浓度普遍比1号和2号采样点高。经7d暴露后, 处理组和对照组中斑马鱼胚胎的孵化率、相对成活率和畸形率(畸形指标包括原肠胚终止、心跳/心率、脊柱畸形、心包囊水肿)均无明显差异; 但幼鱼体内生殖相关基因(如α型雌激素受体, 雄激素受体和芳香化酶)、甲状腺相关基因(如甲状腺激素受体、甲状腺激素释放激素、Ⅱ型脱碘酶)和神经发育相关基因(如α1微管蛋白、突触蛋白、生长相关蛋白)的转录水平较之对照组(曝气 24h的自来水)均显著下降。上述结果表明, 三峡库区水体中 13种重金属的含量仍处于较低水平, 且在此污染水平下不会对斑马鱼胚胎发育过程产生显著影响。此外, 污染水体导致的分子水平上的变化是否会引起鱼类生长发育过程中的长期影响尚有待进一步研究。
三峡库区; 重金属; 斑马鱼; 发育毒性
随着三峡水库进入正常运行阶段, 这一工程引发的环境问题成为政府和学术界关注的焦点。虽然国家大力实施节能减排政策, 但是由于库区上游制造业、采矿业、电力、化学原料生产和金属冶炼等工业产业比较集中, 再加上农药、化肥以及沿江城市废弃物等的大量排放, 给库区水环境带来严重的污染负荷[1,2]。重金属具有分布广泛、环境行为复杂、毒性效应阈值低和毒性效应大等特点, 因而其污染问题一直备受关注。我国专家学者对三峡水库建成前后重金属的含量、来源进行了系统的研究。结果表明, 三峡库区蓄水后水体中部分重金属污染呈加重的态势, 但随着蓄水时间的增长某些重金属含量又现出逐年降低的趋势[3,4]。因此三峡库区水环境中重金属污染水平需要长期持续的动态监测。环境中的重金属不仅很难被自然降解, 还可能在生物作用下转化为毒性更强的有机金属化合物, 并在水生生物体内富集放大, 最终随食物链进入人体。重金属可与生物体内的核酸、酶、维生素、激素等物质发生反应, 改变其化学结构和生物活性[5], 进而对遗传发育、内分泌以及中枢神经等多个系统的功能产生损害引发病变甚至死亡[6—8]。因此, 在掌握重金属污染水平的同时, 评价在现有污染水平下对鱼类健康的影响对于生态渔业的发展也十分有必要。
在实际水体中存在着多种污染物质, 不同污染物之间还存在着协同、拮抗和相加等相互影响, 因此针对单一污染物研究所得的毒性效应和风险往往不能真实反映实际环境污染的危害水平。水样的生物毒性监测可以弥补化学监测和单一污染物评价在目标物质选择上的不足, 有效评估水体污染引起的毒性效应和潜在生态风险, 因而被广泛应用[9,10]。鉴于目前关于三峡库区水质污染对鱼类潜在毒性效应和风险的研究数据仍然缺乏, 本研究在三峡库区坝前段典型区域设置采样点, 分析水样中重金属的含量水平, 并以早期发育阶段的斑马鱼为模型, 测试库区水样对鱼类的发育和健康存在的潜在危害, 评价在目前污染水平下库区水体对鱼类的安全性。
1 材料与方法
1.1 水样的采集及前处理
选择三峡库区坝前段秭归县干流(1号采样点)、典型库湾(2号采样点)、百岁溪(距大坝7.3 km) (3号采样点)等设置三个采样点。每个采样点用棕色采样瓶采集2.5 L 水样, 运回实验室后用0.7 μm孔径纤维膜过滤后低温保存, 使用前放置于培养箱内升温。
1.2 水样重金属分析
现场采集水样10 mL到20%硝酸浸泡过夜的塑料离心管中, 向其中加入一定量的高纯硝酸使其终浓度为 2%, 水样运回实验室后低温保存。利用ICP-MS (NexION300X, PerkinElmer, MA)测定采集水样中Cu、Zn、As、Cd、Cr、Mn、Co、Ni、Be、Pb、Ti、In和 Sb的浓度, 并以115In、103Rh为双内标校正系统。以上实验所用硝酸和盐酸均为优级纯,超纯水电阻率≥18.0 MΩ·cm。目标元素标样购自国家有色金属及电子材料分析测试中心。
1.3 斑马鱼的饲养及鱼卵的收集
斑马鱼成鱼饲养以及胚胎收集、喂养方法参照Shi等[11]的方法。斑马鱼 (野生型AB strain)在封闭式活性碳过滤循环水系统中饲养, 光照周期为 14h︰10h (光︰暗), 水温(28±0.5)℃。成鱼每日投喂丰年虫(Artemia nauplii)两次, 斑马鱼饲料一次。雄鱼和雌鱼以 2︰1的比例过夜混养, 次日早晨灯光刺激产卵。所产鱼卵以活性炭过滤水清洗剔除异物, 在解剖镜下挑选受精后 2h内发育正常的囊胚期鱼卵作为实验材料。
1.4 胚胎暴露实验
首先用刚孵出的斑马鱼幼鱼, 将水样梯度稀释后进行96h 急性毒性测试, 测试过程参照美国环境保护局制定的急性毒性标准方法[12]。在实验过程中,原液和稀释液暴露组与对照组相比均未发现明显的急性毒性。因此, 在以下实验中均采用原液暴露。
胚胎随机分配至 12个玻璃培养皿中, 置于(28±0.5)℃的生化培养箱中孵化。共设3个采样点和一个对照组(24h曝气后的自来水), 每组3个平行皿,每个培养皿装有50 mL暴露液和360颗卵。每天定时更换所有暴露液, 于倒置显微镜下观察记录胚胎的孵化、畸形(包括原肠胚终止、心跳/心率、脊柱畸形、心包囊水肿)和死亡情况, 并及时除去培养液中卵膜、死卵及脏物。
暴露周期为7d。在暴露结束后, 按下述方法统计一下指标:
胚胎孵化率=孵化的斑马鱼胚胎数量/总的斑马鱼胚胎数量
幼鱼存活率=成活的斑马鱼胚胎数量/总的斑马鱼胚胎数量
1.2.2 覆膜对啤酒大麦生长的影响测定 采用全膜覆盖种植方式,于2017年3月27日种植。用0.006mm厚规格的超薄膜,穴播,每带6行,行距15 cm,穴距8~10 cm,每穴7~8粒,播种量75 000穴/hm2,525万~600万粒/hm2,种植小区面积20 m2,设3个重复,以露地种植方式为对照(CK),7月上旬收获。
总畸形率=发生畸形的斑马鱼胚胎总数/总的斑马鱼胚胎数量
1.5 总RNA的提取
在暴露结束后, 用0.03%的MS-222 (Sigma, MO, USA)将幼鱼麻醉, 每组(3个平行)收集30条幼鱼于1.5 mL EP 管中, 以PBS (pH=7.4)清洗两次后冻存于液氮中, 抽提前加入1 mL Trizol (Invitrogen, CA, USA)试剂, 按照说明书提示的操作方法提取总RNA, 并以 DANase Ⅰ (TaKaRa, 大连, 中国)去除DNA污染。1.2% (质量体积比)琼脂糖凝胶电泳(0.5× TBE buffer, 150 V, 15min)检测 RNA完整性, UV-2000紫外/可见分光光度计(Unico, Dayton, USA)测定RNA浓度及纯度。
1.6 基因转录水平的测定
取1 μg总RNA进行反转录反应得到cDNA, 采用 SYBR® Green I染料法于 ABI 7300 PCR仪(Perkin-Elmer Applied Biosystems, USA)上对目标基因进行定量检测。反应体系均为 20 μL, 包括2×SYBR® Green master mix (Toyobo, Osaka, Japan) 10 μL, ROX Reference Dye (50×) 0.4 μL, 5 μmol/L正义和反义引物各 0.5 μL, cDNA 1 μL和 7.6 μL ddH2O。PCR反应程序为95℃预变性3min; 40个循环: 95℃变性30s, 58℃复性20s, 72℃延伸35s; 最后一个循环做熔解曲线: 95℃变性30s, 58℃复性20s, 72℃延伸35s。内参基因选择β-actin, 引物如下: 正义引物 5′-CGAGCAGGAGATGGGAACC-3′, 反义引物5′-CAACGGAAACGCTCATTGC-3′。各目标基因引物见表1。
所有样品的定量检测至少重复2次, 每次3个平行。以delta-delta Ct法计算目标基因mRNA的相对表达量。
1.7 数据处理与分析
数据的正态分布和方差齐性检验分别用 Kolmogorov-Smirnov和Levene’s tests 法进行。对于不符合检验条件的数据进行转换处理, 使其符合相关分析方法的分析条件。采用单因素方差分析(One-way ANOVA)分析对照组与各处理组之间的差异显著性水平。所有数据处理均采用 SPSS 13.0(SPSS, Chicago, IL, USA)软件实现。所有结果表示为算术平均值±标准误(mean±SEM)。当P<0.05时, 即认定为具有显著性差异; 当 P<0.01时, 则认定为差异极显著。作图使用GraphPad Prism 5.01 (GraphPad Software Inc., CA, USA)软件完成。
2 结果
表2列出了三个采样点水样中13种重金属的浓度, 从表中数据可以看出, 1号和2号采样点的水质污染情况相近但均轻于3号采样点。
2.2 三峡库区水样对斑马鱼胚胎发育的毒性效应
如表 3所示, 三峡库区各采样点水样暴露组胚胎幼鱼的死亡数与对照组相比均无显著性的增加。各组斑马鱼胚胎的死亡主要发生于受精后 24h内, 48h后死亡数量较少。暴露7d后, 三峡库区水样暴露组中斑马鱼胚胎的孵化率和总畸形率与对照组相比均无显著性差异(表3)。其中各暴露组8 hpf死亡样品中原肠胚终止约占50%, 24 hpf畸形率心跳停止︰原肠胚发育终止︰心包囊水肿总比例为2︰1︰1, 与对照组相比均无显著差异。

表1 定量PCR所用引物信息Tab. 1 Primers for q-RT-PCR
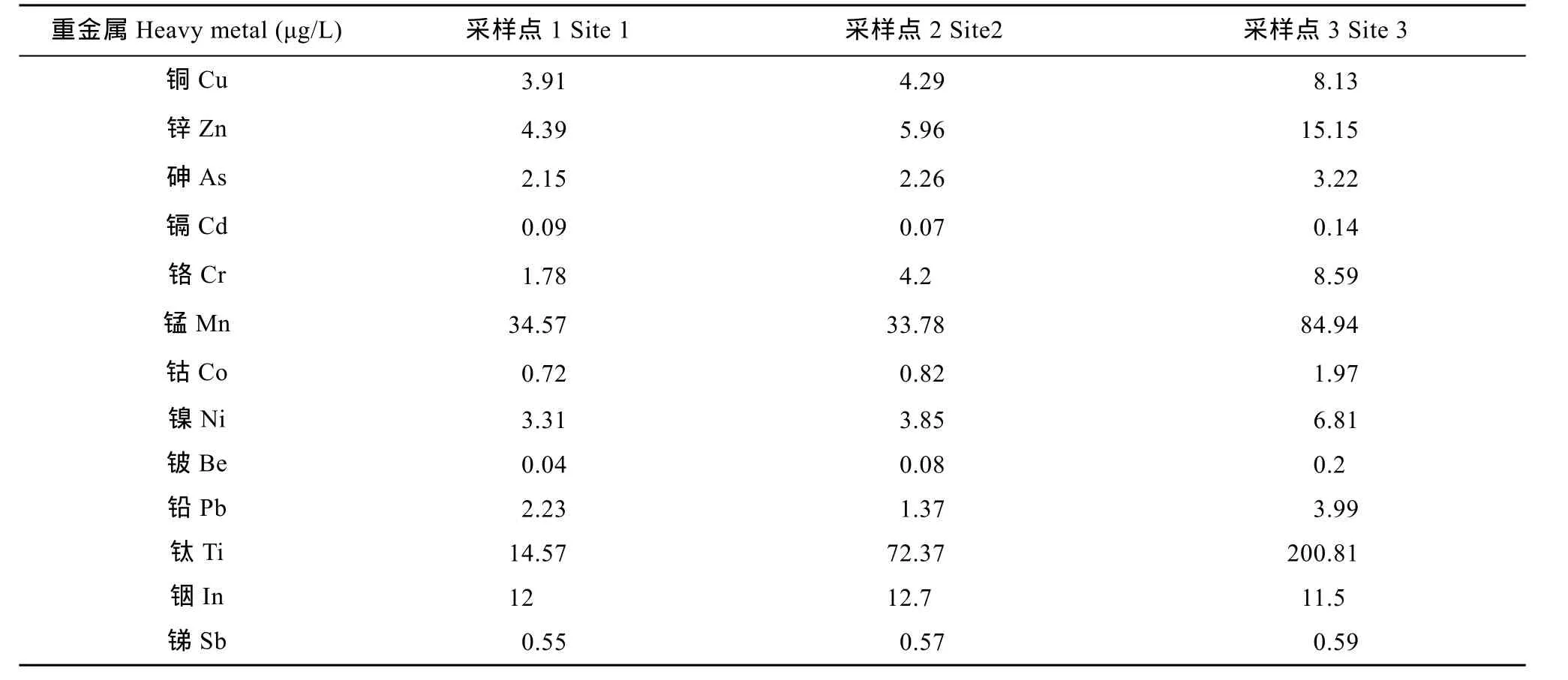
表2 三个采样点原水样中13种重金属的浓度Tab. 2 Concentrations of 13 heavy metals in water samples from the Three Gorges Reservoir Region
2.3 三峡库区水样对斑马鱼基因转录水平的影响
对暴露 7d后幼鱼体内生殖相关基因的转录水平进行检测。结果表明, 在暴露于采样点 1水样的幼鱼体内α型雌激素受体(er α)和雄激素受体(ar)基因的转录水平与对照组相比显著降低(P<0.05), 暴露于采样点3水样的幼鱼体内er α、ar和芳香化酶cyp19的转录水平与对照组相比显著降低(图1)。
对暴露 7d后幼鱼体内甲状腺相关基因的转录水平进行了定量检测。结果表明, 在暴露于采样点1水样的幼鱼体内脱碘酶(dio)基因的转录水平与对照组相比显著降低(P<0.05); 暴露于采样点 2水样的幼鱼体促甲状腺激素(tsh β)和甲状腺激素受体(tr α)基因的转录水平与对照组相比显著降低(P<0.05);暴露于采样点3水样的幼鱼体tsh β、tr α和dio基因的转录水平与对照组相比均显著降低(P<0.05)。
对暴露7d后幼鱼体内神经发育相关基因的转录水平进行了定量检测。结果表明, 早期生命阶段斑马鱼暴露于 3个采样点水样后, 体内 α1微管蛋白(α1-tubulin)、突触蛋白(syn2a)和生长相关蛋白(gap43)的转录与对照组相比均被显著抑制(P<0.05)。

表3 原水暴露对斑马鱼胚胎的毒性效应Tab. 3 Toxic effects of water samples from the Three Gorges Reservoir Region on zebrafish embryos

图1 三峡库区原水暴露对斑马鱼胚胎的生殖相关基因表达的影响Fig. 1 Effects on the transcription of reproduction-related genes in zebrafish larvae after the exposure to water samples

图2 三峡库区原水暴露对斑马鱼胚胎甲状腺相关基因表达的影响Fig. 2 Effects on the transcription of thyroid-related genes in zebrafish larvae after the exposure to water samples
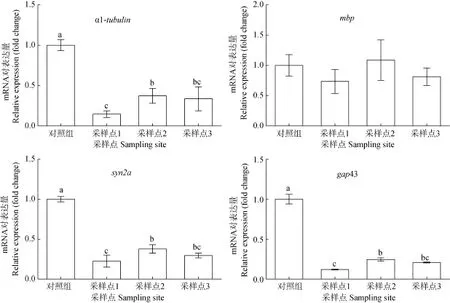
图3 库区原水暴露对斑马鱼胚胎的神经发育相关基因表达的影响Fig. 3 Effects on the transcription of neural development-related genes in zebrafish larvae after the exposure to water
3 讨论
本研究测定了三峡库区(干流、典型库湾、百岁溪)水体中 13种重金属的含量, 结果显示, 重金属铜、锌、砷、镉、铬、锰等含量符合地表水环境质量标准基本项目Ⅰ类标准(GB3838-2002)。钴、镍、铍、铅、钛、铟、锑等重金属的含量也均低于地表水环境质量标准限值。比较发现, 百岁溪水样中重金属的含量要高于干流和典型库湾的水样。
先前的研究表明斑马鱼胚胎毒性试验具有灵敏度高, 重复性好等优点, 能准确地用于评价表层水生物毒性的危害程度[13]。因此, 在本实验中选用斑马鱼胚胎发育来评估三峡库区原水样对鱼类的安全性。结果显示, 与对照组相比三峡库区 3个采样点原水暴露均未对斑马鱼胚胎发育(如孵化率、相对成活率、畸形率)产生不良影响, 提示三峡库区水中有毒物质所致的生态风险度目前还处于较低的水平。这一结果与水质监测结果相吻合, 先前的结果同样表明三峡库区水域未受到明显的重金属污染, 重金属含量低于国家环境相关标准的相应限值[14]。由于蓄水后三峡库区重点区域断面平均流速仅为建库前的 1/10左右, 水面变宽, 停留时间增长, 有毒物质扩散系数大大降低, 长期下去将会影响到污染物的降解与扩散, 造成有毒物质含量的上升[15]。有研究发现, 部分重金属(Cr、Zn、Pb)在三峡库区鱼类体内富集倍数超过 1000, 说明重金属通过食物链层次富集作用比较明显, 提示需进一步密切关注重金属在三峡库区水体的变化及其对鱼类的潜在风险[14]。
大量的生态毒理学研究表明, 在环境污染物胁迫下的生物损伤最先发生在基因水平上, 最终才在个体水平上反映出来。因而, 基因转录水平的改变在环境风险评价早期预警中显得非常重要[16—19]。鱼类的生殖活动受外部环境因素和神经内分泌的双重调节, 下丘脑、脑垂体和性腺通过相互调节, 促进和制约着鱼类生殖细胞的发生、性别分化和性腺发育成熟及其繁殖活动[20]。本实验检测了与鱼类生殖(er α, er β, ar, cyp19b)、甲状腺激素合成(tsh β, tr α, dio)和神经发育(α1-tubulin, mbp, syn2a, gap43)相关基因的转录水平, 结果表明, 三峡库区各采样点水样均能不同程度地改变相关基因的转录水平。具体表现为, 采样点 1的水样能改变与鱼类生殖(er α, ar)和神经发育相关基因(α1-tubulin, mbp, gap43)的转录水平, 采样点 2的水样能改变与鱼类甲状腺激素合成(tsh β, tr α)和神经发育相关基因的转录水平, 而采样点 3的水样能改变与鱼类生殖, 甲状腺激素合成以及神经发育相关基因的转录水平。因此推测3号采样点水样综合毒性大于1号和2号采样点水样。这一结果与我们的化学分析结果相吻合, 3号采样点水样中Cu、Zn、Cr、Cd、Pb等含量均高于1号和2号采样点。研究表明, 这几种重金属在鱼类体内的富集能力为: Cd > Zn > Pb > Cu > Cr[14]。其中As、Cd、Pb等均被美国Our Stolen Future 网站列入《具有内分泌干扰效应的普遍污染物清单》中[21], 因此推测这些有毒重金属可能与性腺和甲状腺相关基因转录水平的改变有关。毒理学研究表明, 除Pb、As、Cd外, Cu、Zn、Cr、Mn、Ni、Co等重金属也都会对生物体神经系统产生影响[22—24], 表明生物体的神经系统对重金属污染物更为敏感。而在本研究中, 3个采样点的水样均能抑制斑马鱼神经发育相关基因的转录水平, 提示神经发育相关基因是很好的生物标志物, 同时也验证了斑马鱼幼鱼基因转录水平的变化与水体中重金属污染有关的推测。
由于三峡库区水体中污染物的分布存在一定的规律性, 即丰水期水体污染稍重于枯水期水体污染[14]。本研究中所用的水样采集于2013年4月, 只能代表三峡库区这一期间内的水质情况, 因而需要对三峡库区上游水体中各有毒物质的含量进行动态监测和长期评估。此外, 在有毒物质长期存在条件下是否会对上游水体区域中的鱼类种群产生影响需要开展进一步的调查研究。
[1] Bulletin of Environmental and Ecological Monitoring for the Three Gorges Project of Yangtze River. Ministry of Environmental Protection of the People’s Republic of China, 2011, 51 [中华人民共和国环境保护部. 长江三峡工程生态与环境监测公报, 2011, 51]
[2] Xu X Q, Deng G Q, Hui J Y, et al. Heavy metal pollution in sediments from the Three Gorges Reservoir area [J]. Acta Hydrobiologica Sinica, 1999, 23(1): 1—10 [徐小清, 邓冠强,惠嘉玉, 等. 长江三峡库区江段沉积物的重金属污染特征.水生生物学报, 1999, 23(1): 1—10]
[3] Zhang S, Li L L, Zhang Y, et al. Changes of heavy metals distribution in water body of the Three Gorges Reservoir at 135 m water level [J]. Journal of Anhui Agricultureal Sciences, 2007, 35(11): 3342—3343, 3376 [张晟, 黎莉莉,张勇, 等. 三峡水库 135 m 水位蓄水前后水体中重金属分布变化. 安徽农业科学, 2007, 35(11): 3342—3343, 3376]
[4] Li Q. Studyon arsenic, lead and chromium toxic heavy metals in Three lead, and chromium toxic heavy Gorges Resevroir Region atfer impoundment [D]. Thesis for Master of Engineering. Southwest University, Chongqing. 2005 [李倩. 三峡水库蓄水后水体中有毒重金属砷、铅、铬研究. 硕士学位论文. 西南大学, 重庆. 2005]
[5] Xu Y J, Liu X Z, Ma A J. Current research on toxicity effect and molecular mechanism of heavy metals on fish [J]. Marine Sciences, 2004, 28(10): 67—70 [徐永江, 柳学周,马爱军. 重金属对鱼类毒性效应及其分子机理的研究概况. 海洋科学, 2004, 28(10): 67—70]
[6] Åse K, Chris B, Cecilie Ø. Genetic effects of high and low exposure to heavy metals [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1997, 379(S1): S112
[7] Gunnar F N, Koji N, Monica N. Handbook on the Toxicology of Metals (4th edition) [M]. Amsterdam: Academic Press. 2015, 667
[8] Molly T, Mathuros R, Philip L. The developmental neurotoxicity of arsenic: cognitive and behavioral consequences of early life exposure [J]. Annals of Global Health, 2014, 80(4): 303—314
[9] Zha J M, Wang Z J. Assessment acute and chronic toxicity and endocrine disruption effects of whole effluent based on early stage development of Japanese medaka (Oryzias latipes) [J]. Acta Scientiae Circumstantiae, 2005, 25(12): 1682—1686 [查金苗, 王子健. 鳉利用日本青 早期发育阶段暴露评估排水的急、慢性毒性和内分泌干扰效应. 环境科学学报, 2005, 25(12): 1682—1686]
[10] Chen J Z, Sun Z Z, Qu J H, et al. Water pollution and its toxicity to fishes in the major areas of the lower researches of the Yangtze River [J]. Acta Hydrobiologica Sinica, 2002, 26(6): 635—640 [陈家长, 孙正中, 瞿建宏, 等. 长江下游重点江段水质污染及对鱼类的毒性影响. 水生生物学报, 2002, 26(6): 635—640]
[11] Shi X, Du Y, Lam P K, et al. Developmental toxicity and alteration of gene expression in zebrafish embryos exposed to PFOS [J]. Toxicology and Applied Pharmacology, 2008, 230(1): 23—32
[12] USEPA. Fish Acute Toxicity Mitigated by Humic Acid [M]. NW Washington D C: U S Environmental Protection Agency Office of Water. 1996
[13] Zhou Y, Xu J, Feng Y H, et al. Bio-toxicity of shallow groundwater in organic pollutants contaminated site to the development of embryos of zebrafish [J]. Journal of Ecology and Rural Environment, 2012, 28(6): 700—705 [周艳, 徐建,冯艳红, 等. 有机污染场地浅层地下水对斑马鱼胚胎发育的生物毒性研究. 生态与农村环境学报, 2012, 28(6): 700—705]
[14] Zhang X H, Xiao B D, Chen Z J, et al. Characteristics of the distribution of Cu, Pb, Cd, Cr, Zn in Xiangxi River [J]. Resources and Environment in the Yangtze Basin, 2002, 11(3): 269—273 [张晓华, 肖邦定, 陈珠金, 等. 三峡库区香溪河中重金属元素的分布特征. 长江流域资源与环境, 2002, 11(3): 269—273]
[15] Lü Y B, Gong Z Y, Lian J, et al. Status of water quality in the Three Gorges after the water storage period [J]. Research of Environmental Sciences, 2007, 20(1): 1—6 [吕怡兵, 宫正宇, 连军, 等. 长江三峡库区蓄水后水质状况分析. 环境科学研究, 2007, 20(1): 1—6]
[16] Pennie W, Pettit S D, Lord P G. Toxicogenomics in risk assessment: An overview of an HESI collaborative research program [J]. Environmental Health Perspectives, 2004, 112(4): 417–419
[17] Thomas R S, Rank D R, Penn S G, et al. Identification of toxicologically predictive gene sets using cDNA microarrays [J]. Molecular Pharmacology, 2001, 60(6): 1189—1194
[18] Snell T W, Brogdon S E, Morgan M B. Gene expression profiling in ecotoxicology [J]. Ecotoxicology, 2003, 12(6): 475—483
[19] Bartosiewicz M, Penn S, Buckpitt A. Applications of gene arrays in environmental toxicology: Fingerprints of gene regulation associated with cadmium chloride, benzo (a) pyrene, and trichloroethylene [J]. Environmental Health Perspectives, 2001, 109(1): 71—74
[20] Hong W S, Fang Y Q. Advances on aromatase activity in fish [J]. Journal of Fisheries of China, 2000, 24(3): 285—288 [洪万树, 方永强. 鱼类芳香化酶活性研究的进展. 水产学报, 2000, 24(3): 285—288]
[21] Ourstolenfuture, http://www.ourstolenfuture.org/basics/chem 2list. htm
[22] Wang D Y, Wang Y. Nickel sulfate induces numerous defects in Caenorhabditis elegans that can also be transferred to progeny [J]. Environmental Pollution, 2008, 151(3): 585—592
[23] Du M, Wang D Y. The neurotoxic effects of heavy metal exposure on GABAergic nervous system in nematode Caenorhabditis elegans [J]. Environmental Toxicology and Pharmacology, 2009, 27(3): 314—320
[24] Wang Y, Xie W, Wang D Y. Transferable properties of multi-biological toxicity caused by cobalt exposure in Caenorhabditis elegans [J]. Environmental and Toxicological Chemistry, 2007, 26(11): 2405—2412
[25] Wang D Y, Shen L L, Wang Y. The phenotypic and behavioral defects can be transferred from zinc exposed nematodes to their progeny [J]. Environmental Toxicology and Pharmacology, 2007, 24(3): 223—230
ANALYSIS OF HEAVY METALS IN THE SURFACE WATER FROM THE THREE GORGES RESERVOIR AND ITS TOXIC EFFECTS ON THE EMBRYONIC DEVELOPMENT OF THE ZEBRAFISH
GUO Yong-Yong, HUA Jiang-Huan, YANG Li-Hua and ZHOU Bing-Sheng
(Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
It has been obscure whether the pollution in the Three Gorges Reservoir (TGR) has impacts on the survival of fish that inhabit in the upstream of TGR, thus it is very important to monitor the pollution level and to investigate the toxic effects on fish early development. In this study, we collected surface water samples from three typical areas of the TGR, and employed the ICP-MS method to determine the concentrations of 13 typical heavy metals. We also evaluated the toxic effects by exposing zebrafish embryos (2h post-fertilization, hpf) to filtrated water samples until 168 hpf. The concentrations of 13 heavy metals in the TGR were all under the limits set by the environmental quality standards for surface water. We then examined the developmental endpoints, the transcription of several key genes in reproduction, in the synthesis of thyroid hormone, and in the neural development of fish. There were no significant differences in hatching, survival, and deformity rates between embryos exposed to the TGR water and the control group. However, zebrafish larvae exposed to TGR surface water showed reduced transcription of genes involved in reproduction (er α, ar, and cyp19b), in the synthesis of thyroid hormone (tr α, tsh β, and dio) and in the neural development (α1-tubulin, syn2a, and gap43), and the water from site 3 had the most profound effects. Our results suggested that there might not be considerable heavy metal pollution in the surface water of the TGR, and that the early development of fish might not be affected at this pollution level. Further study is needed to test whether the molecular-level alteration may have long-term effects on the development of individual fish.
The Three Gorges Reservoir; Heavy metal; Zebrafish; Developmental toxicity
X171.5
A
1000-3207(2015)05-0885-08
10.7541/2015.117
2015-02-16;
2015-04-10
中国长江三峡集团公司科研项目(CT-12-08-01)资助
郭勇勇(1983—), 男, 湖南邵阳人; 硕士; 主要研究方向为环境毒理学。E-mail: yyguo@ihb.ac.cn
杨丽华(1984—), 女, 河北沧州人; 博士; 主要研究方向为环境毒理学。E-mail: lhyang@ihb.ac.cn
