不同剂量川芎嗪注射液对缺血缺氧性脑病新生儿脑组织损伤的改善作用
2015-03-02李给世王文益
李给世,王文益
(四川省三台县人民医院,1.药剂科;2.新生儿科,四川 三台,621100)
缺血缺氧性脑病(HIE)是新生儿窒息后的严重并发症,可导致脑性瘫痪、癫痫、智力障碍等永久性神经系统损伤,甚至死亡,给患儿的生长发育及家庭带来严重影响[1-2]。川芎嗪注射液具有活血、化瘀、理气之功效,可扩张脑血管、改善微循环,在缺血性脑血管疾病中广泛应用[3]。本研究应用不同剂量的川芎嗪注射液治疗新生儿HIE,观察其对脑组织损伤的改善作用及安全性的差异,以期为临床治疗提供参考,现报告如下。
1 资料与方法
选择2011年5月—2014年1月收治的中、重度HIE 新生儿87例,均符合HIE 诊断及分度标准[4],其中男51例,女36例;日龄1~3 d,平均(1.45±0.42)d,体质量1.50~5.05 kg,平均(2.84±0.56)kg;中度72例,重度15例。所有患儿母亲均健康,且无先天性代谢疾病、免疫缺陷、肾脏疾病以及其他可影响免疫内分泌功能的疾病,无免疫制剂、血制品等用药史。将87例患儿随机分为对照组、大剂量组及小剂量组,各29例。3组患儿性别、日龄、体质量、病情程度等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
3组患儿均给予相同的常规治疗[5],包括苯巴比妥控制惊厥、甘露醇降低颅内压、纳诺酮消除脑干症状、胞二磷胆碱促进脑细胞代谢等。小剂量组、大剂量组分别在此基础上加用川芎嗪注射液4 mg/kg、8 mg/kg,溶于生理盐水50 mL 静脉滴注,中度患儿连续治疗14 d,重度患儿治疗21~28 d。
比较3组患儿神经症状(意识、反射、肌张力、脑水肿、惊厥)恢复时间及住院时间;3组患儿均于入院当天及出院前1 d 清晨空腹取静脉血3 mL,检测血清一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)、神经元特异性烯醇化酶(NSE)及髓鞘碱性蛋白(MBP)水平;统计3组患儿治疗期间的不良反应,治疗结束后随访1年,比较预后情况。
2 结果
2.1 3组神经症状恢复时间及住院时间比较
大剂量组及小剂量组各神经症状恢复时间及住院时间均显著短于对照组(P<0.05 或P<0.01),且大剂量组各神经症状恢复时间显著短于小剂量组(P<0.05 或P<0.01),2组住院时间比较,差异无统计学意义(P>0.05)。见表1。
表1 3组神经症状恢复时间及住院时间() d
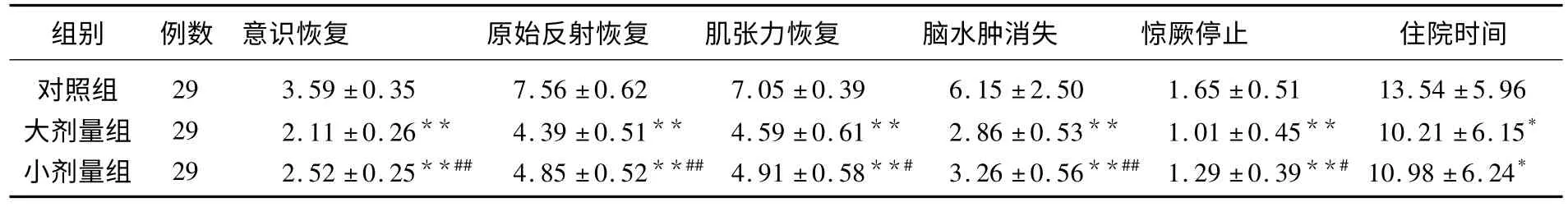
表1 3组神经症状恢复时间及住院时间() d
与对照组比较,* P<0.05,**P<0.01;与大剂量组比较,#P<0.05,##P<0.01。
2.2 3组血清NO、SOD 及MDA 水平
3组患儿治疗前各血清学指标无显著差异(P>0.05),治疗后SOD 均较治疗前显著升高,NO、MDA、NSE和MBP水平较治疗前显著降低(P<0.05 或P<0.01)。组间比较,NO、MDA、NSE 和MBP 水平,大剂量组<小剂量组<对照组,SOD 水平大剂量组>小剂量组>对照组,差异均有统计学意义(P<0.05 或P<0.01)。见表2。
表2 3组NO 及氧自由基水平变化()
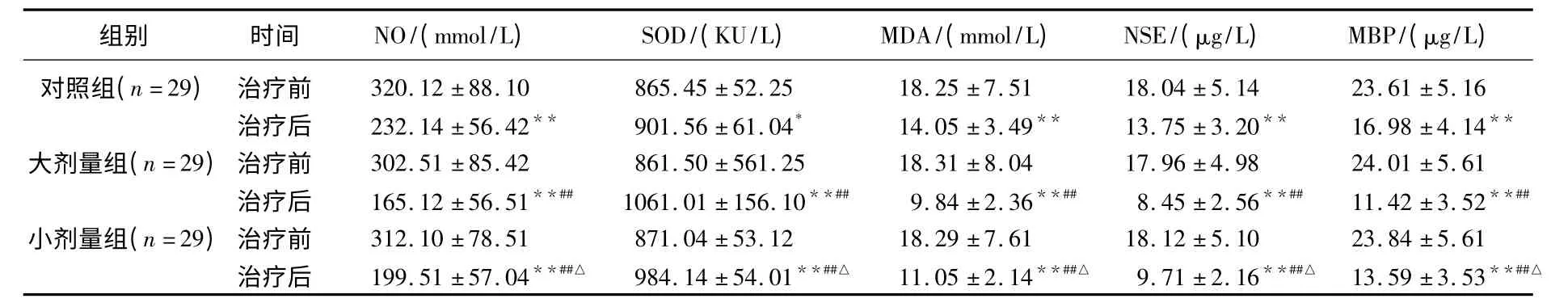
表2 3组NO 及氧自由基水平变化()
与本组治疗前比较,* P<0.05,**P<0.01;与对照组比较,#P<0.05,##P<0.01;与大剂量组比较,△P<0.05。
2.3 不良反应及预后
3组患儿治疗过程中均未发现明显药物相关性不良反应,对照组死亡2例(6.90%),大剂量组死亡1例(3.45%),小剂量组无死亡病例。随访期间,对照组出现智力低下1例,脑瘫4例,癫痫3例,后遗症发生率为29.63%(8/27);大剂量组发生智力低下1例,癫痫1例,无脑瘫患儿,后遗症发生率为7.15%(2/28);小剂量组发生脑瘫1例,癫痫1例,无智力低下患儿,后遗症发生率为6.90%(2/29)。3组病死率无显著差异;对照组后遗症发生率高于大、小剂量组,但差异无统计学意义(P>0.05)。
3 讨论
缺氧可引起脑水肿、神经元坏死,缺血可导致脑血管梗死及白质软化,使得患儿发生永久性神经损伤,严重影响其生长及发育,尤其是中、重度HIE,对患儿智能发育的影响显著,治疗不当容易导致死亡[6-7]。临床上主要采用控制惊厥、降低颅内压、消除脑干症状、促进脑细胞代谢等治疗,并加用血管扩张剂[8]。
近年来,氧自由基及NO 水平在缺氧缺血性脑损伤中变化受到广泛关注[9]。NO 可介导谷氨酸神经毒作用,使正常的细胞代谢被扰乱,各种炎性物质大量释放,从而发生一系列炎性损伤[10];另一方面,由于脑损伤的发生,患者体内酶合成发生障碍,大量氧自由基生成,攻击膜结构及DNA,使神经细胞结构遭到破坏,导致神经元、血脑屏障被损坏,脑水肿形成,从而进一步加重脑损伤[6],同时导致其防御物质SOD 大量消耗,机体清除氧自由基能力下降[11]。
NSE 是二聚体蛋白,特异性存在于神经元及神经内分泌细胞中,当脑缺血导致神经元损伤时,细胞膜遭到破坏,NSE 从胞质中漏出,造成脑脊液中NSE 水平显著升高;另一方面,血脑屏障破坏可使得积聚于脑脊液中的NSE 释放入血,造成血中NSE 含量显著上升[12]。位于髓磷脂浆膜面的MBP 与髓鞘脂质紧密结合,起到维持中枢神经系统髓鞘结构稳定的作用,当中枢神经系统髓鞘被破坏时,脑脊液及血中MBP 含量会显著升高。
川芎嗪是中药川芎中的一种生物碱,在体内吸收完全,易通过血脑屏障,稳定性高,可清除氧自由基、钙拮抗、扩张血管、抗血小板聚集。川芎嗪半衰期较短,常规剂量可能难以取得最佳疗效。但是新生儿各组织、器官的发育尚不完善,因此在用量的选择上应尤其慎重,需依据病情程度、转归预测等进行综合评价,在衡量利弊后选择合适的剂量。实验研究[13]表明,川芎嗪注射液可有效改善缺血缺氧状态下大鼠脑组织的损伤,清除氧自由基,减少神经元丢失。本研究中,大剂量组对于临床症状及血清学指标的改善作用强于小剂量组和对照组,且未发生明显不良反应,提示大剂量川芎嗪对HIE 的疗效显著,且安全可行。
[1]Martinez-Biarge M,Diez-Sebastian J,Kapellou O,et al.Predicting motor outcome and death in term hypoxic- ischemic encephalopathy[J].Neurology,2011,76(24):2055.
[2]Volpe J J.Neonatal encephalopathy:an inadequate term for hypoxic–ischemic encephalopathy[J].Ann Neurol,2012,72(2):156.
[3]任灵,辛宏.川芎嗪注射液辅佐1,6-二磷酸果糖治疗新生儿缺氧缺血性脑病的疗效及预后观察[J].中国生化药物杂志,2014,34(7):135.
[4]中华医学会儿科学分会新生儿学组.新生儿缺氧缺血性脑病诊断标准[J].中华儿科杂志,2005,43(8):584.
[5]Azzopardi D.Clinical management of the baby with hypoxic ischaemic encephalopathy[J].Early Hum Dev,2010,86(6):345.
[6]徐恒昀,曹和涛,徐金标,等.新生儿缺血缺氧性脑病CT及MRI 诊断比较[J].中国CT 和MRI 杂志,2015,13(1):32.
[7]周宜蓉,雷蕾,邓丽丽,等.新生儿和早产儿缺血缺氧性脑病的脑电图分析[J].宁夏医科大学学报,2012,34(11):1173.
[8]陈淑香.新生儿缺氧缺血性脑病120例临床特点分析[J].中国中西医结合儿科学,2012,4(5):452.
[9]Chaudhari T,McGuire W.Allopurinol for preventing mortality and morbidity in newborn infants with hypoxic‐ischaemic encephalopathy[J].Cochrane Database Syst Rev,2012,doi:10.1002/14651858.CD006817.
[10]Shankaran S.Hypoxic- ischemic encephalopathy and novel strategies for neuroprotection[J].Clin Perinatol,2012,39(4):919.
[11]Komur M,Okuyaz C,Celik Y,et al.Neuroprotective effect of levetiracetam on hypoxic ischemic brain injury in neonatal rats[J].Childs Nerv Syst,2014,30(6):1001.
[12]Sun J,Li J,Cheng G,et al.Effects of hypothermia on NSE and S-100 protein levels in CSF in neonates following hypoxic/ischaemic brain damage[J].Acta Paediatr,2012,101(8):e316.
[13]陈德森,郭俐宏,李莉,等.川芎嗪对大鼠局灶性脑缺血再灌注损伤的影响[J].山西医科大学学报,2010,41(9):780.
