同步放化疗联合盆腔热疗治疗局部晚期宫颈癌的效果观察
2015-03-02张爱云杜军华欧宝权尹宜发
付 娟,张爱云,杜军华,欧宝权,尹宜发
(湖北省宜昌市第二人民医院 肿瘤放化疗科,湖北 宜昌,443000)
宫颈癌是妇科常见恶性肿瘤,全球妇女中发病率仅次于乳腺癌,在一些发展中国家居妇女恶性肿瘤的首位。中国每年新发病例为13.15 万,占中国妇女恶性肿瘤首位,死亡率居全身恶性肿瘤第7 位[1],是威胁妇女生命的主要疾病之一。国内外多项大宗随机对照试验证实,含铂方案同步放化疗是局部晚期宫颈癌的标准治疗模式,5年生存率可达到50%左右。
局部晚期宫颈癌治疗失败的主要原因是肿瘤局部复发或转移。治疗失败的患者中,70%是盆腔内复发,仅30%为远处转移,在盆腔内复发者中60%以上在宫旁组织,近40%是局部复发。热疗是利用物理方法使肿瘤区域或全身加热至有效治疗温度并维持一定时间以达到杀灭肿瘤细胞而又不损害正常组织的目的,是应用热效应治疗肿瘤的一种方法。本研究采用同步放化疗联合盆腔热疗治疗局部晚期宫颈癌,观察其临床疗效和毒副反应,现报告如下。
1 资料与方法
1.1 一般资料
选取2008年10月—2010年3月收治入院的局部晚期宫颈癌患者97例作为研究对象。入选标准:年龄≤70岁,卡氏评分≥60 分,HGB≥90 g/L 的病理诊断为宫颈癌患者;1994年FIGO 分期为Ⅱb~Ⅲb 期;曾行放疗或化疗患者、术后者及远处转移者除外;入组患者均签字同意接受以下治疗方案。按就诊顺序随机分为试验组(热疗+同步放化疗)和对照组(同步放化疗)。试验组患者的年龄、卡氏评分、病理类型、临床分期、大体分型、肿块直径、临床症状指标与对照组相比,差异无统计学意义(P>0.05),具有可比性。见表1。
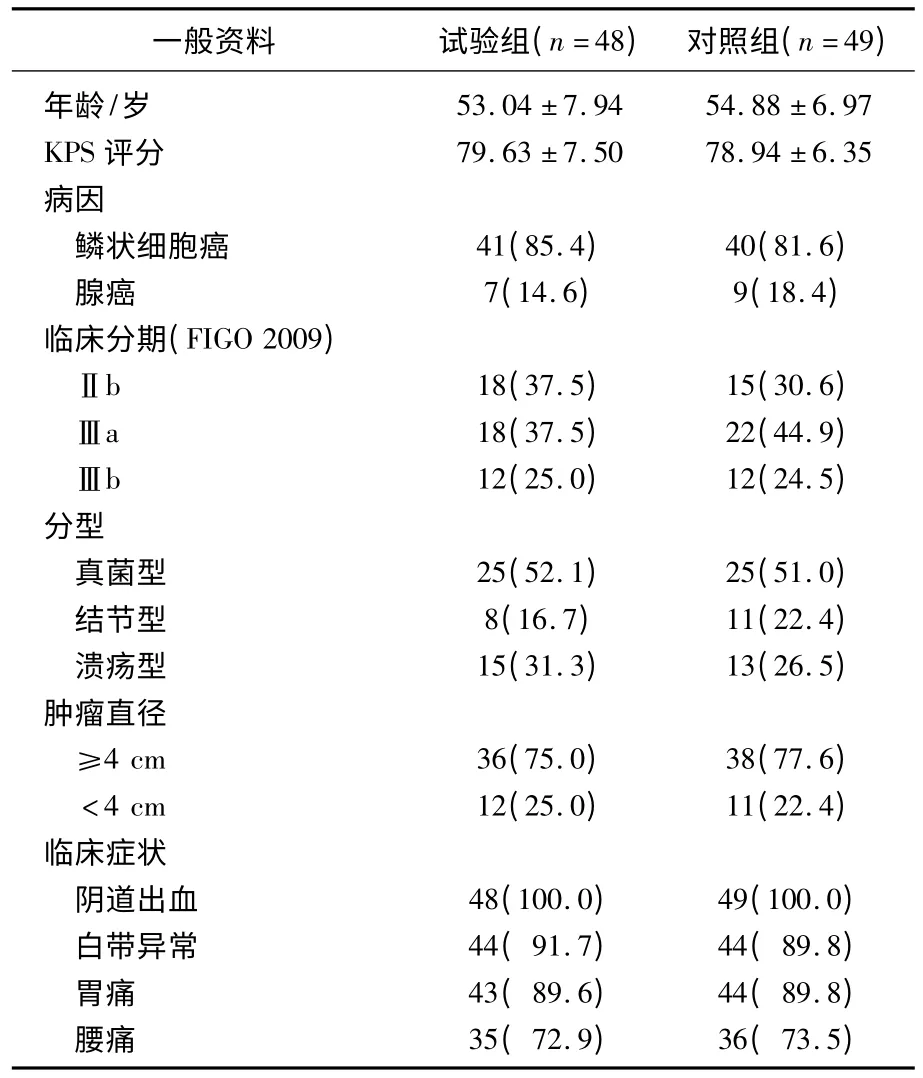
表1 2组患者一般资料比较
1.2 治疗方法
对照组:盆腔外照射采用15MV- X 行盆腔前后野照射,常规分割方式,1.8~2.0 Gy/次,每周5 次,DT45~50 Gy,全盆照射25~30 Gy 后予中间挡铅。挡铅后开始加做腔内后装治疗(192 Ir HDR),后装当天不予以盆腔外照射每周1 次,6 Gy/次,A 点剂量30 Gy/5 次。放疗第1 天开始顺铂化疗增敏,DDP 30 mg/m2,每周1 次,共6次。
试验组:采用同步放化疗联合热疗方案。同步放化疗方案同前,盆腔热疗使用珠海市和佳医疗设备有限公司的频率为13.56MHZ 的HG-2000 体外高频热疗机,温度39.5 ℃~41.5 ℃,60 min/次,每周2 次,总共6 次,放疗前或放疗后1 h 进行。
1.3 临床疗效和毒副反应评估
全面复查包括有1 名副主任医师职称以上者参加的妇科三合诊,盆腔CT、腹部B 超、胸片以及各项化验检查。治疗结束后1 个月以RECIST 标准评价近期疗效,分CR、PR、SD、PD 共4 个等级,以完全缓解率(CR)和部分缓解率(PR)为有效率(RR)。以3年生存率作为远期疗效评价指标,疗效评价时须由两名以上的医生参加。治疗毒副反应按NCI 的CTCAE V3.0 标准和RTOG 放射损伤分级标准进行评估。
2 结果
2组患者共有100例参加本研究,97例按计划完成全部治疗。其中试验组2例因经济原因中断治疗,对照组1例因并发内科病转入内科而中断治疗,无1例因治疗毒副反应中断治疗。可评价例数为97例,其中试验组为48例,对照组为49例。治疗结束,2组患者均症状不同程度减轻或消失。试验组的有效率为91.7%,对照组的有效率为67.3%,差异有统计学意义(χ2=8.762,P<0.01),见表2。
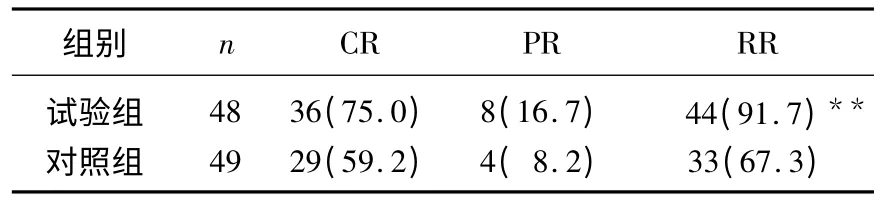
表2 2组患者近期疗效比较[n(%)]
试验组患者的5年生存率高于对照组,差异有统计学意义(χ2=6.228,P=0.013)。试验组患者的局部复发率(3/48,6.25%)也低于对照组(11/49,22.4%),差异有统计学意义(χ2=5.152,P=0.023)。
治疗过程中,2组的早期不良反应主要为骨髓抑制和胃肠道反应,试验组与对照组相比,差异无统计学意义(P>0.05)。随访3年,试验组患者出现放射性膀胱炎、直肠炎反应的情况与对照组患者相比,差异无统计学意义(P>0.05)。试验组皮肤反应稍高于对照组,但均为Ⅰ°~Ⅱ°,可耐受,差异无统计学意义(P>0.05)。试验组有1例患者出现皮下脂肪硬结,未做任何处理。
3 讨论
宫颈癌是中国最常见的妇科恶性肿瘤,大多宫颈癌患者就诊时已属中晚期,治疗后肿瘤局部复发及转移率较高,5年生存率偏低。1999—2002年间GOG、RTOG、SWOG 等进行了6 个以顺铂为基础的同步放化疗大样本前瞻性随机对照临床研究,结果显示各研究组内临床期别、放射剂量、放射方法及含铂的化疗方案不尽相同,但都显示同步放化疗能明显改善生存率,使总体生存率提高12%,从而奠定了同步放化疗在宫颈癌治疗中的地位[2]。同步放化疗现已成为局部晚期宫颈癌的标准治疗模式,适用于鳞癌、腺癌及腺鳞癌等多种病理类型[3]。
Harima 等[4]报道40例Ⅲb 期宫颈癌患者的单纯放疗或热放疗联合治疗的随机研究,结果热放组的CR 率为80%,单放组CR 率为50%,3年生存率分别为58.2%和48.1%,无瘤生存率分别为63.6%和45%,局部控制率分别为79.7%和48.5%,差异有统计学意义。荷兰深部热疗合作组(DDHT)的研究显示深部热疗加放射治疗较单纯放射治疗治疗宫颈癌CR 率由57% 提高到87%(P=0.003),3年总生存率分别为51%和27%(P=0.009),并经过长达12年随访发现热放疗可以持续改善局部控制率和总生存率,并与单纯放疗相比没有显著增加毒副反应。自DDHT完成后,热放疗在荷兰疗已成为局部晚期宫颈癌治疗的标准方案,并推荐应用于不能耐受化疗的患者[5-6]。Vasanthan 等[7]却发现放疗联合热疗对中晚期宫颈癌治疗无明显有益作用,但这个随机试验饱受批评,其中最重要的一点是热疗时测温数据不准确,落后的加热技术是该试验疗效差的重要原因。众多研究表明放疗联合热疗治疗局部晚期宫颈癌,近期疗效及局部控制率是肯定的。热疗联合放疗在提高宫颈癌的近期疗效中得到证实,但对于其联合同步放化疗是否增效,国内外相关报道较少。Westermann 等[8]报道来自一项国际多中心Ⅰ/Ⅱ期临床试验表明这种三联疗法是可行的,该试验采用全程放疗、顺铂周疗,联合局部热疗治疗68例局部晚期宫颈癌患者,CR 率为90%,平均随访538 d,无病生存率为74%,总生存率为84%。陈文娟等[9]对Ⅱb~Ⅲb 期宫颈癌进行回顾性分析,热放化疗组总有效率90.7%,而放化疗组为80.0%(P<0.05)。许江兰等[10]对三联疗法与单纯放化疗病例的远期疗效进行了评估,报道2组3年生存率差异无统计学意义(P>0.05),3年无瘤生存率及局控率差异有统计学意义(P<0.05)。
关于毒副反应,大多学者认为热疗是一种安全可靠、患者能很好耐受的治疗方法[11]。Sabrina等[12]进行的一项回顾性研究应用三联疗法治疗43 名中晚期宫颈癌患者,中位随访时间为29.8月,治疗有效率达83.7%,CR 率达81.4%,1年无瘤生存率达66%,5年总生存率达55%。但有一个突出发现是在治疗期间Ⅲ~Ⅳ级血管毒性增加,在化疗期间有39.5%的患者发生,并建议预防性应用抗凝血药减少血管毒性的发生[13-15]。对于三联疗法是否增加毒副反应,目前尚无确定结论。近期一项同步放化疗与热放化疗三联疗法疗效比较的荷兰多中心Ⅲ期临床试验正在进行中,有待解答这些问题[2]。
本研究结果显示,试验组CR 为75.00%,PR为16.67%,治疗总有效率(CR+PR)为91.67%;对照组CR 为59.18%,PR 为8.16%,治疗总有效率(CR +PR)为67.35%。2组毒副反应无显著差异(P>0.05),而试验组患者的5年生存率要高于对照组,且局部复发率更低。该研究结论与既往大多报道相符,较好地阐述了热疗在局部晚期宫颈癌患者治疗中的意义[16-18]。但本课题也有其局限性,这是一个单中心研究,样本量偏少。同时,作者考虑下一步研究放疗联合热疗、同步放化疗和热放化疗三联疗法的随机3组试验,这或许可以提供关于热疗在局部晚期宫颈癌综合治疗中有效性和毒副反应更准确的答案[19]。在IMRT 技术下,盆腔热疗联合同步放化疗对比单纯同步放化疗有无疗效差异,尚需探讨。
[1]Shi J F,Canfell K,Lew J B,et al.The burden of cervical cancer in China:synthesis of the evidence[J].Int J Cancer,2012,130(3):641.
[2]Franckena M,Stalpers LJ,Koper PC,et al.Long-term improvement in treatment outcome after radiotherapy and hyperthermia in locoregionally advanced cervix cancer:an update of the Dutch Deep Hyperthermia Trial[J].Int J Radiat Oncol Biol Phys,2008,70(4):1176.
[3]Symonds P.Chemoradiation:the new gold standard for nonsurgical treatment of cervical cancer[J].Clinical oncology(Royal College of Radiologists (Great Britain),2002,14(3):201.
[4]Harima Y,Nagata K,Harima K,et al.A randomized clinical trial of radiation therapy versus thermoradiotherapy in stage IIIB cervical carcinoma[J].International journal of hyperthermia,2001,17(2):97.
[5]van der Zee J,Gonzalez G D.The Dutch Deep Hyperthermia Trial:results in cervical cancer[J].International journal of hyperthermia,2002,18(1):1.
[6]van der Zee J,Gonzalez G D,van Rhoon G C,et al.Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours:a prospective,randomised,multicentre trial[J].Lancet,2000,355(9210):1119.
[7]Vasanthan A,Mitsumori M,Park JH,et al.Regional hyperthermia combined with radiotherapy for uterine cervical cancers:a multi-institutional prospective randomized trial of the international atomic energy agency[J].Int J Radiat Oncol Biol Phys,2005,61(1):145.
[8]Westermann A M,Jones E L,Schem B C,et al.First results of triple-modality treatment combining radiotherapy,chemotherapy,and hyperthermia for the treatment of patients with stage ⅡB,Ⅲ,and IVA cervical carcinoma[J].Cancer,2005,104(4):763.
[9]陈文娟,王捷忠,潘建基,等.中晚期巨块型宫颈癌热疗配合同步放化疗的近期疗效观察[J].中国医药指南,2012,(27):54.
[10]许江兰,王也.深部热疗联合顺铂增敏同步放疗治疗中晚期宫颈癌的临床研究[J].内蒙古医学杂志,2011,43(9):1045.
[11]李梅,王芳,魏万里.肿瘤热疗的研究进展[J].现代肿瘤医学,2006,14(9):1169.
[12]Heijkoop S T,Franckena M,Thomeer M G,et al.Neoadjuvant chemotherapy followed by radiotherapy and concurrent hyperthermia in patients with advanced-stage cervical cancer:a retrospective study[J].International journal of hyperthermia,2012,28(6):554.
[13]李杰,崔丽峰,姜赛琳,等.宫颈病变中HPV 感染与FHIT 蛋白表达的相关性[J].中国妇幼保健,2011,26(36):5789.
[14]李治群,高金鸟.MRI 术前诊断宫颈癌宫旁浸润和淋巴结转移中的价值研究[J].中国妇幼保健,2015,30(4):632.
[15]梁慧,付敏,任玲,等.高危型HPVDNA 联合TCT 在宫颈癌前病变筛查中的诊断价值[J].中国妇幼保健,2011,26(36):5829.
[16]尹香花,苏悦,隋玉梅,等.HPV 阴性的宫颈癌和癌前病变中p14ARF 蛋白表达及其临床意义[J].中国妇幼保健,2011,26(36):5784.
[17]李伟宏,凌奕,张峻霄,等.宫颈癌筛查系统不同点探区间在宫颈癌筛查中的应用价值[J].海南医学院学报,2011,17(9):1171.
[18]季修庆,成建,林颖,等.FISH 检测宫颈脱落细胞hTERC基因扩增及宫颈癌筛查中的意义[J].中国妇幼保健,2011,26(31):4813.
[19]章任兵,谭琪,何小兰,等.表达谱芯片筛选人宫颈癌淋巴结转移相关基因的研究[J].海南医学院学报,2011,17(1):38.
