乳管镜在乳管内病变诊断与治疗中的应用价值
2015-03-02赵亚婷张景华
赵亚婷,张景华,王 鹿
(河北省唐山市人民医院 乳腺外科,河北 唐山,063000)
乳头溢液是乳腺疾病最常见的临床症状之一,多为乳管内病变的早期表现。乳腺导管扩张、炎症、乳房囊性增生、乳管内乳头状瘤及乳腺癌等病变都可能引起乳头溢液[1]。目前,乳头溢液常见检测方法主要为脱落细胞学检测、B 型超声检查、乳腺钼靶X 线摄片及乳腺导管造影等[2],其结果均为间接征象,阳性率通常较低[3]。乳管镜(FDS)可通过直接观察乳管内病变,直视下放置定位针以准确判断乳管内病变位置,明确乳头溢液病因及导管内占位性病变的性质。提高早期乳腺癌的检出率,并可指导乳管扩张及乳腺炎性病变的乳管内介入治疗[4-5]。本研究对行FDS 检查的147例乳头溢液患者的临床资料进行回顾性分析,以评价FDS 在乳头溢液诊治中的临床应用价值。
1 资料与方法
1.1 一般资料
选取2012年4月—2014年9月就诊的行FDS 检查的乳头溢液患者147例,入选标准:①临床体检时未触及肿瘤;②乳腺钼靶、B 超检查未发现明显阳性征象,但需排除乳管内占位性病变;③非哺乳期女性,年龄19~74岁,平均(37.7±2.9)岁;病程4 d~7年。其中,淡黄色性溢液69例(46.9%),血性溢液18例(12.2%),白色乳汁样26例(17.7%),无色清水样溢液34例(23.1%);单侧溢液129例(87.8%),双侧乳头溢液18例(12.2);单孔溢液114例(77.6%),多孔溢液33例(22.4%)。
1.2 方法
1.2.1 FDS 诊断:患者取平卧位,患侧乳房常规消毒铺巾、采用4~5 号扩张器依次扩张找到乳孔后由溢液乳管管口注入2%利多卡因约0.5 mL,6~8 号Bowmann 泪囊探针由细到粗逐步扩张乳管,同时注入少量生理盐水冲洗乳管,沿扩张的乳管缓慢插入FDS。检查过程中选择异常开口,寻腔进镜,不断调节乳头和FDS 位置,逐级观察乳管走向、结构、光滑度,获得最佳图像并保存。根据管腔内容物的性质、位置及与管腔关系,作出初步诊断[6]。
1.2.2 FDS 定位及手术处理:经初次FDS 诊断乳管内有新生物,或拟行瘤体及所在区段乳管切除手术者,术前1 d 再次利用FDS 行乳管内病变体表定位以指引手术操作。首先Bowmam 探针逐级扩张溢液乳管开口,FDS 探查,明确肿物位置,由侧孔插入定位导丝于肿物旁并跨越肿物0.3 cm,尾端导丝支撑固定,标示肿物部位,依据FDS 进入的长度确定病变离乳头的距离,乳房皮肤根据所透出的光线标记病变部位[7]。对乳管扩张期无急性炎症活动表现者,依据FDS 诊断潴留物的量镜下注入糜蛋白酶4000~40000 U +庆大霉 素4 万~12 万U 或0.5% 甲硝唑10~50 mL 及生理盐水,溶解、稀释后,挤压排出管腔潴留物,进行灌洗治疗,直至排出液清亮[8];对已有脂肪坏死或肉芽肿纤维化及脓肿形成者,单发占位性病变采取选择性病变乳管切除术;多发占位则采取病变乳管及其所属小叶切除术;如报告为乳腺癌,按乳腺癌治疗规范治疗。处理结束后,乳头局部给予红霉素软膏,防挤压,24 h 内禁浴。
1.3 观察指标
比较FDS 检察与病理诊断符合情况;统计乳管内占位性病变与溢液性状的关系;对占位性病变患者行FDS 下手术治疗或介入治疗,观察治疗效果。
2 结果
2.1 FDS 下诊断与病理诊断符合情况
FDS 诊断为导管内癌患者,造影显示导管断端不整齐,近侧导管轻度扩张,扭曲,排列紊乱,充盈缺损或完全性阻塞,导管僵硬(图1)。FDS 诊断为乳头状瘤者,造影显示导管断端呈光滑杯口状,近侧导管显示明显扩张,出现圆形或卵圆形充盈缺损,导管柔软、光整(图2)。导管内癌患者病理组织HE 染色见导管内实体性生长,乳头状结构形成假菊形团,肿瘤细胞形态较温和,细胞内外均见黏液分泌(图3)。乳腺导管乳头状瘤图片见球形分支或乳头状上皮细胞团少见,而以边缘不规则的小团状上皮细胞为主(图4)。

图1 FDS 显示导管内癌、浸润性癌患者造影

图2 FDS 显示乳头状次瘤患者造影
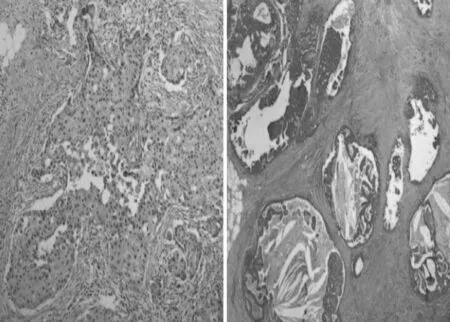
图3 导管内癌、浸润性导管癌组织 HE 染色 100 倍

图4 导管内乳头状瘤组织 HE 染色 100 倍
FDS 检查诊断为乳管导管扩张或炎症病变16例(10.9%);乳管内 占位性病变74例(50.3%):其中乳头状瘤52例(70.3%),乳头状瘤病18(24.3%),乳腺浸润性导管癌4例。术后经病理证实乳管占位病变78例(53.1%),其中乳头状瘤52例(66.7%),乳头状瘤病21例(26.9%),乳腺导管癌5例(6.4%)。
术前FDS 误诊4例:1例镜下拟诊乳头状瘤病,术后证实为乳腺导管癌;3例镜下拟诊乳头状瘤,术后证实为乳头状瘤病。漏诊4例:2例镜下拟诊慢性乳管炎,1例镜下拟诊乳管导管扩张症,1例镜下拟诊积乳症,术后均证实为乳头状瘤。FDS 乳管内占位性病变诊断灵敏度为94.9%(74/78),特异度94.5%(69/73),尤登指数89.4%。
2.2 乳管内占位性病变与溢液性状的关系
乳头黄色浆液性溢液69例,其中占位性病变54例(78.3%),乳腺浸润性导管癌2例;血性溢液18例,占位性病变16例(88.9%),乳腺浸润性导管癌2例;白色乳汁样溢液26例,乳管内占位性病变6例(23.1%);无色清水样溢液34例,2例FDS 诊断乳管内占位性病变(5.9%),1例术后经病理证实为乳管浸润性导管癌。黄色浆液性、血性溢液占位性病变概率显著高于乳汁样溢液和水样溢液(P<0.01);黄色浆液性和血性溢液之间,乳汁样溢液和水样溢液之间无差异(P>0.05)。
2.3 治疗情况
手术治疗乳管内占位性病变患者78例,采用FDS 于体表定位,行病变乳管切除或乳腺象限、区段切除,1例乳腺导管癌行乳房单纯切除。另9例乳管内乳头状瘤行FDS 下介入冲洗治疗。术后,共3例(3.8%)患者再次手术,2例乳管内乳头状瘤病患者分别于术后4 个月、5 个月,再次发生乳头溢液,FDS 检查见乳管内占位,行病变乳管切除;1例乳腺浸润性导管癌患者行乳腺癌根治术,其余随访至2015年4月未见明显复发或可疑恶性改变。
3 讨论
乳头溢液是乳腺病变中最常见的临床症状之一,既往对乳头溢液的患者多行溢液脱落细胞学检查,流行病学数据显示该法检出率较低,且对乳管内病灶的变化情况无法直接观察[9];而直接行手术切除进行病理活检,会对病人造成过多的损伤。绝大部分乳腺疾病起源于乳腺导管,FDS 可通过直接观察导管内的病变,根据图像做出诊断,并以此来指导外科手术切除部位及范围[10],本研究对147例伴有乳头溢液的患者行FDS 检查,结果与病理诊断比较,FDS 诊断灵敏度为95.1%,特异度94.7%,尤登指数89.8%。表明FDS 作为一种可直视观察病变乳管的新方法,能够发现乳腺X 线检查及乳腺彩超等不能发现的广泛癌前病变和导管内癌成分,提高乳腺疾病诊断率。
乳头溢液的性状可分浆液性、血性、水样、乳汁样及脓性等。有研究者认为临床对血性及浆液性溢液的病例应引起高度重视,尤其是50岁以上妇女,血性溢液恶变率高[11-12]。本研究结果黄色浆液性溢液69例,乳管内占位性病变率为78.3%;血性溢液18例,16例诊断为乳管内占位性病变,分别有2例诊断为乳腺导管癌。因此,临床上对黄色浆液性、血性溢液的患者需引起高度重视。
FDS 技术在乳头溢液的诊断方面已得到广泛的临床应用,而其在临床治疗上的应用,是近期临床研究的活跃领域[13]。由于FDS 具有精确定位的特点,有研究认为[14]FDS 直视下放置定位针有利于精确判断乳管内占位性病变位置,明确乳腺恶性疾病在乳管内的累及范围,提高病检的阳性率,避免误切或漏切,做到早诊早治。本研究中在FDS 下,对78例乳头溢液可疑乳管内占位性病变患者行手术切除或介入冲洗治疗,随访至今仅3例发生复发,有效率为96.2%(75/78),高于文献报道的传统手术有效率[15],表明FDS 下定位切除手术、介入治疗较传统手术具有优势,值得推广。
[1]Yang L,Wu D,Fan Z M.Retrospective analysis of pathologic nipple discharge[J].Genet Mol Res,2015,14(1):1443.
[2]胡滨,应学翔,等.超声和MRI 对于病理性乳头溢液诊断的临床研究[J].同济大学学报:医学版,2012,33(3),94.
[3]Shao Z M,Liu Y,Nguyen M.The role of the breast ductal system in the diagnosis of cancer[J].Oncol Rep,2001,8(1):153.
[4]苑著,屈翔,张忠涛,等.乳管镜放置定位针在未扪及肿块乳管内肿物手术中的应用[J].中国实用外科杂志,2008,28(10):883.
[5]王虎霞,陈楠,宋张骏,等.纤维乳管镜对乳腺导管内肿瘤的诊断价值[J].现代肿瘤医学,2014,22(4):847.
[6]吴唯,钱立元,丁波泥,等.1368例FDS 治疗乳管内病变的临床应用经验[J].中国肿瘤临床,2014,41(4):254.
[7]Hunerbein M,Raubach M,Gebauer B,et al.Intraoperative ductoscopy in women undergoing surgery for breast cancer[J].Surgery,2006,139(6):833.
[8]Kamali S,Bender O,Kamali G H,et al.Diagnostic and therapeutic value of ductoscopy in nipple discharge and intraductal proliferations compared with standard methods[J].Breast Cancer,2014,21(2):154.
[9]Lian Z Q,Wang Q,Zhang A Q,et al.A nomogram based on mammary ductoscopic indicators for evaluating the risk of breast cancer in intraductal neoplasms with nipple discharge[J].Breast Cancer Res Treat,2015,150(2):373.
[10]吴红丽,余建军,鲍山林,等.996例纤维乳管镜诊治分析[J].中国微创外科杂志,2012,12(11):1000.
[11]任毅,韩学东,甄林林.不同性状乳头溢液与乳管内病变的相关性探讨[J].中国现代医药杂志,2014,16(7):48.
[12]邵稳喜,章佳新,祝玉祥,等.乳头溢液306例病因分析及治疗策略[J].临床误诊误治,2010,23(1),61.
[13]Tekin E,Akin M,Kurukahvecioglu O,et al.The value of breast ductoscopy in radiologically negative spontaneous/persistent nipple discharge[J].Breast J,2009,15(4):329.
[14]Patel B K,Falcon S,Drukteinis J.Management of Nipple Discharge and the Associated Imaging Findings[J].Am J Med,2015,128(4):353.
[15]Kamali S,Bender O,Aydin M T,et al.Ductoscopy in the evaluation and management of nipple discharge[J].Ann Surg Oncol,2010,17(3):778.
