水分胁迫对黔金荞麦1 号生理特性的影响
2015-02-28赵丽丽向清华
赵丽丽, 向清华 , 张 文, 杨 芳
(1.贵州大学 动物科学学院草业科学系, 贵州 贵阳 550025; 2.贵州省畜牧兽医研究所, 贵州 贵阳 550005; 3.贵州省草原监理站, 贵州 贵阳 550002; 4.六盘水市农委兽药饲料监察所, 贵州 六盘水 553001)
水分胁迫对黔金荞麦1 号生理特性的影响
赵丽丽1, 向清华2 *, 张 文3, 杨 芳4
(1.贵州大学 动物科学学院草业科学系, 贵州 贵阳 550025; 2.贵州省畜牧兽医研究所, 贵州 贵阳 550005; 3.贵州省草原监理站, 贵州 贵阳 550002; 4.六盘水市农委兽药饲料监察所, 贵州 六盘水 553001)
为探索黔金荞麦1号(FagopyrumdibotrysCV.Qianjin No.1)对水分胁迫的适应机制,加快金荞麦育成品种的推广利用,以黔金荞麦1号为试验材料,采用室内盆栽模拟水分胁迫,测定分析了水分胁迫下育成品种主要生理指标的变化情况。结果表明:正常水分条件下,各指标无显著变化。处理组黔金荞麦1号的电导率、丙二醛(MDA)和可溶性糖(SS)含量及过氧化物(POD)和过氧化氢(CAT)酶活性随水分胁迫强度的增加而升高,脯氨酸(Pro)含量、超氧化物歧化(SOD)酶活性和水分利用效率随水分胁迫强度的增加呈先升高后降低的趋势,净光合速率、气孔导度和蒸腾速率呈降低趋势。轻、中度水分胁迫时,黔金荞麦1号能够通过调节自身的渗透调节物质含量和保护酶活性来减轻水分胁迫伤害,维持植株的正常生理代谢功能。重度水分胁迫时,渗透调节能力和保护酶活性减弱,细胞膜受伤害程度增强,光合能力降低。
黔金荞麦1号; 水分胁迫; 生理指标
土壤水分是植物生存、生长和发育的主要限制因子,对植物的危害在所有非生物危害中占首位[1]。长期以来,科研工作者为在水分胁迫生境下获得较高品质和理想产量,对植物的抗旱性进行了广泛的研究。有研究表明,不同种甚至同一种内不同品种间植物的抗旱适应能力和方式不同[2]。为更好地利用植物资源有必要对植物的抗旱机理进行研究。
黔金荞麦1号(FagopyrumdibotrysQian jin No.1)是贵州省畜牧兽医研究所以贵州黔中地区野生金荞麦为原始材料培育而成的牧草新品种[3]。该品种具有块状根茎入土深、适应性强、生长快、产量和营养价值高、兼具药用价值等特点,现已成为贵州省畜牧业生产和石漠化综合治理的优良多年生牧草。目前,关于金荞麦抗旱性的研究报道较少。为探索黔金荞麦1号对水分胁迫的适应机制,加快金荞麦育成品种的推广利用,试验通过室内盆栽模拟水分胁迫,以黔金荞麦1号为试验材料,研究水分胁迫对金荞麦育成品种叶片电导率,丙二醛(MDA)、脯氨酸(Pro)和可溶性糖(SS)含量,SOD、POD和 CAT等保护酶活性以及光合参数的影响,旨在探讨黔金荞麦1号的抗旱机制,为制定提高黔金荞麦1号抗旱性的技术措施提供理论依据。
1 材料与方法
1.1 试验材料与处理
黔金荞麦1号(黔审草2012001)是贵州省畜牧兽医研究所于2012年育成的省级新品种。在田间选择大小一致的黔金荞麦1号块根播种于由河沙、蛭石、腐殖质土按1∶1∶3比例混合的花盆中,每盆3株。在温室内经过2个月的日常管理后,选择长势(株高15~20 cm)良好、大小基本一致的植株进行处理。设对照组和处理组。对照组正常浇水,处理组实行连续干旱,在处理开始、第10天、第20天和第30天分别取3盆采样测定各指标。同时取土样测定土壤含水量,利用公式计算土壤相对含水量(RWC):RWC=土壤含水量/田间持水量×100%。根据潘昕等[4]方法设定土壤相对含水量在80%以上为正常水平,50%~70%为轻度干旱,30%~50%为中度干旱,低于30%为重度干旱。各取样时期土壤相对含水量情况见表1。

表1 黔金荞麦1号的盆栽土壤相对含水量(RWC)
1.2 测定项目及方法
电导率、丙二醛(MDA)含量、脯氨酸(Pro)和可溶性糖(SS)含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性指标分别采用雷磁DDSJ-308A型电导仪、硫代巴比妥酸(TBA)显色法、酸性茚三酮法、蒽酮法、NBT光化还原法、愈创木酚氧化法和紫外分光光度法测定[5-6],每个处理3次重复。
光合指标包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和水分利用效率(WUE)等,采用LI-Cor 6400-15透明叶室,于上午10: 00选取金荞麦中部中等大小的健康叶片进行测定。其中水分利用效率WUE=Pn/Tr。每个处理3次重复。
1.3 数据处理与统计分析
采用SPSS(13.0)统计分析数据,显著水平为P<0.05。
2 结果与分析
2.1 水分胁迫黔金荞麦1号的叶片电导率及丙二醛含量
随处理时间的延长,对照组叶片电导率和MDA含量无显著变化,处理组2个指标均逐渐增加(图1)。轻、中度水分胁迫下,电导率和MDA含量增加幅度较小。当水分胁迫达到重度时,电导率和MDA含量均显著增加,分别为开始时的2.94倍和1.98倍。
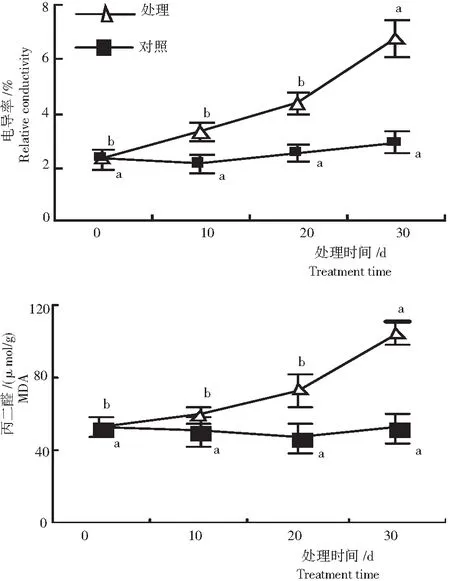
注:不同字母表示在0.05水平上差异显著,下同。
Note:Different letters indicated significance of difference at 0.05 level. The same below.
图1 水分胁迫黔金荞麦1号的叶片电导率和丙二醛含量
Fig.1 Relative conductivity and MDA content in leaves under water stress
2.2 水分胁迫黔金荞麦1号的叶片脯氨酸和可溶性糖含量
随处理时间的延长,对照组叶片脯氨酸(Pro)和可溶性糖(SS)含量无显著变化,处理组Pro含量呈先增加后降低的变化趋势,而SS含量迅速增加(图2)。轻度水分胁迫时,Pro含量增加幅度较小;中度水分胁迫时,Pro含量增加到最大值,6.901 μg/g;重度胁迫时,叶片Pro含量较中度水分胁迫时显著降低。轻、中度水分胁迫时,叶片SS含量分别为处理开始时的2.60和5.15倍;重度水分胁迫时,叶片SS积累量达最大值,为89.01 mg/g;4个处理梯度间SS含量差异均达到显著水平。
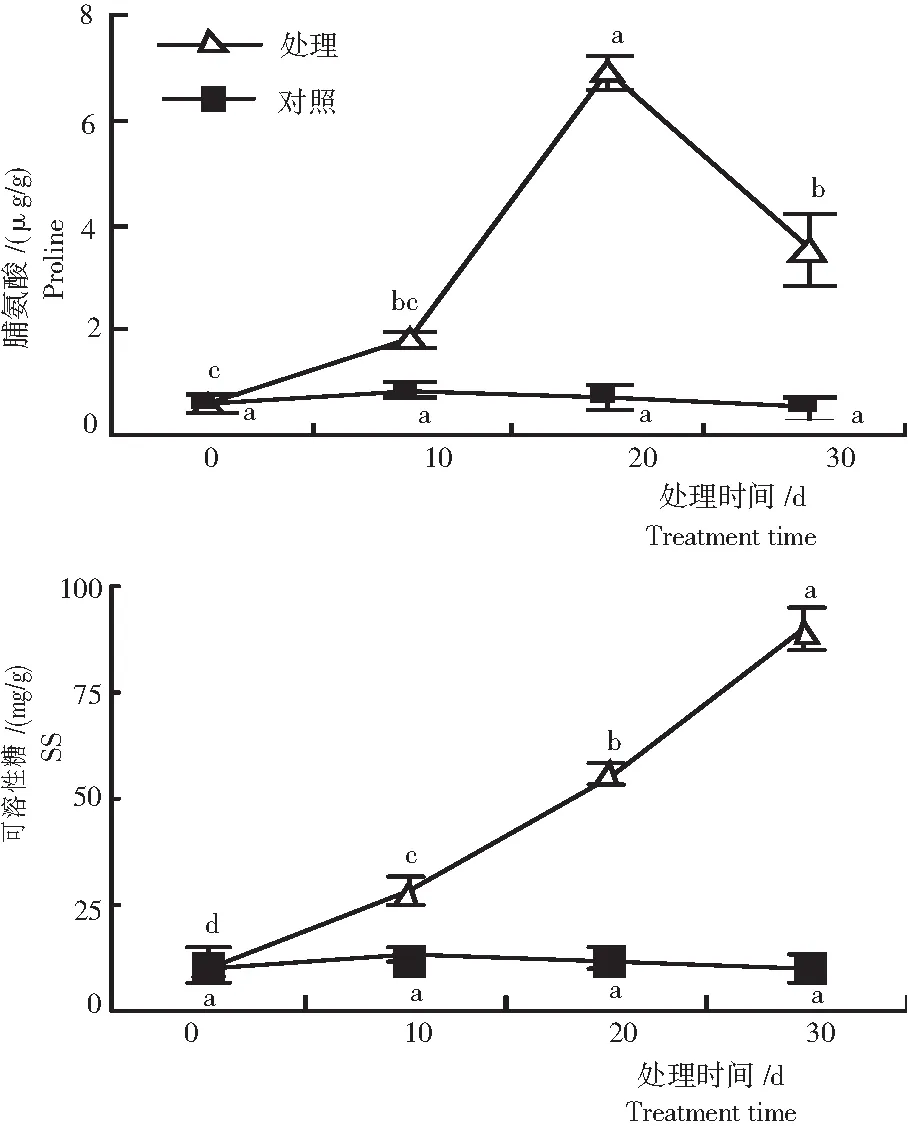
图2 水分胁迫黔金荞麦1号的叶片脯氨酸含量和可溶性糖含量
Fig.2 Proline and soluble sugar contents in leaves under water stress
2.3 水分胁迫黔金荞麦1号的叶片SOD、POD和CAT酶活性
随处理时间的延长,对照组叶片SOD、POD和CAT酶活性无显著变化,处理组SOD酶活性先升高后降低,POD和CAT酶活性均增加(图3)。中度水分胁迫时,叶片SOD酶活性最高,为240.00 U/g,显著高于处理开始时和另外2个处理梯度。重度水分胁迫时,叶片SOD酶活性迅速降低到135.00 U/g,与轻度胁迫处理的值无显著差异。叶片POD酶活性在轻度水分胁迫时增加幅度较小;中度胁迫时,POD酶活性显著升高,重度胁迫时达最大值,为400.18 U/g。而叶片CAT酶活性在轻度水分胁迫时即显著增加,且各处理梯度间差异均达到显著水平,在重度水分胁迫时,CAT酶活性达最大,为405.45 U/g。
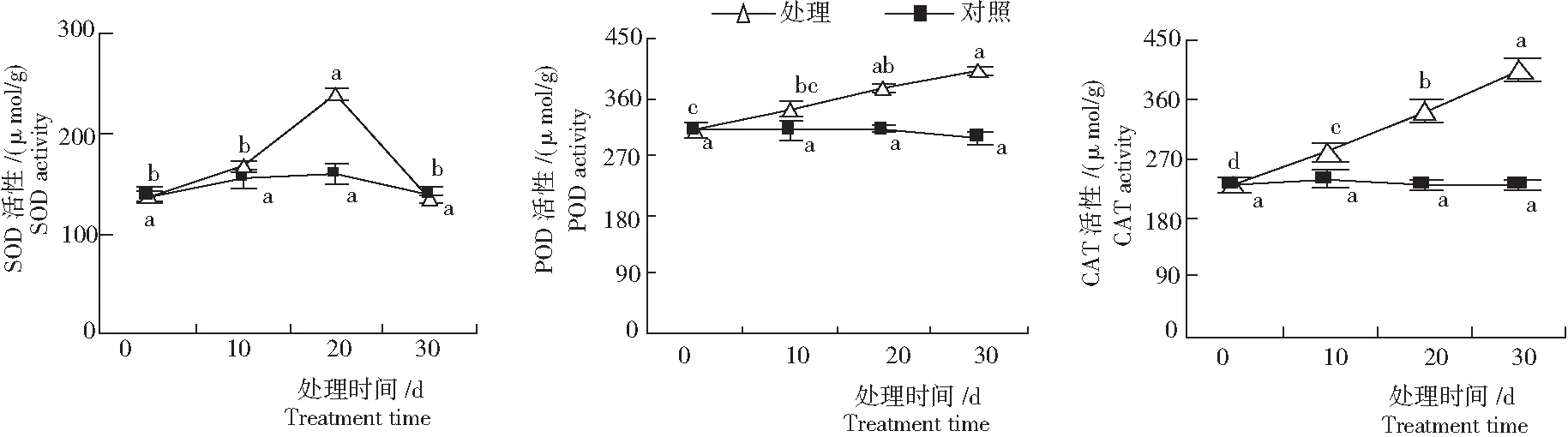
图3 水分胁迫黔金荞麦1号的叶片SOD、POD和CAT酶活性

处理时间TreatmentTime净光合速率/[μmol/(m2·s)]Pn对照处理气孔导度/[mmol/(m2·s)]Gs对照处理蒸腾速率/[mmol/(m2·s)]Tr对照处理水分利用效率/(μmolCO2/mmolH2O)WUE对照处理04.79±3.46a14.98±1.06a0.48±0.06a0.48±0.05a6.09±0.96a6.09±0.36a2.46±0.74a2.46±0.14a1014.53±3.38a13.67±0.93a0.49±0.04a0.43±0.04a6.20±0.79a5.38±0.31b2.34±0.26a2.54±0.11a2015.07±3.45a10.40±0.49b0.49±0.05a0.36±0.02b6.12±0.88a4.73±0.26c2.46±0.53a2.20±0.20b3015.14±3.06a6.06±1.17c0.42±0.06a0.28±0.03c6.07±0.85a4.19±0.30d2.49±0.36a1.45±0.21c
2.4 水分胁迫对叶片光合参数的影响
由表2可知,随处理时间的延长,对照组叶片净光合速(Pn)、气孔导度(Gs)和蒸腾速率(Tr)无显著变化,处理组3个指标均呈降低趋势。Pn和Gs在中度水分胁迫时显著降低,Tr在轻度水分胁迫时显著降低,均在重度胁迫时降低为最小值,分别为处理开始时的40.45%、58.33%和68.80%。水分利用效率(WUE)在轻度水分胁迫时增加,为处理开始时的1.03倍,差异未达显著水平;中度、重度水分胁迫时,WUE均显著降低,分别为处理开始时的89.43%和58.94%。
3 讨论与结论
细胞膜是植物感受环境胁迫最敏感的部位,当植物受到不良环境影响时,细胞的内含物会不同程度外渗而引起细胞膜透性改变[7]。丙二醛(MDA)是植物在逆境下遭受伤害脂膜过氧化最重要的产物之一[8]。刘济明等研究了水分胁迫下小蓬竹的生理生化特性,指出水分胁迫下细胞膜受伤害和细胞膜过氧化程度可反映植物原生质膜的受害强度[9]。王齐等对干旱胁迫下结缕草的生理变化研究指出,相对电导率和丙二醛含量在水分胁迫处理期整体呈上升趋势,且随水分胁迫的增加而增大[10]。试验中,黔金荞麦1号随水分胁迫时间延长,对照组的叶片电导率和MDA含量均无显著变化,而处理组2个指标则逐渐增加,在重度水分胁迫时显著增加,说明水分胁迫使黔金荞麦1号叶片的原生质膜受到伤害,但轻、中度水分胁迫细胞膜受害较轻,重度胁迫时则受到严重的伤害。
逆境下,植物通过增加胞内溶质浓度,降低渗透势达到从外界吸水从而维持一定的膨压,保证正常的代谢活动[11]。脯氨酸和可溶性糖是渗透调节中最重要的溶质[12-13]。包文龙等对水分胁迫下硬质早熟禾细胞内渗透调节物质的研究指出水分胁迫下植物体内脯氨酸和可溶性糖大量累积,有利于细胞保持较高的水势,增强了细胞吸水能力,并减少水分向外散失;但脯氨酸和可溶性糖的渗透调节能力不同,可溶性糖的渗透调节能力强于脯氨酸[14]。本研究中,黔金荞麦1号叶片脯氨酸含量在轻度水分胁迫时增加幅度较小,渗透调节能力较弱;中度水分胁迫时渗透调节能力增强,达最大值;重度水分胁迫时渗透调节能力降低。叶片可溶性糖在轻度水分胁迫时增加幅度即达显著水平,表现出较高渗透调节能力,随胁迫强度增加,到重度水分胁迫时渗透调节能力继续增加。由此可知,水分胁迫下,黔金荞麦1号叶片可溶性糖的渗透调节能力强于脯氨酸。这与包文龙[14]的研究结果一致,与安玉艳[15]对干旱胁迫下杠柳幼苗的研究结果不一致,可能与不同植物对干旱的适应机制不同有关。
逆境下,植物体内为保护自身免受氧化伤害形成一套相应的抗氧化保护酶系统(如SOD、POD和CAT等)来保护植物细胞膜和敏感分子免受活性氧的伤害[16]。本研究表明,随水分胁迫强度增加,黔金荞麦1号叶片SOD酶活性先增加后降低,在中度水分胁迫时达最大值;POD和CAT酶活性则一直处于上升状态,POD和CAT酶活性分别在中度和轻度水分胁迫时显著增加。说明,水分胁迫下黔金荞麦1号体内产生了大量ROS(活性氧簇),致使保护酶活性增加,中度水分胁迫时SOD、POD和CAT酶活性较强,3种酶协同作用将超氧阴离子歧化成H2O2和O2后,进一步将H2O2催化分解成H2O和O2,减小水分胁迫对植株细胞的损伤[17-18]。但重度水分胁迫时,酶的保护作用遭到破坏,表现为SOD酶活性降低,此时起作用的是CAT和POD酶。
光合作用是植株生长的生理基础,可以反映植株生长势和对水分胁迫的适应性强弱[19]。轻度水分胁迫时,黔金荞麦1号的净光合速率和气孔导度的下降幅度较小,蒸腾速率的降幅较大,差异达显著水平,水分利用效率略有增加,说明轻度水分胁迫时,黔金荞麦1号通过降低蒸腾速率,提高对水分的利用效率。但中、重度水分胁迫时,黔金荞麦1号的叶片光合机构遭到破坏,造成叶肉细胞气孔扩散阻力增加,Rubisco 酶对 CO2的亲和力降低,碳同化能力下降,净光合速率降低。
由此可见,黔金荞麦1号品种在轻、中度水分胁迫时能够通过调节自身的渗透调节物质含量和保护酶活性来减轻水分胁迫伤害,维持植株的正常生理代谢功能;重度水分胁迫时,渗透调节能力和保护酶活性减弱,细胞膜受伤害程度增强,光合能力降低。
[1] 蔡丽平,吴鹏飞,侯晓龙,等.干旱胁迫对水土保持先锋植物类芦光合特性的影响[J].水土保持学报,2011,25(6):237-241.
[2] 李 源,谢 楠,赵海明,等.不同高丹草品种对干旱胁迫的响应及抗旱性评价[J].草地学报,2010,18(6):891-896.
[3] 向清华,陈 莹,陈燕萍,等.黔金荞麦 1号种子生产技术规程[J].种子,2014,33(3):108-110.
[4] 潘 昕,邱 权,李吉跃,等. 干旱胁迫对青藏高原6种植物生理指标的影响[J]. 生态学报,2014,34(13):3558-3567.
[5] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[6] 邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000.
[7] 谢演峰,沈惠娟,罗 珍,等. 南方7个造林树种幼苗抗旱生理指标的比较[J]. 南京林业大学学报,1999,23(4):13-16.
[8] 王智威,牟思维,闫丽丽,等.水分胁迫对春播玉米苗期生长及其生理生化特性的影响[J]. 西北植物学报,2013,33(2):343-351.
[9] 刘济明,李 鹏,廖小锋,等.干旱胁迫对小蓬竹生理生化特性的影响 [J].西北农业学报,2013,22(9):153-157.
[10] 王 齐,孙吉雄,安 渊.水分胁迫对结缕草种群特征和生理特性的影响[J].草业学报,2009,18(2):33-38.
[11] 吉雪花,郑 群,李 格,等. 水分胁迫对瓜尔豆生长和生理性状的影响[J].干旱地区农业研究,2014,32(3):39-44.
[12] 吴 迪,龙秀琴,唐金刚,等. 干旱胁迫对3种藤本植物抗旱生理特性的影响[J]. 贵州农业科学,2013,41(6):69-71.
[13] 马旭凤. 水分亏缺对玉米生理指标、形态特性及解剖结构的影响[D]. 陕西杨陵:西北农林科技大学,2010.
[14] 包文龙,张楚涵,陈雅君,等.干旱胁迫及复水对硬质早熟禾细胞内渗透调节物质的影响[J].黑龙江农业科学,2014(3):84-87.
[15] 安玉艳,梁宗锁,郝文芳,等.杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J].生态学报,2011,31(3):716-725.
[16] 尹宝重,王 艳,张月辰,等. 干旱胁迫对红小豆苗期生理生化特性的影响[J].贵州农业科学,2011,39(7):65-67.
[17] 李龙梅,王毅承,严海鸥.二月兰对水分胁迫生理生化的响应[J].内蒙古农业大学学报,2012,33(2):34-36.
[18] 王丽丽,孙海龙,李 强,等. 水分胁迫对黄荆叶片生理生化特性的影响[J].广西农业科学,2008,39(2):152-154.
[19] 张仁和,薛吉全,浦 军,等.干旱胁迫对玉米苗期植株生长和光合特性的影响[J].作物学报,2011,37(3):521-528.
(责任编辑: 孙小岚)
Effects of Water Stress on Physiological Characteristics ofFagopyrumdibotrysCV. Qianjin No.1
ZHAO Lili1, XIANG Qinghua2*, ZHANG Wen3, YANG Fang4
(1.DepartmentofGrasslandScience,CollegeofAnimalScience,GuizhouUniversity,Guiyang,Guizhou550025; 2.GuizhouInstituteofAnimalHusbandryandVeterinary,Guiyang,Guizhou550005; 3.GuizhouGrassSuperviseStation,Guiyang,Guizhou550002; 4.InstituteofVeterinaryDrugandFeedControl,LiupanshuiAgricultureCommittee,Liupanshui,Guizhou553001,China)
In order to explore the drought resistance mechanism and accelerate the utilization and extension of bred variety, UsingF.dibotrysCV. Qianjin No.1 as experimental materials, the cell injury rate, MDA content, proline content, soluble sugar content, SOD activity, POD activity and CAT activity were investigated under water stress in pool cultivation. The results showed that there was no significant change in all of indexes. With the prolongation of treatment time,the injury rate,MDA content, soluble sugar(SS), the activities of peroxidase(POD) and catalase(CAT) increased. The proline content (Pro), superoxide dismutase(SOD) and water use efficiency increased in the beginning and decreased at last. The net photosynthetic rate, stomatal conductance and transpiration rate decreased. Based on the results,F.dibotrysCV. Qianjin No.1 could endure and adapt to the low-grade and middle-grade water stress through increasing the content of osmotic substances and coordinating the activity of protective enzymes. Under high-grade water stress, the ability of osmotic adjustment and the activity of protective enzymes weakened, the cell membrane injured seriously, the photosynthetic capacity decreased.
FagopyrumdibotrysCV. Qianjin No.1; water stress; physiological indicators
2014-10-15; 2014-03-14修回
贵州省科技厅农业攻关项目[黔科合NY字(2011)3102];贵州省科技成果重点推广计划[黔科合成字(2013)5084];贵州省动植物育种专项[黔农育专字(2012)018];贵州大学引进人才科研项目[贵大人基合字(2010)036]
赵丽丽(1981-),女,副教授,博士,从事牧草种质资源及育种研究。E-mail:zhaolili_0508@163.com
*通讯作者:向清华(1974-),女,高级经济师,从事畜牧经济研究。E-mail:770234274@qq.com
1001-3601(2015)05-0233-0045-05
S517; Q945.11
A
