应用克隆文库构建法分析马铃薯块茎形成期根系AMF菌群组成
2015-02-28夏体渊陈丽娟杨瑞萍王定康
任 禛, 韩 丽, 夏体渊, 陈丽娟, 杨瑞萍, 王定康
(1.昆明学院 农学院, 云南 昆明 650214; 2.云南省高校 都市型现代农业工程研究中心, 云南 昆明 650214; 3.昆明学院 生命科学与技术系, 云南 昆明 650214)
应用克隆文库构建法分析马铃薯块茎形成期根系AMF菌群组成
任 禛1,2, 韩 丽1,2, 夏体渊1,2, 陈丽娟1,2, 杨瑞萍1, 王定康3*
(1.昆明学院 农学院, 云南 昆明 650214; 2.云南省高校 都市型现代农业工程研究中心, 云南 昆明 650214; 3.昆明学院 生命科学与技术系, 云南 昆明 650214)
为弄清马铃薯生产中丛枝菌根真菌的作用,随机采取马铃薯块茎形成期的根系样品,以DNA提取产物为基础,Nested-PCR扩增目的片段,利用该产物构建AMF部分18S rRNA基因克隆文库,运用ARDRA筛选、DNA测序和系统发育树等方法分析丛枝菌根真菌的结构组成。结果表明:文库Coverage C值为89.7%,但Rarefaction曲线不够饱和;获得的8个AMF类型均与免培养的球囊霉属克隆序列相似度较高,其中Seq2、Seq3、Seq5和Seq8代表的摩西球囊霉(Glomusmosseae)、幼套球囊霉(Glomusetunicatum)、近明球囊霉(Glomusclaroideum)和地表球囊霉(Glomusversifome)分类地位较为清晰,其余序列可能代表的球囊霉属较新种类。
丛枝菌根真菌; 马铃薯; 18S rRNA基因; 克隆文库; 系统发育树
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是一类广泛存在于农田生态系统中的异养微生物,能够侵染大多数植物根系并形成菌根结构,这种共生体的建立对植物的生长发育具有重要意义[1]。关于AMF在植物上的应用已有较多报道,大量试验证实[2-4],AM真菌侵入植物根系后,能够改变根系构型,提高光合作用,促进植物对营养元素的吸收利用,并能提高植株对病原菌、重金属、高盐和弱光等不良胁迫的耐受性,从而改善品质提高产量。同时,AMF在修复污染土壤,提高幼苗移栽成活率方面也具有积极作用[5-6]。丛枝菌根真菌在农业生态系统中起重要作用[7]。因此,AMF是一类宝贵的微生物资源,在植物学和生态学研究中其功能作用不可忽略。了解某种植物根围AMF组成和结构是研究其功能作用的基础工作,可为筛选优势或功能型的AMF类型提供参考。
丛枝菌根真菌需与植物共生后才能完成生活史,因此难以进行分离培养,这为其多样性研究带来一定困难。而传统上依赖于形态学观察和特定物质测定的方法已无法满足AMF研究的需要。近年来,以真菌微生物核糖体基因分析为基础,设计AMF特异引物,经PCR扩增后,结合DGGE、AFLP、DNA测序和系统发育树分析等分子生物学方法,为植物根际或根系AMF组成结构的研究提供了新思路和新技术。在多种方法中,AMF部分18S rRNA基因克隆文库构建是准确揭示其多样性和组成结构的重要方法之一,已被广泛应用到洋葱、夏枯草、旱生植物、荻草、满天星和玉米等植物上[8-12]。目前国外对此方面的报道较多,而国内较少。特定片段克隆文库的构建为探索植物根围AMF的多样性提供了帮助。
关于AMF在马铃薯生产上应用的报道较少,但不同菌根菌剂对其不同时期营养元素的促进作用已被证实[13],并且不同菌剂对植株生物量的提高作用亦被揭示[14]。在农业生态系统中,AMF与植物共生关系的建立具有复杂性,在综合因素的影响下,马铃薯根系可能存在多种AMF类型,准确探索其组成可为揭示AMF功能作用奠定基础。马铃薯块茎形成期是植物整个生长周期的关键时期,直接决定最终产量,探明此时期植株根系的AMF组成具有实际意义。笔者通过构建马铃薯块茎形成期根系AMF部分18S rRNA基因克隆文库,了解此生长阶段根系优势和AMF组成,初步揭示对马铃薯产量具有重要作用的AMF类型,也为多种菌剂在实际生产中的开发利用奠定基础。
1 材料与方法
1.1 试验材料
马铃薯品种为合作88号,在富源县农业技术推广中心购买。
1.2 试验设计
于2013年4月在昆明学院观物山上播种马铃薯,常规水肥管理,植株生长至60 d时(块茎形成期)随机选取3株采集根系。取样时将植株连根拔起,剪除地上部,抖掉附着土壤,用自来水清洗泥土,纱布擦拭根系水分后剪成0.1 cm的根段备用。
1.3 DNA提取
将3株植物根系充分混匀,随机称取2 g用于DNA提取,参照任禛等[11]方法,DNA产物经检测后进行巢式PCR扩增。
1.4 巢式PCR扩增
DNA经适当稀释后进行PCR扩增,第1次和第2次扩增反应体系一致,反应条件不同,具体引物见表1[12]。第一次采用真菌18S rRNA基因通用引物GeoA2和Geo11,产物长度1.8 kb,反应体系参照常规,保证模板DNA量为0.2~1 μg。反应程序为95℃预变性5 min;95℃变性1 min,57℃退火1 min,72℃延伸2 min,30个循环,72℃延伸10 min。扩增产物经电泳检测后进行2次PCR扩增,扩增引物为菌根真菌特异混合引物(AM1,AM2,AM3)和NS31,产物长度550 bp。反应程序为95℃预变性5 min;95℃变性45 s,65℃退火1 min,72℃延伸2 min,30个循环,72℃延伸10 min。PCR产物经胶回收试剂盒纯化后用于后续克隆文库构建。
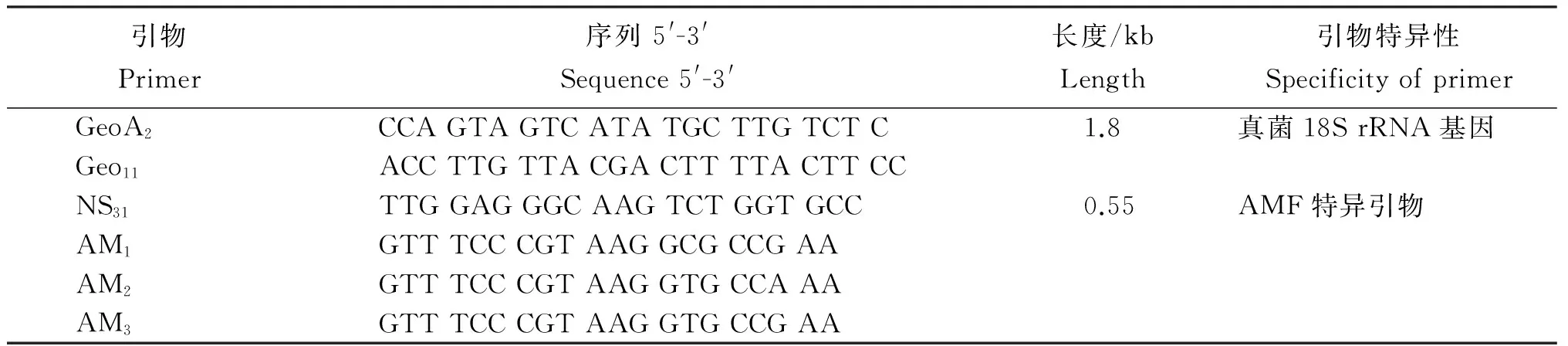
表1 马铃薯根系的巢式PCR引物
1.5 克隆文库构建、阳性克隆子确定与酶切筛选
采用Takara pMD 18-T Vector克隆试剂盒对PCR产物进行连接反应,产物转入感受态细胞JM109,转化后产物涂布于含青霉素、X-Gal和IPTG的平板中隔夜培养,待菌落长到合适大小,随机挑选35个白色克隆子在LB培养基中扩大培养,收集菌体抽提质粒,PCR排除假阳性克隆子,最终确定30个阳性克隆子。分别用HinfⅠ和TaqⅠ进行酶切筛选,2个酶切图谱一致的克隆子归为1个OTU,每个OTU选择代表性克隆子测序。
1.6 系统发育树的构建
在GenBank数据库的BLAST程序中对测序序列进行相似性搜索,寻找相似度较高的序列构建系统发育树,采用Clustal X 1.8软件进行完全对比,并用Mega 3.0软件分析,采用邻位相邻法(Neighbor-Joining)构建系统进化树。
1.7 克隆文库评价及多样性计算
采用库容值计算以及稀有饱和度曲线绘制评价文库大小。库容值Coverage C计算公式为C=[1-(n/N)]×100,其中n代表仅有单个克隆子的OTU数,N为总克隆数目[15]。稀有饱和度曲线Rarefaction Curve采用Analytic Rarefaction Version 1.3软件绘制[16]。运用SPADE软件计算文库Shannon-Wiener和Simpson指数[11]。
2 结果与分析
2.1 马铃薯根DNA提取和PCR扩增
由图1可见,提取DNA产物经电泳检测后在21 kb处获得明亮单一条带,说明提取的纯度和浓度较为理想,满足试验要求。以DNA为模板经第1次PCR扩增后,在1.8 kb处获得目的片段,与预期结果一致。上述PCR产物可直接用于2次扩增,成功获得0.5 kb目的产物,且电泳检测结果单一明亮。终产物连接到pMD 18-T载体中,转入JM109构建马铃薯根系AMF克隆文库。
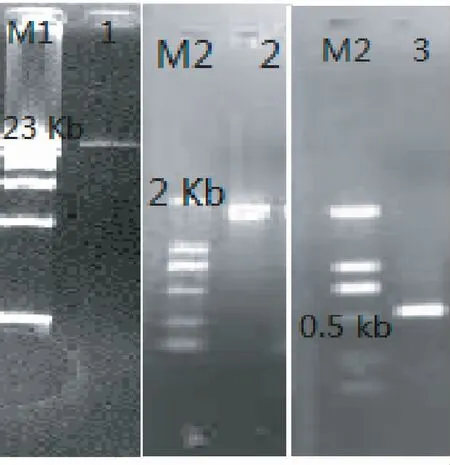
注:M1为λ-HindⅢ digest DNA Marker,M2为DL2000 Marker,泳道1为DNA提取结果,泳道2为第1次PCR结果,泳道3为第2次PCR结果。
Note:M1:λ-Hind Ⅲ digest DNA Marker,M2:DL2000 Marker;Lane 1:The results of DNA extraction;Lane 2:The results of first Nested-PCR;Lane 3:The results of second Nested-PCR.
图1 马铃薯DNA提取与巢式PCR图谱
Fig.1 The results of DNA extraction and Nested-PCR
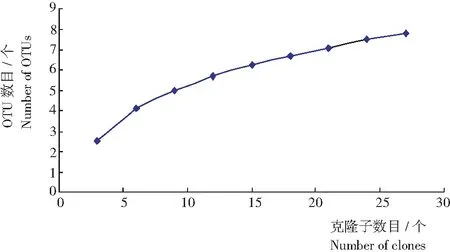
图2 AMF克隆文库的稀有饱和度曲线
2.2 阳性克隆子鉴定及ARDRA结果
经酶切分析共获得9种差异图谱,每种图谱选择代表克隆子测序。测序结果发现,有1个序列(对应1个克隆子)为马铃薯未知基因序列,其余8个序列(对应29个克隆子)均为AMF 18S rRNA基因序列。
2.3 克隆文库评价及多样性指数
通过计算,马铃薯根系AMF克隆文库的Coverage C值为89.7%。Rarefaction曲线结果表明(图2),文库中的OTU数目随着克隆数目的增加仍呈上升趋势,说明文库大小对马铃薯根系AMF类群组成虽有一定反映,但仍不够饱和,需加大克隆子数目,增加文库包含的AMF类型。经SPADE计算,文库的Shannon-Wiener和Simpson指数分别为1.91和0.19。
2.4 AMF序列的系统发育树
经BLAST分析,在GenBank中,代表不同OTU类型的8个差异序列均与免培养的克隆序列相似度最高(表2)。筛选亲缘关系最近的序列构建系统进化树(图3),8个目的序列被划分为2大类群,序列Seq2、Seq4、Seq5、Seq6和Seq7聚集在一大分支上,而Seq1、Seq3和Seq8序列聚集在一个小分支上。从序列代表类型来看,全部序列均为球囊霉属的种类,其中Seq2、Seq3、Seq5和Seq8的分类地位较为清晰,而其余序列均与球囊霉属未知序列关系较近,可能代表该属较为新颖的类型。
具体分析系统发育树,Seq2与摩西球囊霉(Glomusmosseae) BEG12聚集在一起,两者的同源性高达99%以上,可见Seq2代表该种类型;Seq3与2个幼套球囊霉(Glomusetunicatum)序列聚集在一小分支上,且相似性较高,同源性达99%以上,说明Seq3应为幼套球囊霉;虽然Seq5与GenBank中的未知球囊霉属的克隆子相似性较高,但在系统进化树中与近明球囊霉(Glomusclaroideum)免培养克隆子的相似度亦较高,Seq5应为近明球囊霉;Seq8分类地位非常清晰,单独与2个地表球囊霉(Glomusversiforme)克隆子聚集在一起,且与地表球囊霉克隆2相似性最高,接近100%,因此该序列代表的是地表球囊霉;Seq1、Seq4、Seq6和Seq7均与球囊霉属克隆子关系最近,但准确分类地位不清楚。
从8个序列对应的克隆子数目来看,Seq1和Seq2应为文库中的主要类群,应是侵袭马铃薯根系的主要AMF种类,Seq3和Seq8代表着文库中较为常见的类型,而Seq4、Seq5、Seq6和Seq7代表的克隆子较少为1~2个,为马铃薯根系中鲜少的AMF类型。

表2 AMF克隆文库序列的相似菌种
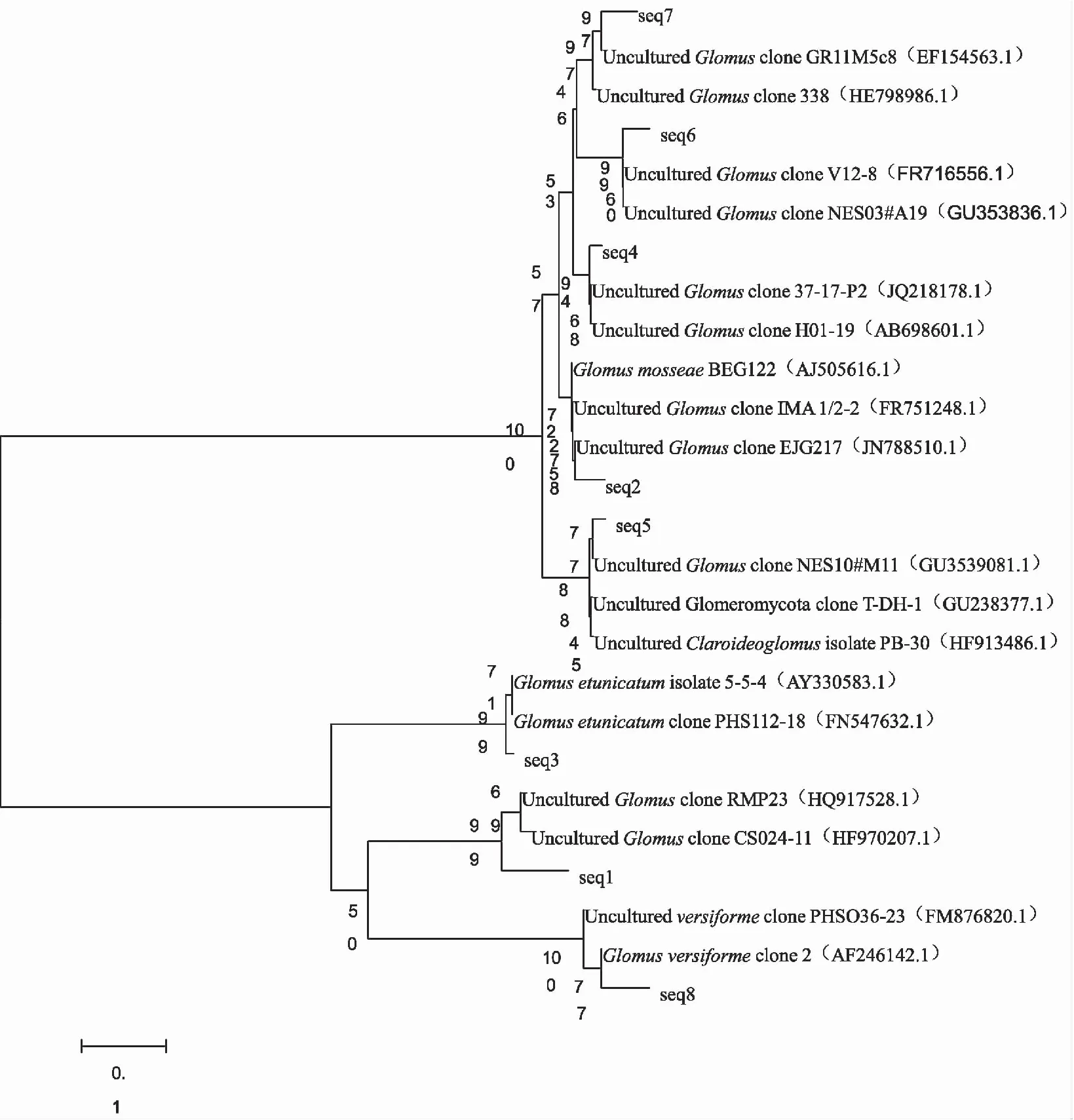
图3 AMF部分18S rRNA基因系统发育树
Fig.3 Phylogenetic tree of AMF partial 18S rRNA gene
3 结论与讨论
AMF在农业生态系统中的作用已被广泛证实,调查农作物根系AMF的组成和结构是研究其具体功能作用的基础工作。传统上,一般主要通过植物根部染色再进行显微形态观察辨别AMF种类,但AMF微生物种属之间并无明显的结构差异,只能初步判断AMF类群组成,难以鉴定到具体种类,且无从准确统计某种AMF的数量[17]。近年来,利用分子生物学技术,以根系DNA提取为基础,通过AMF特异引物扩增目的片段,借助DGGE、AFLP和克隆文库构建等方法分离差异AMF类型,再结合测序技术,可直观的从分子水平上识别AMF种类[11,18-19]。相比之下,分子技术具有高效、客观和可重复性强的特点。在几种分子生物学方法中,克隆文库构建法能够克服DGGE条带分离不明显、研究基因太短的局限,又能克服AFLP灵敏度不高、结果不清晰的缺点,是研究AMF多样性的理想方法。
马铃薯根系AMF克隆文库中共检测到8个差异序列,除Seq2、Seq3、Seq5和Seq8代表的摩西球囊霉、幼套球囊霉、近明球囊霉和地表球囊霉外,其余序列都与AMF未知克隆子序列的相似度较高,可能代表的是较为新颖的类型,在玉米[11]上亦发现了多种分类地位不清晰的AMF种类。国外有研究采用克隆文库构建法在森林植物、旱生植物、夏枯草和荻草等植物上均发现了未知的AMF类型[10,12,20]。笔者认为,生态系统中的AM微生物的多样性远远超过人类的认知,生态系统的多元化和植物的多样性决定了AMF种类的复杂性。传统上的方法只认知小部分种类,要深入挖掘利用此类微生物资源,应对多种农业生态系统土壤和不同作物菌根进行研究,建立AMF资源库,并研究相应功能,为其在农业生产中的应用奠定基础。
系统发育树结果表明,8个序列全部为球囊霉属的特异序列,其中摩西球囊霉是马铃薯块茎形成期根系的主要类型,幼套球囊霉和地表球囊霉是常见种类,这与国内外相关报道较为一致。王玉峰等[13]和张功等[14]均研究不同AMF对马铃薯生长的影响发现,摩西球囊霉对马铃薯生物量和产量的促进作用最为明显,并且对其土壤的速效氮、磷和钾的改善作用亦优于其他AMF种类。笔者同样发现,摩西球囊霉是玉米根系的主要种类[11]。有综述表明[21],我国粮食作物根际土壤AMF类型以摩西球囊霉为主,而幼套球囊霉和地表球囊霉是较为常见的种类。国内外通过克隆文库构建法对玉米、大豆、洋葱和满天星等根系的研究表明,球囊霉属的AMF是侵染植物根系的主要类群,以摩西球囊霉最为普遍[8-9,11]。可见,摩西球囊霉普遍能与多种植物建立共生关系,是AMF的重要种类,其对植物的功能作用值得研究。
马铃薯块茎形成期是决定产量和质量的重要时期,此时植株对水分和营养元素的吸收水平直接影响块茎数量和大小,而此时丛枝菌根真菌的生态功能作用不可忽略。有研究证实AMF对马铃薯生长和产量的积极作用[13-14],结合本研究结果,笔者发现的8种AMF类型,尤其是摩西球囊霉,一般在苗期能侵染马铃薯植株,生长至块茎形成期这种共生关系趋于稳定,此时AM微生物大量的菌丝伸出根外,扩大了植物根系吸收面积,并能活化土壤中难溶解的磷元素,帮助植株吸收各种营养元素,最终对马铃薯的产量和品质产生积极影响。本文仅探讨了马铃薯块茎形成期根系的AMF组成,但不同的AMF种类间的关系是亟待研究的问题。
[1] Smith S E,Read D J.Mycorrhizal Symbiosis(2nd Ed.)[M].London:Academic Press,1997:4-160.
[2] 吕桂云,陈桂林.蔬菜作物VA菌根研究进展[J].河北农业大学学报,2001,24(1):99-103.
[3] 仝瑞建,刘雪琴,耿惠敏.丛枝菌根真菌对洛阳红牡丹苗期生长及矿质营养的影响[J].贵州农业科学,2010,38(10):104-106.
[4] 蔡柏岩,葛菁萍,接伟光,等.黄檗根围丛枝菌根真菌菌群组成[J].菌物学报,2009,28(4):512-520.
[5] Gosling P,Hodge A,Goodlass G, et al.Arbuscular mycorrhizal fungi and organic farming[J].Agriculture Ecosystems and Environment,2006,113:17-35.
[6] Postma W M,Olsson P A,Ursula F G. Root colonisation by arbuscular mycorrhizal, fine endophytic and dark septate fungi across a pH gradient in acid beech forests[J].Soil Biology & Biochemistry,2007,39:400-408.
[7] Requena N,Serrano E,Oc n A,et al.Plant signals and fungal perception during arbuscular mycorrhizal establishment[J].Phytochemistry,2007,68:33-40.
[8] Juan C S,Roger D F,Anders T.Seasonal dynamics of arbuscular fungi communities in roots in a seminatural grassland[J].Applied and Environment Microbiology,2007,73(17):5613-5623.
[9] Guillermo A,Galvan I P,Karin B.Molecular diversity of arbuscular mycorrhizal fungi in onion roots from organic and conventional farming systems in the Netherlands[J].Mycorrhiza,2009,19:317-328.
[10] Armelle G,Diederik V T,David A.Diversity of arbuscular mycorrhizal fungi colonising roots of the grass species Agrostis capillaries and Lolium perenne in a field experiment[J].Mycorrhiza,2004,14:111-117.
[11] 任 禛,王建武,冯远娇,等.应用克隆文库研究玉米根系AMF多样性方法的建立[J].玉米科学,2011,9(5):19-24.
[12] Alguacil M M,Roldan A,Torres M P,et al.Assessing the diversity of AM fungi in arid gypsophilous plant communities[J].Environmental Microbiology,2009,11(10):2649-2659.
[13] 王玉峰,孙 磊,李伟群,等.VA菌根真菌对马铃薯养分吸收的影响[J].北方园艺,2007,6:47-49.
[14] 张 功,旺 庆,峥 嵘,等.不同VA菌根真菌对马铃薯生长的影响[J].华北农学报,2001,16(4):115-118.
[15] Moyer C L,Tiedje J M,Dobbs F C. A computer-simulated restriction fragment length polymorphism analysis of bacterial small-subunit rRNA genes:efficacy of selected tetrameric restriction enzymes for studies of microbial diversity in nature[J].Applied and Environment Microbiology,1996,62(7):2501-2507.
[16] Ravenschlag K, Sahm K,Pernthaler J.High bacterial diversity in permanently cold marine sediments[J].Applied and Environment Microbiology,1999,65(9):3892-3989.
[17] Hart M M,Reader R J.Taxonomic basis for variation in colonization strategies of arbuscular mycorrhizal fungi[J].New Phytologist,2002,153(2):335-344.
[18] 龙良鲲,羊宋贞,姚 青,等.AM真菌DNA提取与PCR-DGGE分析[J].菌物学报,2005,24(4):564-569.
[19] 蔡邦平,陈俊愉,张启翔,等.梅根系丛枝菌根真菌AFLP分析[J].北京林业大学学报,2001,34(1):82-87.
[20] Vincent C,David R,Alain O,et al.Molecular analysis of arbuscular mycorrhizal community structure and spores distribution in tree-based intercropping and forest systems[J].Agriculture,Ecosystems and Environment,2009,131:32-39.
[21] 李桂贞,张德罡,杨富裕.粮食作物AM真菌研究进展[J].土壤肥料科学,2008,24(2):250-254.
(责任编辑: 刘忠丽)
Analysis on AMF Community Composition of Potato Roots at Tuber Formation Stage by Applying Clone Library Construction Method
REN Zhen1,2, HAN Li1,2, XIA Tiyuan1,2, CHEN Lijuan1,2, YANG Ruiping1, WANG Dingkang3*
(1.SchoolofAgriculture,KunmingCollege,Kunming,Yunnan650214; 2.UrbanModernAgriculturalEngineeringResearchCenter,CollegesandUniversitiesinYunnanProvice,Kunming,Yunnan650214; 3.LifeScienceandTechnologyDepartmant,Kunmingcollege,Kunming,Yunan650214,China)
In order to provide a reference for AMF applying in potato production, the roots of potato at the tuber formation stage were randomly sampled in this study. Based on the DNA extraction production, the purpose fragments were obtained by Nested-PCR. These DNA fragments were used to construct AMF partial 18S rRNA gene clone library. AMF community composition of potato roots were studied combining with ARDRA screening, DNA sequencing and phylogenetic tree analysis. These results show that the Coverage C value of library is 89.7%, but the rarefaction curve is not saturated enough. Eight AMF types show high similarity with unculturedGlomussequences. The taxonomic status of Seq2, Seq3, Seq5 and Seq8 are clear. These four sequences representGlomusmosseae,Glomusetunicatum,GlomusclaroideumandGlomusversifomerespectively. The remaining sequences may represent novelGlomusspecies.
AMF;potato; 18S rRNA gene;clone library;phylogenetic tree
2014-09-13; 2015-03-14修回
云南省应用基础研究自筹基金“Bt基因导入对玉米与AMF共生关系及其诱导青枯病抗性的研究”(2013FZ099);昆明学院人才引进基金“克隆文库构建法研究Bt棉对根系AMF多样性的影响”(YJL12002);昆明学院校级科研项目“缓解马铃薯水分胁迫压力的丛枝菌根筛选研究”(XJL14018);云南省高校优势特色重点学科(生态学)建设项目
任 禛(1983-),女,讲师,博士,从事农业生态学的教学和科研工作。E-mail:10067994@qq.com
*通讯作者:王定康(1966-),男,教授,从事植物生态学的教学与科研工作。E-mail:wdk117@163.com
1001-3601(2015)05-0229-0028-05
S532
A
