果蝇抗菌肽DiptericinA基因的原核表达及其抑菌活性
2015-02-28徐佳
徐 佳
(贵州民族大学, 贵州 贵阳 550025)
果蝇抗菌肽DiptericinA基因的原核表达及其抑菌活性
徐 佳
(贵州民族大学, 贵州 贵阳 550025)
为成功获得具有生物活性的Diptericin蛋白,利用RT-PCR方法从果蝇体内获得DiptericinA基因,经PCR、双酶切、序列测定等方法确认构建原核表达载体的正确性;重组质粒转化大肠杆菌BL21,Ampicillin抗性筛选工程菌株,经二步亲和层析纯化以及凝血酶切纯化后进行抑菌测验。结果表明:获得DiptericinA基因;成功构建原核表达载体;在大肠杆菌中实现Diptericin A-GST融合蛋白的胞内可溶性表达,表达量为315.4 mg/L;获得Diptericin A抗菌肽单体,纯度达90%;抑菌检测证明,Diptericin A对大肠杆菌具有明显抑制活性,且呈剂量依赖性。
DiptericinA; 原核表达; 抑菌活性; 果蝇; 原核表达
果蝇缺乏哺乳动物具有的获得性免疫系统,也无抗体和补体系统,但成虫果蝇却能成为酵母、细菌和真菌的传播载体,使有机体腐烂或变坏,这主要是因为果蝇的天然免疫系统可以抵制各种病原微生物的侵染[1]。果蝇免疫反应的一个重要特点是在受到病原微生物侵染或损伤时,脂肪体细胞能快速合成一些抗菌肽,这些分子分泌到血淋巴后能杀死入侵的病原微生物[2]。另外,果蝇的气管和上皮细胞等也能产生抗菌肽,而肠细胞和唾腺细胞等能产生溶菌酶和昆虫防御素等抗菌蛋白[3-5]。到目前为止,在果蝇基因组中已发现超过30种编码抗菌肽的基因,目前已有Attacin、Cecropin及Andropin[6-8]的表达研究,但对于成功获得具有生物活性的Diptericin尚未见报道。因此,笔者利用大肠杆菌表达系统对黑腹果蝇的天然抗菌肽Diptericin A进行表达,测定表达产物是否具有抑杀大肠杆菌的活性,为开发新型抗菌肽药物提供理论依据。
1 材料与方法
1.1 材料
黑腹果蝇(Drosophilamelanogaster)由上海大学生命科学学院饲养,大肠杆菌TOP10、大肠杆菌BL21和金黄色葡萄球菌ATCC6538由上海大学生命科学学院保存。
Ex.Taq酶、限制性核酸内切酶、T4DNA连接酶、RT-PCR试剂盒、小量胶回收试剂盒、小量质粒抽提试剂盒、原核载体pGEX-4T-1购自Takara,Trizol、Ampicillin试剂购自鼎国生物技术有限公司,IPTG购自上海生工生物工程有限公司,GST-sepharose 4B购自Amersham Pharmacia Biotech,氧化型谷胱甘肽、还原型谷胱甘肽、十二烷基肌氨酸钠购自上海华舜生物有限公司,凝血酶(Thrombin,10U/mg)购自上海永吉生物有限公司,CNBr-activated Sepharose 4B购自Amersham Biosciences,其他试剂均为国产分析纯,购自国药集团化学试剂有限公司。
1.2 果蝇总RNA的提取
液氮研磨大肠杆菌(E.coli)饲喂的3龄果蝇20~30只3次,按Trizol试剂盒说明提取总RNA。
1.3DiptericinA的PCR扩增
根据DiptericinA的核苷酸序列分别设计其上下游引物D1、D2,在D1的5′端引入限制性核酸内切酶EcoR I的酶切位点,在D2的5'端引入终止子和限制性核酸内切酶XhoI的酶切位点。上游引物D1为5′-CCGGAA TTC GAC GAC ATG ACC ATG AAG CC-3′,下游引物D2为5′-CCG CTC GAG CTA TTA GAA ATT CGG AAA TC-3′;以从果蝇中提取的总RNA为模板,用上下游引物两步法RT-PCR分别扩增,反应体系如表,RT-PCR反应程序第一步是30℃ 10 min,47℃ 30 min,5℃ 5 min;RT-PCR第二步反应程序是85℃ 1 min,55℃ 1 min,72℃ 1 min,循环25次。扩增产物用1%琼脂糖凝胶电泳检测,并将目的条带从胶上切下,然后用小量胶回收试剂盒回收纯化。
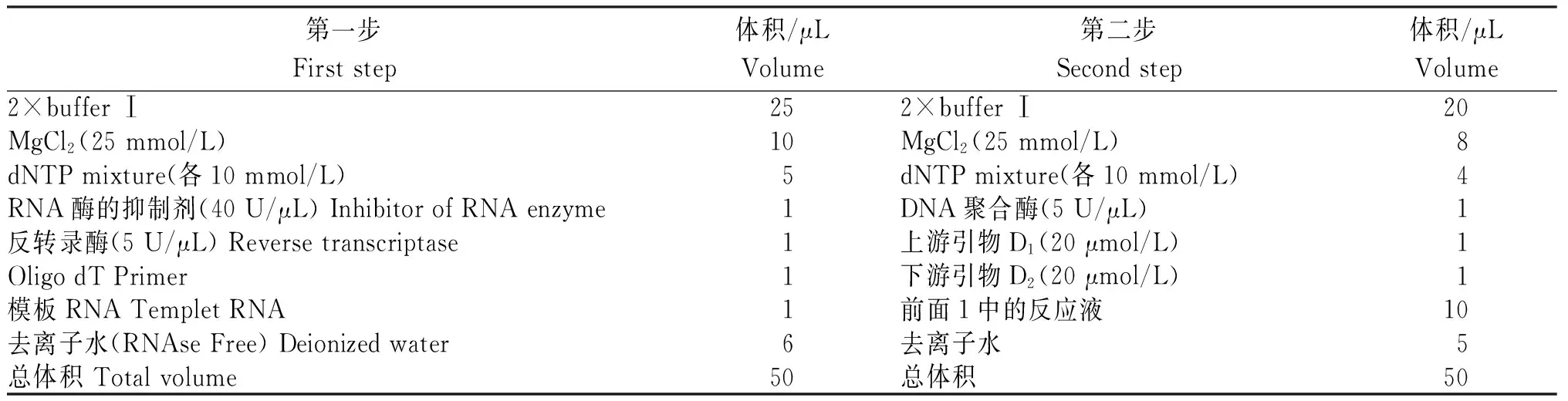
表 两步法RT-PCR的反应体系
1.4 重组质粒pGEX-4T-1-Diptericin A的构建
将质粒pGEX-4T-1与经RT-PCR产物用EcoR I和XhoI双酶切,用T4DNA连接酶连接双酶切得到的pGEX-4T-1和目的基因片段,形成闭合环状的重组质粒,命名为pGEX-4T-1-Diptericin A。
第三,充分利用互联网和新兴媒体,开通多层次、多渠道的营销网络,加大互联网促销力度,形成直销和代理相结合的特色营销渠道。
用表达质粒转化感受态大肠杆菌BL21,涂布于含Ampicillin的LB平板上,挑选单菌落接入3 mL含Ampicillin的LB液体培养基中,在37℃250 r/min下振荡培养12~16 h,然后用小量质粒抽提试剂盒抽提质粒。用EcoRI和XhoI作双酶切鉴定,构建正确的重组大肠杆菌及时用含15%~20%甘油的LB培养基,于-20℃保存。
1.5 重组融合蛋白的高效表达
将重组大肠杆菌接种于5 mL 2×YT培养基中(含Amp 100 μg/mL),37℃振摇过夜,培养至OD600值达到0.6。取500 μL过夜培养物加至50 mL含100 μg/mL Ampicillin的2×YT液体培养基中。37℃摇床培养至OD600到0.6时(约3 h),加入100 mmol/L IPTG储液至终浓度为1.0 mmol/L。继续培养4 h后离心,收集发酵后的上清培养基、胞质蛋白以及包涵体蛋白进行SDS-PAGE检测。
1.6 融合蛋白的分离纯化
选用表达载体pGEX-4T-1含有编码GST的序列,其下游有编码凝血酶识别位点的序列,使表达的GST融合蛋白经凝血酶酶切后即可释放单体多肽。
通过GST-sepharose 4B亲和层析柱纯化融合蛋白,用Bradford法测定各步流出液蛋白质的浓度,SDS-PAGE检测纯度。由此得到较高纯度的重组融合蛋白溶液,于-80℃保存待用。将m融合蛋白∶m凝血酶=120∶1的比例混合,4℃下反应16 h,切割融合蛋白。通过GST亲和层析除去切割下的GST和未被切割的融合蛋白,获得纯度较高的单体多肽。
1.7 生物活性的测定
2 结果与分析
2.1DiptericinA的扩增产物
由图1可见,以引物D1和D2进行扩增,经过25个循环后分别得到1个约280 bp的条带,大小与理论值273 bp(包括编码83个氨基酸残基的Diptericin A成熟肽基因序列249 bp、引物设计增加24 bp)基本一致。将片段构建原核表达载体后,经测序确认基因序列的正确性。
注:1,2为DiptericinA基因的RT-PCR产物;3为marker。
Note:1 and 2, RT-PCR products ofDiptericinAgene; 3, marker.
图1 RT-PCR扩增果蝇DiptericinA基因图谱
Fig.1 Amplification ofDiptericinAgene of Drosophila melanogaster by RT-PCR
2.2 重组质粒pGEX-4T-1-Diptericin A
PCR及双酶切鉴定结果得到1个273 bp的DiptericinA片段和1个4 900 bp的pGEX-4T-1质粒片段,表明目的片段正确插入表达质粒(图2)。测序结果证实其目的片段的正确性。
2.3 重组融合蛋白的表达
由图3表明,在裂解菌体上清中获得35 KD可溶的重组融合蛋白Diptericin A-GST,说明Diptericin A-GST能实现胞内可溶性表达。
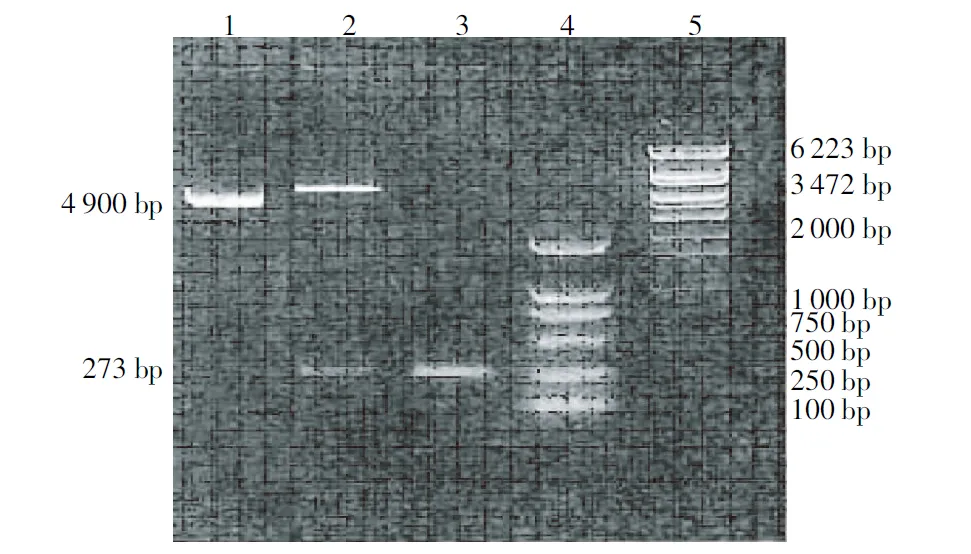
注:1为重组质粒pGEX-4T-1-Diptericin A,2为重组质粒pGEX-4T-1-Diptericin A用EcoRI和XhoI双酶切,3为重组质粒pGEX-4T-1-Diptericin A的PCR产物,4、5为marker。
Note:1, Recombinant plasmid pGEX-4T-1-Diptericin A; 2, Recombinant plasmid pGEX-4T-1-Diptericin A digested byEcoRIandXhoI; 3, PCR product of recombinant plasmid pGEX-4T-1-Diptericin A; 4 and 5, Marker.
图2 重组质粒pGEX-4T-1-Diptericin A的鉴定
Fig.2 Identification of recombinant plasmid pGEX-4T-1-Diptericin A
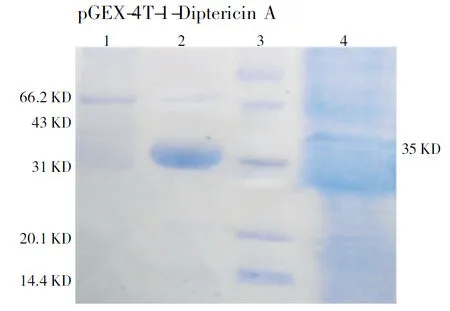
注:1为发酵后上清培养基中的蛋白,2为发酵后胞质蛋白,3为marker,4为包涵体蛋白。
Note:1, Protein in supermatant medium after fermentation; 2, Cytoplasmic protein after fermentation; 3, Marker; 4, Inclusion body protein.
图3 融合蛋白Diptericin A- GST的表达产物定位
Fig.3 Location of expression product of fusion protein Diptericin A- GST
2.4 重组融合蛋白Diptericin A- GST的分离纯化
由图4可见,已成功获得纯度较高的Diptericin A-GST融合蛋白,其纯度可达95%。经Bradford法检测,产量为315.4 mg/L。
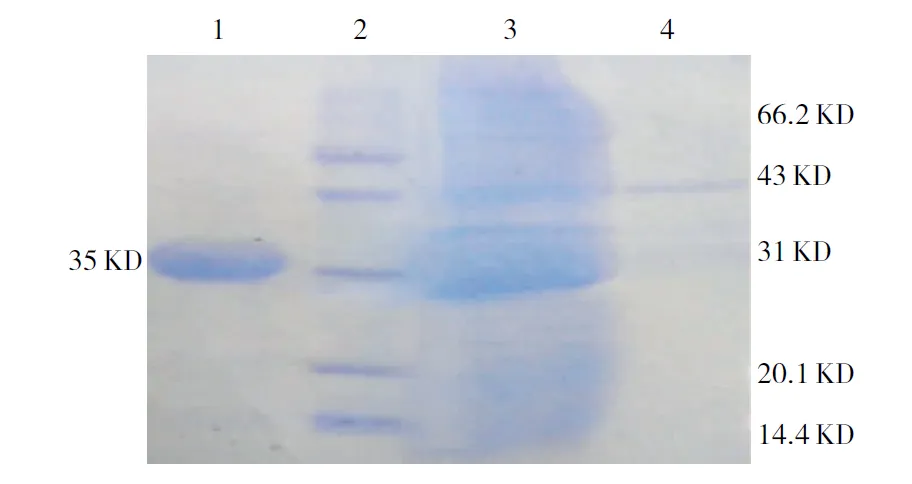
注:1为洗脱液,2为marker,3为上样流出液,4为PBS洗杂液。
Note:1, Eluant; 2, Marker; 3, Outflow of upper sample; 4, PBS wash liquid.
图4 融合蛋白Diptericin A-GST的纯化
Fig.4 Purification of fusion protein Diptericin A-GST
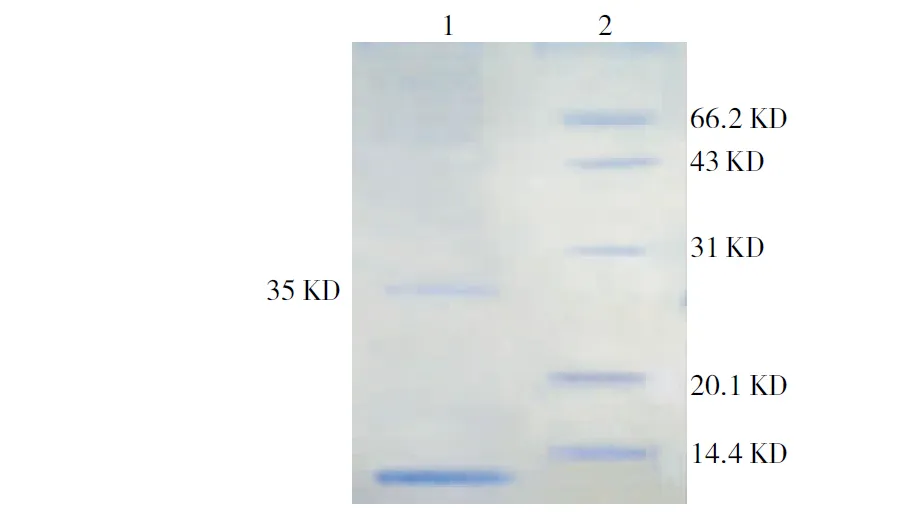
注:1为纯化后的抗菌肽Diptericin A单体,2为marker。
Note:1,Purified Diptericin A monomer; 2, Marker.
图5 抗菌肽Diptericin A的纯化
Fig.5 Purification of Diptericin A
2.5 融合蛋白Diptericin A-GST的酶切及抗菌肽Diptericin A的纯化
将酶切混合溶液与GST-sepharose4B亲和层析柱结合,流出液中含有的未结合蛋白即目的蛋白Diptericin A,经SDS-PAGE检测,Diptericin A单体蛋白的纯度约为90%(图5)。
2.6 Diptericin A的生物活性
不同浓度的Diptericin A溶液对大肠杆菌的抑菌圈大小分别为20.5 mm、15.00 mm和9.00 mm(图6)。
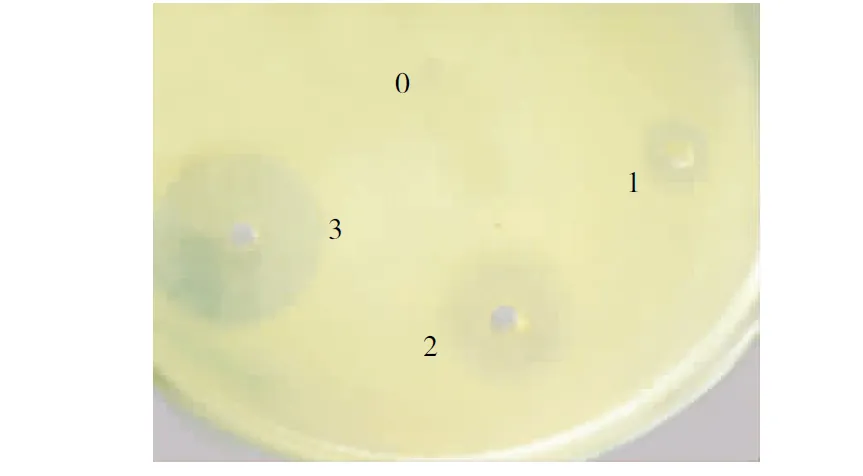
注:0为PBS对照孔,1为1 mg/mL Diptericin A溶液加样孔,2为2 mg/mL Diptericin A溶液加样孔,3为4 mg/mL Diptericin A溶液加样孔。
Note: 0, PBS control pore; 1, Sampling pore of 1 mg/mL Diptericin A solution; 2, Sampling pore of 2 mg/mL Diptericin A solution; 3, Sampling pore of 4 mg/mL Diptericin A solution.
图6 Diptericin A对大肠杆菌的抑菌圈
Fig.6 Inhibition zone of Diptericin A againstE.coli
Diptericin A对大肠杆菌具有抑杀活性,并且该作用呈剂量依赖性。在以金黄色葡萄球菌为阴性对照的抑菌圈试验中,未观察到抑菌圈,因金黄色葡萄球菌属于革兰氏阳性细菌,因此结果与前人结论一致[9-11],即昆虫体内的富含甘氨酸抗菌肽类对革兰氏阴性细菌具有抑杀作用,但不作用于革兰氏阳性细菌。抑菌试验结果说明, Diptericin A具有抑杀革兰氏阴性菌的生物活性。
3 结论与讨论
因抗菌肽具有广谱的抗菌作用,并且微生物对其拮抗作用非常小,随着越来越多传统抗生素耐药性细菌菌株的出现,抗菌肽可能成为一类抗微生物或抗脂多糖新型药物,广泛应用于医学、农业等领域[12-14]。但生物体中抗菌肽含量较低,且从生物体内直接提取的难度大,对技术和成本的要求高,难以实现规模化生产,化学合成方法同样存在成本较高的问题,因此基因重组技术成为大量表达有活性抗菌肽的一条有效途径。
本研究采用的表达载体pGEX-4T-1含有tac启动子,有利于融合蛋白的诱导及高水平表达,并且具有氨苄抗性,在其编码GST序列的下游含有编码凝血酶酶切位点的序列。用IPTG诱导表达后,表达产物N端融合了GST蛋白,用凝血酶酶切后即可得到单体蛋白。该载体的使用可以起到以下3个作用:增加外源蛋白的稳定性,提高外源基因在宿主中的表达水平,有利于目的蛋白的分离纯化。
试验证明,本研究成功获得果蝇抗菌肽Diptericin A,并具有一定的抑菌活性,为进一步研究其对机体免疫力方面的影响提供可能。在大肠杆菌中成功表达具有活性的Diptericin A为利用基因工程技术生产抗菌肽奠定基础,也为进一步研究抗菌肽的作用机理和开发新型抗感染药物开辟一条新途径。
[1] Claudine N, Andrew J B, Olivier B, et al. Methods to study Drosophila immunity[J].Methods,2014,68(1):116-128.
[2] 李冠楠,夏雪娟,隆耀航,等.抗菌肽的研究进展及其应用[J].动物营养学报,2014,26(1):17-25.
[3] Phoebe T, Ennio D G, Bruno L. How Drosophila combats microbial infection: a model to study innate immunity and hostpathogen interactions[J].Curr Opin Microbiol,2002,5(1):102-110.
[4] Jules A. Hoffmann. The immune response of Drosophila[J].Nature,2003,426:33-38.
[5] Brian P. Lazzaro, Andrew G. Clark. Molecular Population Genetics of Inducible Antibacterial Peptide Genes in Drosophila melanogaster[J].Mol. Biol. Evol,2003,20:914-923.
[6] 金 珊,张 黎,曾庆韬.果蝇防御素在毕赤酵母中的表达及活性检测[J].生物技术通报,2008(S1):456-461.
[7] 杨 莹,王成林,徐家萍.家蚕和果蝇的抗菌肽cecropin B基因的原核表达及抑菌活性分析[J].蚕业科学,2011,37(2):246-253.
[8] 刘变芳,郭蔼光,金伟波,等.果蝇抗菌肽基因(Andropin)的原核表达与活性分析[J].西北农林科技大学学报:自然科学版,2010,38(7):209-215.
[9] Hancock RE, Diomand G. The role of cationic antimicrobial peptides in innate host defences[J].Trends Micmbiol,2000,8(9):402-410.
[10] Bulet P, Hegy G, Lambert J, et al. Insect immunity:The inducible antibacterial peptide diptericin carries two O-glycans necessary for biological activity[J].Biochemsitry,1995,34(22):7394-7400.
[11] Ando K, Okada M, Natori S. Purification of sarcotoxin II, antibacterial proteins of Sarcophaga peregrina (flesh fly) larvae[J].Biochemistry, Jan 1987,26(1):226-230.
[12] Alexandra K Marr, William J Gooderham, Robert EW Hancock. Antibacterial peptides for therapeutic use: obstacles and realistic outlook[J].Current Opinion in Pharmacology,2006(6):468-472.
[13] 梁 英.抗菌肽的来源及应用[J].动物营养学报,2014,26(1):7-16.
[14] Hui-Yu Yi, Munmun Chowdhury, Ya-Dong Huang, et al. Insect antimicrobial peptides and their applications[J].Applied Microbiology and Biotechnology.2014,98(13):5807-5822.
(责任编辑: 刘忠丽)
Prokaryotic Expression ofDiptericinAGene and Its Antimicrobial Activity inDrosophilamelanogaster
XU Jia
(GuizhouMinzuUniversity,Guiyang,Guizhou550025,China)
DiptericinAgene was amplified from total Drosophila RNA by RT-PCR and then the correctness of established prokaryotic expression vector was determined by PCR, double-enzyme digestion and sequencing methods. The recombinant plasmid was transformed into BL21 and then strains with resistance to Ampicillin were screened. The results showed thatDiptericinAgene is obtained and the prokaryotic expression vector is established successfully. Diptericin A-GST is expressed in the form of soluble GST fusion protein with a yield of 315.4 mg/L. Diptericin A antibacterial peptide monomer with 90% purity is obtained. The bacteriostat test showed that Diptericin A has the significant inhibition effect onE.coliand the effect is dose-dependent.
DiptericinA; prokaryotic expression; bacteriostatic activity;Drosophilamelanogaster; prokaryotic expression
2015-04-14; 2015-05-01修回
贵州省科技厅贵州民族大学联合基金项目“贵州地区奶牛乳房炎主要病原菌调查及其生物防治方法研究”[黔科合J字KM(2012)01]
徐 佳(1982-),女,实验师,硕士,从事蛋白药物研究。E-mail:50424567@qq.com
1001-3601(2015)05-0228-0024-04
S443.9
A
