苦荞锌指蛋白基因FtLSD1的克隆及其对非生物胁迫的应答
2015-02-28姚攀锋雒晓鹏李成磊姚慧鹏
高 飞,姚攀锋,雒晓鹏,李成磊,吴 琦,姚慧鹏
(四川农业大学 生命科学院,四川雅安 625014)
苦荞锌指蛋白基因FtLSD1的克隆及其对非生物胁迫的应答
高 飞,姚攀锋,雒晓鹏,李成磊,吴 琦,姚慧鹏*
(四川农业大学 生命科学院,四川雅安 625014)
根据苦荞(Fagopyrumtataricum)花期转录组数据,分别以苦荞DNA和cDNA为模板,克隆得到1个苦荞C2C2型锌指蛋白基因FtLSD1(GenBank登录号KP252134)的DNA序列和cDNA序列,采用实时荧光定量PCR方法,研究了FtLSD1基因在非生物胁迫下的表达模式。结果显示:苦荞FtLSD1基因DNA全长2 427 bp,由6个外显子和5个内含子构成,符合GU-AG剪切原则;cDNA序列包含一个528 bp开放阅读框,编码175个氨基酸,具有LSD1家族的典型结构域;UV-B照射和水杨酸处理均能使FtLSD1基因的表达量上升,且UV-B处理在6 h达到最大,为0 h(CK)的3.84倍;水杨酸处理于10 h达到最大,为0 h(CK)的3.44倍,而4 ℃冷胁迫下该基因表达量保持稳定。推测该基因可能参与苦荞抗UV-B和高浓度水杨酸等非生物胁迫的应答反应,为苦荞的抗逆性研究提供新的视角。
苦荞;锌指蛋白LSD1;基因克隆;非生物胁迫
类LSD1基因编码一类特殊的C2C2型锌指蛋白,含有3个特殊的锌指结构域:CxxCxRxxLMYxxGAxSVxCxxC,又称为zf-LSD1结构域[1]。该基因家族克隆的首个基因是拟南芥AtLSD1,随后在水稻、小麦、玉米等植物中发现并克隆出更多含有zf-LSD1结构域的基因[2-3]。功能研究表明,这类LSD1型锌指蛋白在细胞过敏性死亡、植物广谱抗病性以及植物对低温、长日照等非生物环境胁迫具有调控功能[4]。Danie等[5]研究表明,拟南芥AtLSD1基因功能是通过应答水杨酸(salicylic acid,SA)信号分子,上调铜锌超氧化物歧化酶(Cu-ZnSOD)来清除由病原菌或者其它非生物胁迫造成的过量积累的活性氧(reactive oxygen species,ROS),减轻氧迸发引起的二次伤害。
苦荞(Fagopyrumtataricum)又称鞑靼荞麦,属蓼科(Polygonaceae)荞麦属一年生草本植物。主要分布在中国西南高寒山地[6]。苦荞含有丰富的生物类黄酮,对人类多种疾病具有预防治疗作用,被誉为新型的绿色保健食品,备受青睐[7-8]。苦荞抗逆能力强,能适应高寒、高海拔、强紫外及干旱等恶劣环境。目前,关于苦荞抗逆及抗氧化的研究主要集中于黄酮类化合物和SOD酶类对ROS的清除方面。Suzuki等[9]证明苦荞在受到紫外线、冷和干旱胁迫时叶片中的芦丁含量以及芦丁葡萄糖苷酶活性显著上升,以此来清除胁迫条件下产生的过量ROS。董新纯等[10]研究发现,苦荞经UV-B处理后,其SOD总活性提高,说明苦荞在受到胁迫时,通过提高抗氧化酶活性清除ROS以保护细胞,而其中的分子调控机制尚不清楚。
本实验根据获得的苦荞花期转录组数据,采用RT-PCR技术克隆苦荞抗逆相关的锌指蛋白FtLSD1基因序列,并采用UV-B、2 mmol/L水杨酸和4 ℃冷胁迫处理二叶期苦荞,探究FtLSD1基因的表达与外界非生物胁迫的相关性,为从分子水平探究苦荞抗逆和抗氧化的机制提供参考,也为苦荞的抗逆性研究提供新的视角。
1 材料和方法
1.1 材料及处理
苦荞(‘西荞二号’)种植于四川农业大学生命科学院实验室培养箱,培养条件为光照16 h,黑暗8 h,温度(22±2) ℃,相对湿度60%,培养至二叶期供试备用。
UV-B处理:使用10 W UV-B(308 nm)LED灯照射二叶期苦荞,光照距离30 cm。水杨酸处理:使用2 mmol/L浓度水杨酸,叶面喷施二叶期苦荞,以叶面滴水为度,以上处理均于处理前0 h、处理后2、4、6、8、10和12 h分别取供试样品叶片,液氮冷冻后置于-80 ℃备用。4 ℃冷处理:将二叶期苦荞转移至培养条件为光照16 h,黑暗8 h,温度4 ℃,相对湿度60%的光照培养箱,于处理前0 h、处理后12、24、36、48、60和72 h取供试样品叶片,液氮冷冻后置于-80 ℃备用。
1.2 方 法
1.2.1FtLSD1 DNA序列和cDNA序列的克隆 采用改良SDS法[11]提取苦荞叶片总DNA,采用植物RNAout试剂盒提取各处理样品的总RNA,并以其为模板使用PrimeScript RT reagent Kit With gDNA Eraser(Perfect Real Time)试剂盒反转录制备cDNA第一条链。根据本实验室获得的苦荞花期转录组数据,设计1对特异引物FtLSD1f(5′-TTCTACCATTTTACGCCTCCCTCC-3′)和FtLSD1r(5′-CGACCGGTACGCTGTTGAGTATAAC-3′),分别以苦荞总DNA和cDNA第一条链为模板,PCR扩增FtLSD1 DNA序列和cDNA序列,PCR产物回收纯化后连接至pMD19-T 载体,阳性克隆送上海英骏生物公司测序。
1.2.2 序列分析 使用NCBI在线工具Blast进行FtLSD1核苷酸序列及其编码的蛋白质氨基酸序列同源性分析;使用DNAMAN进行多序列比对;利用MEGA 5.0将对比结果采用邻接法(neighbor-joining,NJ)构建系统进化树。
1.2.3 苦荞FtLSD1基因表达 设计1对实时定量PCR特异引物FtLSD1 Qf (5′-TGTATCCCTT-TGGAGCACCATCAG-3′)和FtLSD1 Qr(5′-GCCAACCACAACATTGCTGACC-3′),以苦荞组蛋白H3基因[12]为内参基因,引物为H3Qf(GAAATTCGCAAGTACCAGAAGAG)和H3Qr(CCAACAAGGTATGCCTCAGC),采用Takara公司实时荧光定量PCR试剂盒SYBR Premix ExTaqTMⅡ(Perfect Real Time),在BIO-RAD公司的CFX96 Real-Time System进行荧光定量,数据采用2-△△CT方法[13]分析,采用IBM SPSS Statistics 20统计软件对水杨酸、UV-B和冷胁迫下苦荞FtLSD1基因的表达进行数据分析。
2 结果与分析
2.1 苦荞FtLSD1基因DNA序列和cDNA序列的克隆
采用特异引物FtLSD1f和FtLSD1r,以苦荞DNA为模板,PCR扩增得到4 000 bp左右条带,测序结果表明该片段长4 080 bp(图1,A)。用该特异引物,以苦荞cDNA为模板,PCR扩增得到900 bp左右条带(图1,B),测序结果表明该片段长877 bp。
2.2 核苷酸序列分析
通过Blast 比对苦荞FtLSD1 DNA和cDNA序列,确定其全长DNA序列为2 427 bp,由6个外显子,5个内含子构成(图2),符合标准的GU-AG剪切原则。此外,位于ATG上游5 ′-UTR的-2 bp和-1 194 bp之间,存在1个长度为1 391 bp插入片段,同时符合GU-AG剪切原则,属于特殊的内含子结构,是比较少见的基因类型[14]。Prediction在线软件分析结果表明,在距离起始密码子-1 140 bp至-1 190 bp存在1个可能的启动子基础序列。苦荞FtLSD1 cDNA序列包含一个528 bp开放阅读框(ORF)。Blast序列比对显示,该cDNA序列与豌豆(Pisumsativum)、可可(Theobromacacao)和毛果杨(Populustrichocarpa)的相似性分别为69%、69%和65%。表明克隆得到的序列属于类LSD1基因家族。
2.3 氨基酸序列及系统进化树分析
DNAman分析表明,FtLSD1基因编码175个氨基酸,等电点(pI)为8.37,相对分子质量为18.38 KDa,无信号肽。SOPMA预测表明,该序列由13.14% α-螺旋、24.57%延伸链、6.86% β-转角和55.43%无规则卷曲组成。NCBI Blast结果表明,苦荞FtLSD1与拟南芥(Arabidopsisthaliana)AtLSD1、可可(Theobromacacao)TcLSD1和豌豆(Pisumsativum)PsLSD1相似性分别为59%、66%
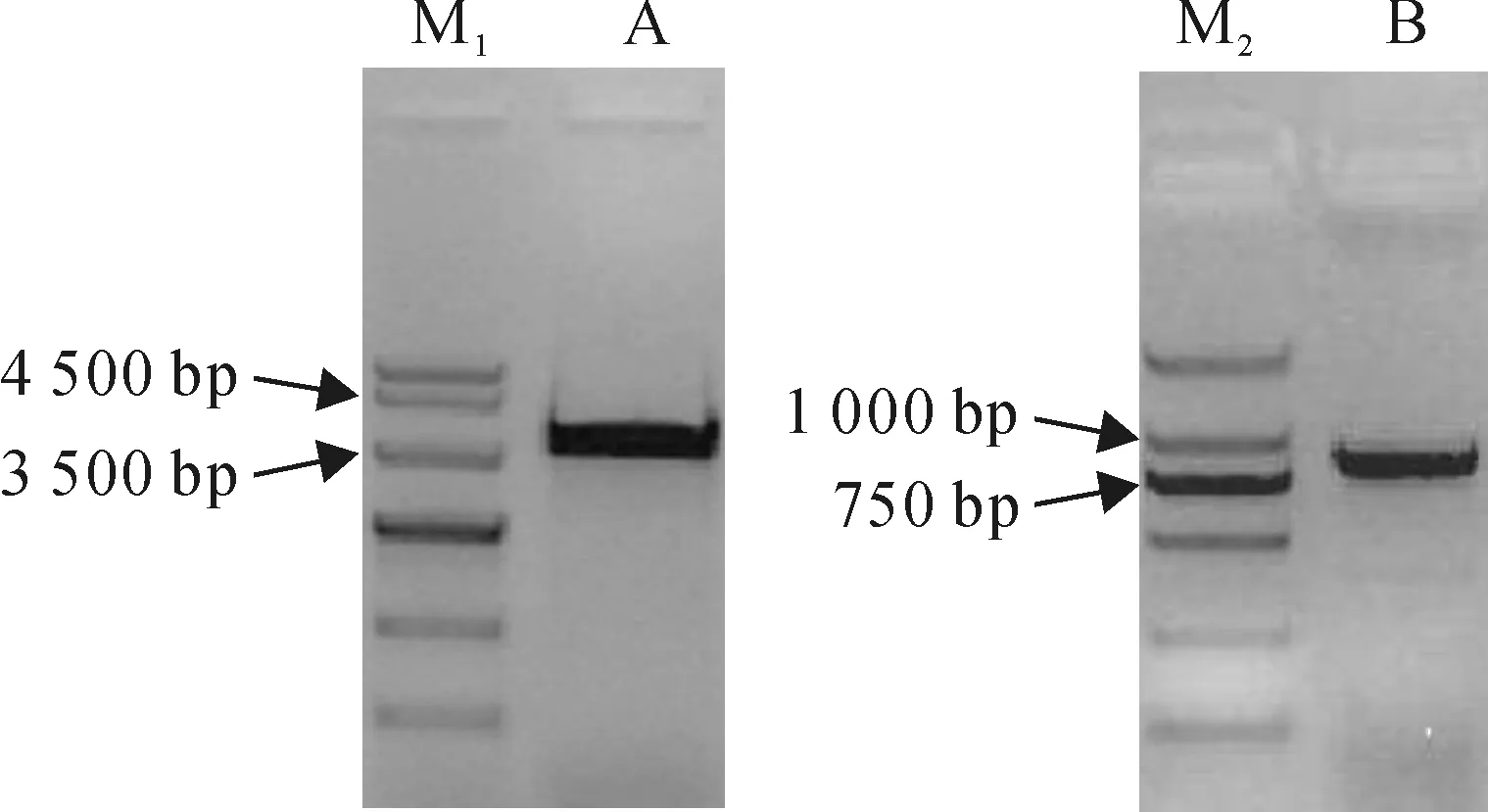
图1 苦荞FtLSD1 DNA(A)和cDNA(B)扩增
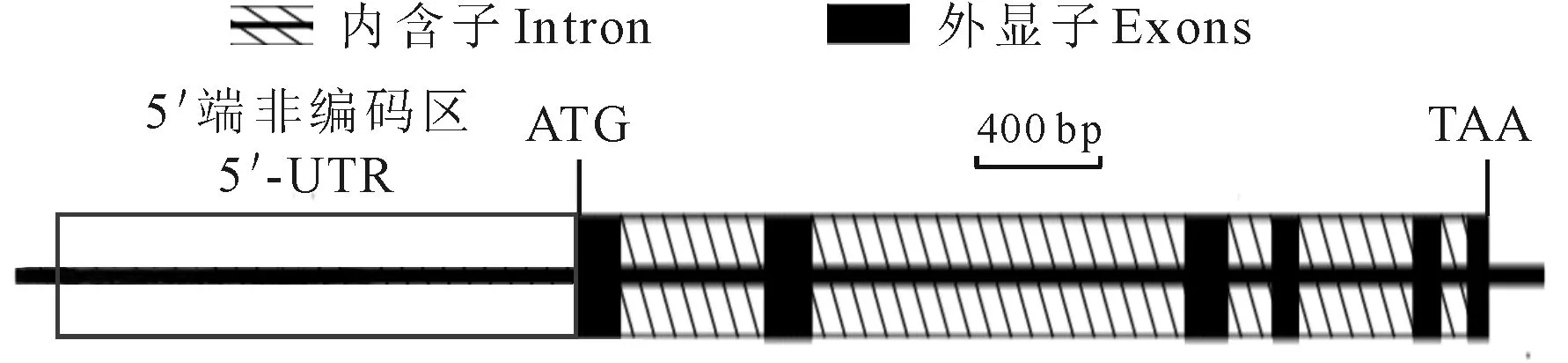
图2 FtLSD1基因结构示意图ATG表示起始密码子;TAA表示终止密码子
和64%。将FtLSD1氨基酸序列与其它物种LSD1氨基酸序列进行对序列比对结果(图3)表明,苦荞FtLSD1与拟南芥等植物的LSD1都具有3个共同的保守肽基序,结构为CxxCxRxxLMYxxGAxSVxCxxC,是锌指蛋白的典型的保守序列,而其它区域相似性较低。
采用MEGA 5.0软件将LSD1氨基酸序列进行比对,并采用邻接法构建系统发育进化树(图4),发现苦荞FtLSD1与拟南芥AtLSD1、甘蓝BoLSD1、BoLSD2等共分布于进化树簇Ⅰ,而拟南芥AtLOL1、水稻OsLSD1和玉米ZmLOL1等分布于进化树簇Ⅱ。
2.4 苦荞FtLSD1表达分析
使用荧光定量PCR分析FtLSD1在UV-B、水杨酸和4 ℃冷处理下各个时间段的转录水平。以苦荞组蛋白H3为内参基因,0 h为对照组,使用2-△△CT法计算FtLSD1基因表达量变化的倍数关系。UV-B处理结果(图5)表明,FtLSD1基因表达从UV-B处理2 h开始上升,到6 h达到最大,为对照(0 h)的3.84倍,6 h后有所下降,但仍然维持较高表达量。水杨酸处理结果(图5)表明,FtLSD1基因的表达量从水杨酸处理的2 h开始上升,4 h有所下降,但在0~10 h表达量保持稳定上升趋势,到10 h达到最大值,为对照(0 h)的3.44倍;12 h后表达量突然下降,仅为对照(0 h)的1.85倍。

图3 不同植物LSD1氨基酸序列比对图中从上至下依次代表的是苦荞、甘蓝、拟南芥、玉米、水稻、竹子、拟南芥中相应的LSD1氨基酸序列;划线部分为zf-LSD1锌指蛋白结构域

图4 苦荞LSD1与其他植物LSD1氨基酸序列的系统发育树

图5 UV-B和SA处理条件下FtLSD1表达量

图6 4 ℃冷处理条件下FtLSD1表达量
4 ℃冷处理结果(图6)表明,FtLSD1基因的表达量整体趋势保持稳定,12 h开始上升,48 h达到最大值,为对照(0 h)的1.35倍。60 h下降回到冷处理前的水平,然后维持稳定。
3 讨 论
高通量测序技术作为新一代的测序技术,目前广泛应用于基因组和转录组的测序,Lai等[15]根据获得的红薯(Ipomoeabatatas)转录组数据克隆得到红薯尿苷二磷酸葡萄糖脱氢酶,目前根据转录组数据克隆获得基因序列已经成为一种快速高效的克隆方法,与RACE等其它技术相比,具有简便、高效、节省经费等特点。本实验根据获得的苦荞花期转录组数据库,首次在苦荞中克隆得到1条锌指蛋白基因FtLSD1,获得该基因的DNA和cDNA序列,为从分子水平研究苦荞抗逆性提供一条靶基因。
Liu等[16]对植物LSD1型锌指蛋白家族进行了分类,含有3个zf-LSD1蛋白、2个zf-LSDl蛋白以及1个zf-LSDl蛋白,同时发现具有调控细胞死亡、植物抗病性以及植物对非生物胁迫抗逆性功能的锌指蛋白多属于3个zf-LSD1蛋白的亚家族。通过氨基酸序列比对,可知FtLSD1具有3个典型的C2C2型锌指蛋白结构域zf-LSDl,且与十字花科植物拟南芥AtLSD1和甘蓝BoLSD1高度同源,而与禾本科植物玉米ZmLOL1、水稻OsLSD1和竹子BohLOL1相比,仅在锌指蛋白保守结构域zf-LSD1(CxxCxRxxLMYxxGAxSVxCxxC)处保守,而在3个zf-LSD1间隔区域保守性较低,这种结构为该类蛋白调控功能的多样化提供了分子依据。另外,FtLSD1氨基酸序列第一个zf-LSD1结构域的第10个氨基酸Met被同为疏水氨基酸的Leu取代,但不影响其锌指结构域的形成[17],相关功能是否存在不同有待进一步研究。由进化树可知,同一物种的拟南芥AtLSD1和AtLOL1分属不同的簇,而研究表明AtLSD1和AtLOL1具有相反的功能,AtLSD1参与负调控ROS介导的信号通路,而AtLOL1参与正调控,推测苦荞FtLSD1与AtLSD1具有相似的功能,参与负调控ROS介导的信号通路,限制植物对外界的应激,防止细胞死亡的扩散[18]。
据报道,SA处理、UV-B处理和冷刺激等非生物胁迫均能打破植物体内氧代谢平衡,造成ROS的过量积累,引起细胞的死亡。Kliebenstein等[19]研究表明,拟南芥AtLSD1通过上调铜锌超氧化物歧化酶(Cu-ZnSOD)来清除ROS,防止细胞死亡的扩散。本研究发现,苦荞FtLSD1基因在水杨酸和UV-B处理条件下表达上调,说明FtLSD1可能参与了苦荞的抗UV-B和水杨酸的防卫反应,其中UV-B处理条件下FtLSD1表达上调较水杨酸处理迅速,说明该基因对不同的外界刺激具有不同的响应速度。而4 ℃冷处理条件下,FtLSD1基因表达量相对稳定。Huang等[20]研究表明,4 ℃冷处理条件下拟南芥AtLSD1表达量在72 h内表达量维持稳定,而在72 h后开始积累,暗示在冷胁迫的初期阶段,植物可能存在其它的途径来抵抗冷刺激。
苦荞主要分布在中国西南山区,该地区干旱、昼夜温差大、紫外线强,而苦荞具有良好的适应性,表现出良好的抗逆性能。已有的研究主要集中在苦荞如何通过提高黄酮类物质合成来参与抗逆过程,而本实验则首次对苦荞抗逆相关的锌指蛋白基因FtLSD1进行研究,分析其在UV-B、水杨酸和冷处理等非生物学胁迫下的响应,为研究苦荞的抗逆机制提供新的思路。
[1] DIETRICH R A,RICHBERG M H,SCHMIDT R,etal.A novel zinc finger protein is encoded by theArabidopsisLSD1 gene and functions as a negative regulator of plant cell death[J].Cell,1997,88(5):685-694.
[2] WANG L J(王丽娟),TIAN Y CH(田颖川),HE CH Z(何朝族).Cloning of a novel rice geneOsLSD1 and bioinformatic analysis ofLSD1-like gene family fromArabidopsisand rice[J].ProgressinBiochemistryandBiophysics(生物化学与生物物理进展),2005,32(3):268-274(in Cihinese).
[3] HUANG X J(黄新杰),GUO J(郭 军),QU ZH P(屈志鹏),etal.In silico cloning and sequence analysis of aTaLSD1 zinc finger protein gene from wheat infected by stripe rust fungus[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2007,27(11):2 147-2 152(in Cihinese).
[4] SHENG H Y,CHOUN S L,FU H W,etal.Analysis of the expression ofBohLOL1,which encodes an LSD1-like zinc finger protein inBambusaoldhamii[J].Planta,2011,234:1 179-1 189.
[5] DANIE H A,CHRISTINE R A,BEN F H,etal.Runaway cell death,but not basal disease resistance,in lsd1 is SA- andNIM1/NPR1-dependent[J].ThePlantJournal,2002,29(3):381-391.
[6] KITABAYASHI H,UJIHARA A,HIROSE T,etal.On the genotypic differences for rutin content in tatary buckwheat,FagopyrumtataricumGaertn[J].BreedingScience,1995,45(2):189-194.
[7] CALABRO M L,TOMMASINI S,DONATO P,etal.The rutin/beta-cyclodextrin interactions in fully aqueous solution:Spectroscopic studies and biological assays[J].JournalofPharmaceuticalandBiomedicalAnalysis,2005,36(5):1 019-1 027.
[8] ZWIRTES O I R,FERNANDES S C,VIEIRA I C.Development of a biosensor based on gilo peroxidase immobilized on chitosan chemically crosslinked with epichlorohydrin for determination of rutin[J].JournalofPharmaceuticalandBiomedicalAnalysis,2006,41(2):366-372.
[9] SUZUKI T,HONDA Y,MUKASA Y J.Effects of UV-B radiation,cold and desiccation stress on rutin concentration and rutin glucosidase activity in tartary buckwheat (Fagopyrumtataricum) leaves[J].PlantScience,2005,168:1 303-1 307.
[10] DONG X CH(董新纯),ZHAO SH J(赵世杰),GUO SH SH(郭珊珊),etal.Role of flavonoids on stress injury and antioxydative enzymes inFagopyrumtataricunseedings under enhanced UV-B radiation[J].JournalofShandongAgriculturalUniversity(山东农业大学学报),2006,37(2):157-162(in Cihinese).
[11] LI CH L(李成磊),FENG ZH Y(冯争艳),BAI Y CH(白悦辰),etal.Molecular cloning and prokaryotic expression of phenylalanine ammonialyase geneFdPALfromFagopyrumdibotrys[J].ChinaJournalofChineseMateriaMedica(中国中药杂志),2011,36(23):3 238-3 243(in Cihinese).
[12] BAI Y C,LI C L,ZHANG J W,etal.Characterization of two tartary buckwheat R2R3-MYB transcription factors and their regulation of proanthocyandin biosynthesis[J].PhysiologiaPlantarum,2014,152(3):431-440.
[13] THOMAS D S,KENNETH J L.Analyzing real-time PCR data by the comparative CT method[J].NatureProtocols,2008,3(6):1 101-1 108.
[14] WEI ZH G(卫正国),CHEN Y H(陈玉华),LI B(李 兵),etal.Cloning and structure analysis of cytochrome P450 gene CYP305B1 fromBombyxmori[J].ScienceofSericulture(蚕业科学),2009,35(1):144-147(in Cihinese).
[15] LAI X J,GU Y H,TAO X,etal.Cloning and characterization of uridine diphosphate glucose dehydrogenase gene fromIpomoeabatatas[J].RussianJournalofPlantPhysiology,2014,61(3):298-308.
[16] LIU Q P,XUE Q Z.Molecular phylogeny,evolution,and functional divergence of theLSD1-like gene family:inference from the rice genome[J].JournalofMolecularEvolution,2007,64(3):354-363.
[17] BROWN R S.Zinc finger proteins:getting a grip on RNA[J].CurrentOpinioninStructuralBiology,2005,15(1):94-98.
[18] KAMINAKA H,NAKC C,EPPLE P,etal.bZIP10-LSD1 antagonism modulates basal defense and cell death inArabidopsisfollowing infection[J].EMBOJournal,2006,25(18):4 400-4 411.
[19] DJ KLIEBENSTEIN,RA DIETRICH,AC MARTIN,etal.LSD1 regulates salicylic acid induction of copper zinc superoxide dismutase inArabidopsisthaliana[J].MolecularPlant-microbeInteractions,1999,12(11):1 022-1 026.
[20] HUANG X Z,LI Y S,ZHANG X Y,etal.TheArabidopsisLSD1 gene plays an important role in the regulation of low temperature-dependent cell death[J].NewPhytologist,2010,187(2):301-312.
(编辑:宋亚珍)
Cloning and Expression Analysis of Zinc Finger Protein GeneFtLSD1 inFagopyrumtataricumunder Abiotic Stress
GAO Fei,YAO Panfeng,LUO Xiaopeng,LI Chenglei,WU Qi,YAO Huipeng*
(College of Life Science,Sichuan Agricultural University,Ya’an,Sichuan 625014,China)
According to transcriptome data ofFagopyrumtataricumat flowering,using PCR and RT-PCR techniques,the DNA and full-length cDNA sequences ofFtLSD1 gene (GenBank accession number:KP252134) were amplified fromF.tataricum.The obtained sequences were analyzed by bioinformatics software,and the expressionFtLSD1 gene were analysed by qPCR under UV-B,SA and 4 ℃ cold stress.The results showed that the DNA sequence ofFtLSD1 gene was 2 427 bp,of which consisted 6 exons and 5 introns,in line with the principle of GU-AG splicing,and the cDNA ofFtLSD1 contained a 528 bp ORF.The UV-B radiation and 2 mmol/L salicylic acid could lead to a significant increase in the expression of theFtLSD1 gene,while 4 ℃ cold stress remained stable expression levels of the gene.The results expected to lay a foundation for study the stress resistance inF.tataricum.
Fagopyrumtataricum;zinc finger protein LSD1;gene cloning;abiotic stress
1000-4025(2015)04-0669-05
10.7606/j.issn.1000-4025.2015.04.0669
2014-12-12;修改稿收到日期:2015-02-09
四川省教育厅青年基金(13ZB0294)
高 飞(1991-),男,在读硕士研究生,主要从事植物分子生物学研究。E-mail:gaofeibiology@aliyun.com
*通信作者:姚慧鹏,博士,副教授,主要从事植物分子生物学研究。 E-mail:yaohuipeng0921@163.com
Q785;Q789
A
