热辅快速生物发酵分解工艺无害化处理病死猪尸体效果评估
2015-02-27陈腾飞吴志明刘阳利闫若潜谢彩华王淑娟李勤楠河南农业大学河南郑州45000河南省动物疫病预防控制中心河南郑州450008
陈腾飞,吴志明,刘阳利,闫若潜,谢彩华,王淑娟,李勤楠(1.河南农业大学,河南郑州45000;.河南省动物疫病预防控制中心,河南郑州450008)
热辅快速生物发酵分解工艺无害化处理病死猪尸体效果评估
陈腾飞1,2,吴志明2*,刘阳利1,2,闫若潜2,谢彩华2,王淑娟2,李勤楠2
(1.河南农业大学,河南郑州450002;2.河南省动物疫病预防控制中心,河南郑州450008)
摘 要:为评估热辅快速生物发酵分解工艺无害化处理病死猪尸体的处理效果,利用病毒分离培养、RT-PCR(PCR)等方法对热辅快速生物发酵分解工艺处理的病死猪尸体样品进行病原检测,通过处理前及处理后病原微生物检出率的对比,对该工艺无害化处理病死猪尸体的效果进行评估。结果显示,除猪瘟病毒外,猪圆环病毒、伪狂犬病病毒、猪细小病毒、猪链球菌等常见病原微生物在处理72h后均能被杀死,说明经热辅快速生物发酵分解工艺无害化处理病死猪尸体基本达到了无害化处理要求。
关键词:生物发酵;无害化处理;病死猪尸体;效果;评估
随着动物疫病种类的不断增多,猪病更趋于复杂多样化,任何猪场都会产生病死猪,并且病死猪的数量越来越多。且我国畜禽死亡率居高不下,据专家估计,我国每年因各类疾病引起猪的死亡率为8%~12%,给养猪业造成了重大的损失[1]。由于病死猪尸体携带有各种病原,被随意丢弃的病死猪尸体其所带的细菌、病毒会随空气或其他途径传播扩散,如果是重大动物疫病或人畜共患病病原,会造成重大动物疫情或人畜共患病发生,人畜生命安全就会受到威胁,经济就会受到严重损失,影响畜牧养殖业的发展[2]。若未经有效处理,特别是病死猪流入市场,将直接威胁消费者身体健康,引发严重的食品安全和公共卫生安全事件[3]。无害化处理是指用物理、化学等方法处理病死动物尸体及相关动物产品,消灭其携带的病原体,消除尸体危害的过程[4]。当前病死猪尸体无害化处理的模式主要有焚烧、掩埋、高温化制及发酵降解等,掩埋时如果填埋不当,容易造成水源和土壤污染[5]、操作成本高、掩埋不达标还存在病原溢出及掩埋的病死动物尸体被动物扒出撕咬或者人为挖出流入市场的风险;焚烧虽然能通过高温杀死病原,但会造成空气污染;高温化制处理过程,易产生恶臭气体(异味明显)和废水,设备质量参差不齐、品质不稳定、工艺不统一、生产环境差等问题[6]。这些方法一定程度上都存在二次污染环境的风险和生物安全风险[7]。作为新兴的病死猪尸体处理技术,热辅快速生物发酵分解工艺处理病死猪尸体正在河南及很多省的规模猪场推广,其处理后的产品从外观形色看都被人们认可,但生物安全效果如何,目前尚无科学的定论。本次研究旨在对此工艺的无害化处理效果进行评估,为进一步研究无害化处理工艺、提高无害化处理生物安全效果提供依据。
热辅快速生物发酵分解工艺是利用机械设备的分割绞碎功能,以及耐高温益生菌的高效发酵功能,结合可编程逻辑控制器(Programmable Logic Controller,简称PLC)智能化控制系统,先通过传动系统低速旋转,使病死猪尸体在容器内分割绞碎,然后使用加热系统使其充分加热,再配合一定剂量的耐高温益生菌使之发酵、降解、灭菌。病死猪尸体经过机械分割、高温杀菌、益生菌发酵降解等工序后,处理为有机肥料。该工艺的优点是能将完整病死猪尸体等原料直接进行处理,无须人工分割,克服焚烧、掩埋等传统方法带来的弊端,不存在生物安全及二次污染环境的风险[8]。并且PLC智能化控制系统的运用,极大地节省了人工、降低了处理成本,且处理后的产品为有机肥料,生态环保,良性循环[9]。
在本研究中,每个批次的无害化处理完整流程中,采用平行式采样法采样,分别采集处理前病死猪尸体淋巴结等组织脏器和处理24、48、72h后猪尸体粉碎混合物样品。检测每份样品中猪常见病病原,如猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒(Porcine circovirus,PCV)、伪狂犬
病病毒(Pseudorabies virus,PRV)、口蹄疫病毒(Foot and mouth disease virus,FMDV)、猪细小病毒(Porcine parvovirus,PPV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)又称猪蓝耳病病毒、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)与猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、副猪嗜血杆菌(Haemophilus parasuis,Hps)、猪链球菌(Streptococcus suis)、猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)共11种,并且用病毒分离培养等方法对处理后阳性样品做病原活性鉴定。处理前病死猪尸体样品6个批次,共计74份样品,检出猪瘟病毒、猪圆环病毒、猪蓝耳病病毒、副猪嗜血杆菌、伪狂犬病病毒等5种病原微生物,共计27份样品;利用热辅快速生物发酵分解工艺处理病死猪尸体72h后,利用RT-PCR方法检测病原微生物,6个批次样品中有4个批次检出猪瘟病毒,批次阳性检出率66.67%,检出阳性5份,样品阳性检出率27.77%。经细胞培养,结果有3个批次的3份处理后样品中猪瘟病毒具有活性。分别利用PCR或RT-PCR对处理前病原阳性样品进行猪圆环病毒等其他病原微生物检测,结果均未检出阳性。
1 材料与方法
1.1材料
1.1.1主要试剂 磁珠法核酸全自动提取试剂盒为Ambion生物科技公司产品;猪瘟RT-PCR诊断试剂(扩增CSFV的E2基因,GB/T16551—2008)、猪口蹄疫RT-PCR诊断试剂(GB/T 18935—2003)依据标准进行配制;猪圆环病毒2型PCR试剂(扩增PCV2的ORF2基因),高低致病性猪蓝耳病二重PCR引物(扩增NSP2基因,GB/T27517—2011),猪传染性胃肠炎与流行性腹泻病毒二重RT-PCR引物(DB41/T706—2011),猪链球菌PCR试剂盒,猪伪狂犬病病毒PCR试剂盒,猪支原体PCR试剂盒,猪细小病毒PCR试剂盒均为河南省动物疫病预防控制中心自行研制并提供;猪瘟病毒阳性对照为脾淋源猪瘟活疫苗为山东绿都生物科技有限公司产品;猪蓝耳病病毒阳性对照为高致病性蓝耳病活疫苗(JxA1-R株)为普莱柯生物工程股份有限公司产品;其他病原阳性对照均为河南省动物疫病预防控制中心实验室构建保存的质粒;DMEM培养基为美国Gibco公司产品;犊牛血清为浙江天杭生物科技有限公司产品;发酵菌种分别为德邻生物制剂有限公司和山东佳依有限公司产品。
1.1.2样品 热辅快速生物发酵分解工艺处理前的样品于2013年09月-2013年11月期间采自河南省原阳太平猪场、驻马店正阳猪场病死猪尸体胸腔积液、淋巴结、脾脏、肝脏、肺脏、肾脏、小肠、胎衣;热辅快速生物发酵分解工艺处理后的样品采自河南省原阳猪场、驻马店正阳猪场的热辅快速生物发酵分解处理后的猪尸体肥料。
1.1.3主要仪器 KingFisher全自动核酸提取仪和CO2恒温培养箱为Thermo Fisher公司产品;PCR扩增仪为Biometra公司产品;凝胶成像分析系统为AlphaInnotech公司产品;倒置显微镜为日本Nikon公司产品;Ⅱ级生物安全柜为美国Baker公司产品;热辅快速生物发酵分解处理病死猪尸体设备为郑州润升生物科技有限公司产品。
1.2方法
1.2.1热辅快速生物发酵分解法处理前后11种病原RT-PCR和PCR检测
1.2.1.1样品采集 选取河南省正在应用热辅快速生物发酵分解工艺处理病死猪尸体的规模猪场,在完整的处理流程中,均采用平行式采样法,对每批次处理的病死猪尸体处理之前分别采集其胸腔积液、淋巴结、脾脏、肝脏、肺脏、肾脏、小肠、胎衣等,处理前共采集6个批次74头猪的样品(其中第2批、第3批、第5批和第6批无害化处理使用的为山东佳依有限公司的菌种;第1批和第4批使用的为河南德邻生物制剂有限公司的菌种),对第1批、第2批、第3批次在快速生物发酵分解处理24、48、72h时分别采取猪尸体粉碎混合物样品各3份,共计27份,对第4批、第5批、第6批次处理72h时分别分别采集猪尸体粉碎混合物样品各3份,共计9份。总共采集处理前后样品110份。
1.2.1.2样品处理 将每头病死猪的腹股沟淋巴结、下颌淋巴结、肠系膜淋巴结各取一部分,用剪刀剪碎后混合,用各自对应病死猪的胸腔积液作稀释液进行稀释;把快速生物发酵分解处理24、48、72h时的猪尸体粉碎混合物样品,分别用生理盐水稀释;稀释后放入1.5mL EP管中,用组织粉碎仪将其粉碎均匀,离心,吸取上清液于新的1.5mL EP管,作好标记,备用。
1.2.1.3PCR扩增 将上述6批次该工艺处理前后110份样品利用磁珠法核酸全自动提取试剂盒提取DNA或RNA,参照标准涉及的猪瘟病毒RTPCR、口蹄疫病毒RT-PCR、高低致病性猪蓝耳病病毒二重RT-PCR、猪传染性胃肠炎病毒与流行性腹泻病毒二重RT-PCR方法和相关文献[10-13]中的猪
圆环病毒、副猪嗜血杆菌、猪链球菌、猪伪狂犬病病毒等PCR,分别进行猪瘟病毒等11种病原的检测。1.2.1.4 琼脂糖凝胶电泳 用15g/L的琼脂凝胶,以110 V、25 min进行凝胶电泳,并通过AlphaImager进行观察,照相保存。
1.2.2病毒分离培养鉴定 取快速生物发酵分解处理72h后的猪尸体肥料,利用RT-PCR检测出猪瘟病毒阳性的样品,经处理后加入5倍~10倍体积的DMEM液充分混匀,然后12 000r/min离心10min,取上清,用0.22μm滤膜过滤后加入长成75%单层的PK-15细胞瓶中,3d后收获细胞。将病毒细胞培养液反复冻融3次后,放入-80℃冰箱备用。依据GB/T16551—2008,采用RT-PCR进行猪瘟病毒鉴定。
2 结果
2.1热辅快速生物发酵分解法处理前后11种病原RT-PCR和PCR检测
分别对6批次样品在热辅快速生物发酵分解法无害化处理病死猪尸体前后做猪瘟病毒等11种常见猪病的病原进行PCR检测。结果显示,6个批次样品在未经快速生物发酵分解法处理前的样品中均检出有猪瘟病毒、猪圆环病毒2种病原,其中第1批和第3批样品中在未经快速生物发酵分解法处理前还检出了伪狂犬病病毒、猪蓝耳病病毒、副猪嗜血杆菌3种病原。其中第1批处理前样品中猪瘟病毒阳性检出率为71.43%,猪圆环病毒阳性检出率为92.86%,伪狂犬病病毒阳性检出率为7.15%,猪蓝耳病病毒阳性检出率为21.43%,副猪嗜血杆菌阳性检出率为7.15%。6个批次样品经过热辅快速生物发酵分解法无害化处理后,分别于24、48、72h采样检测,在处理72h后,只有猪瘟病毒能够少量检出,其他病原均未检出。第1批次样品处理前及处理后PCR电泳结果如图1~图10。
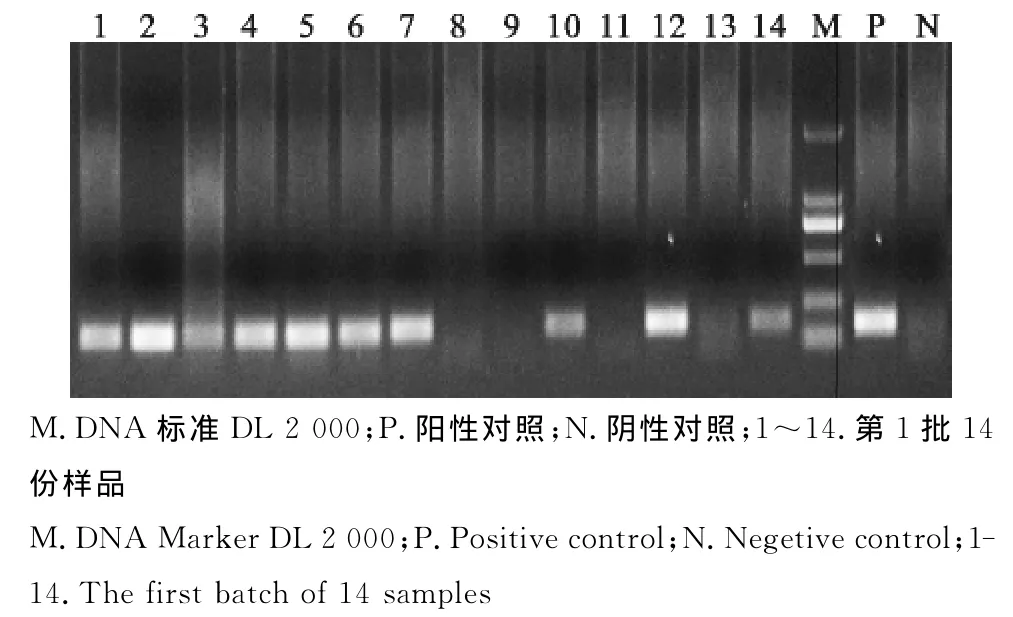
图1 处理前猪瘟病毒RT-PCR检测Fig.1 RT-PCR test for CSFV before the treatment
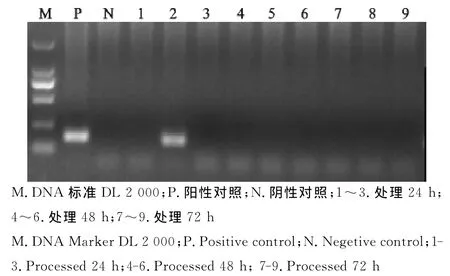
图2 处理后猪瘟病毒RT-PCR检测Fig.2 RT-PCR test for CSFVafter the treatment
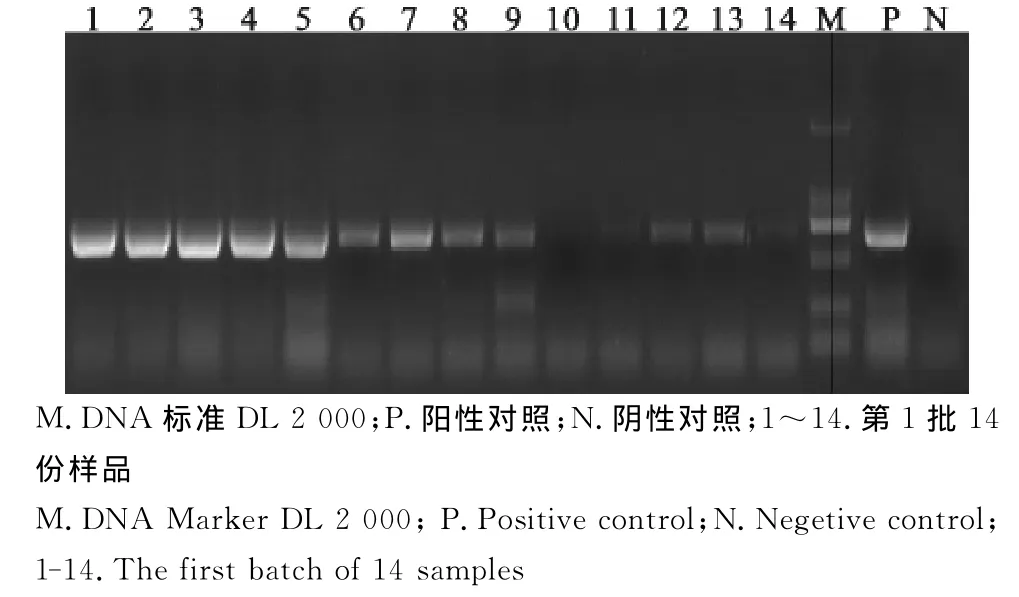
图3 处理前猪圆环病毒PCR检测Fig.3 PCR test for PCV before the treatment
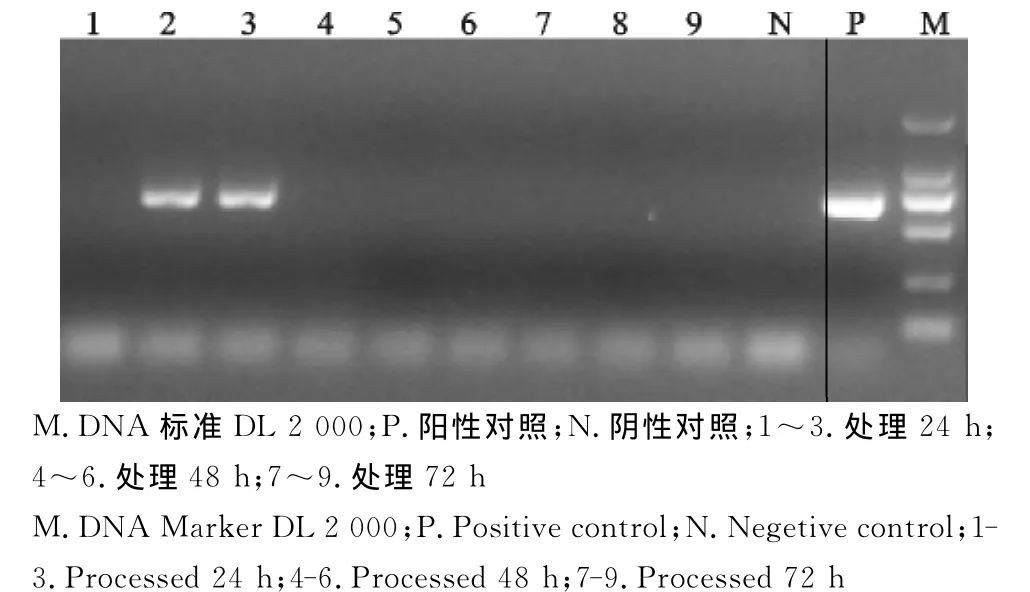
图4 处理后猪圆环病毒PCR检测Fig.4 PCR test for PCV after the treatment

图5 处理前伪狂犬病病毒PCR检测Fig.5 PCR test for PRV before the treatment

图6 处理后伪狂犬病病毒PCR检测Fig.6 PCR test for PRV after the treatment
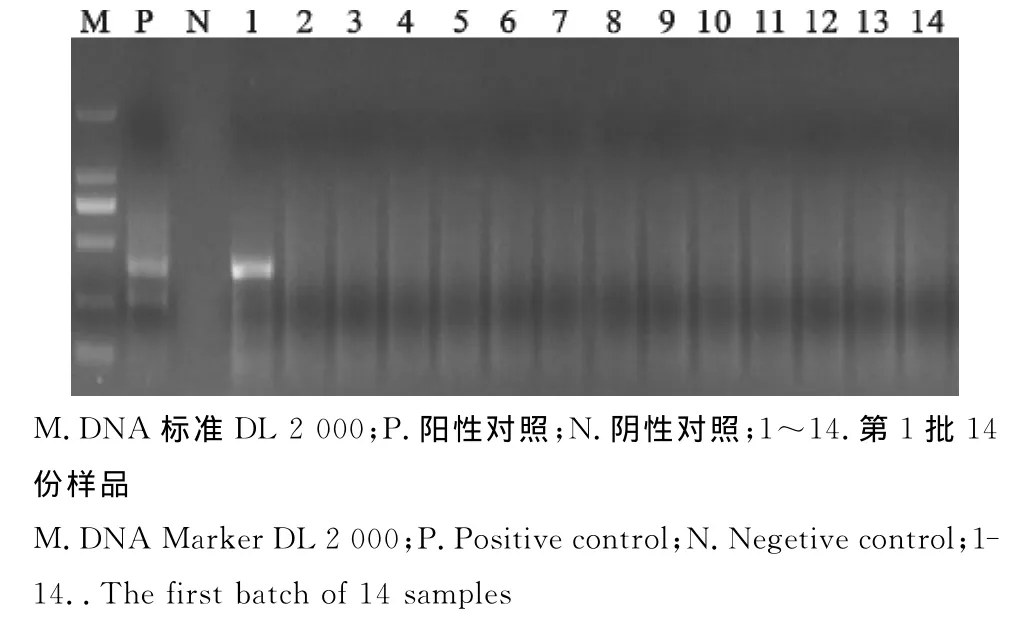
图7 处理前猪蓝耳病病毒RT-PCR检测Fig.7 RT-PCR test for PRRSV before the treatment

图8 处理后猪蓝耳病病毒RT-PCR检测Fig.8 RT-PCR test for PRRSV after the treatment

图9 处理前副猪嗜血杆菌PCR检测Fig.9 PCR test for Hps before the treatment
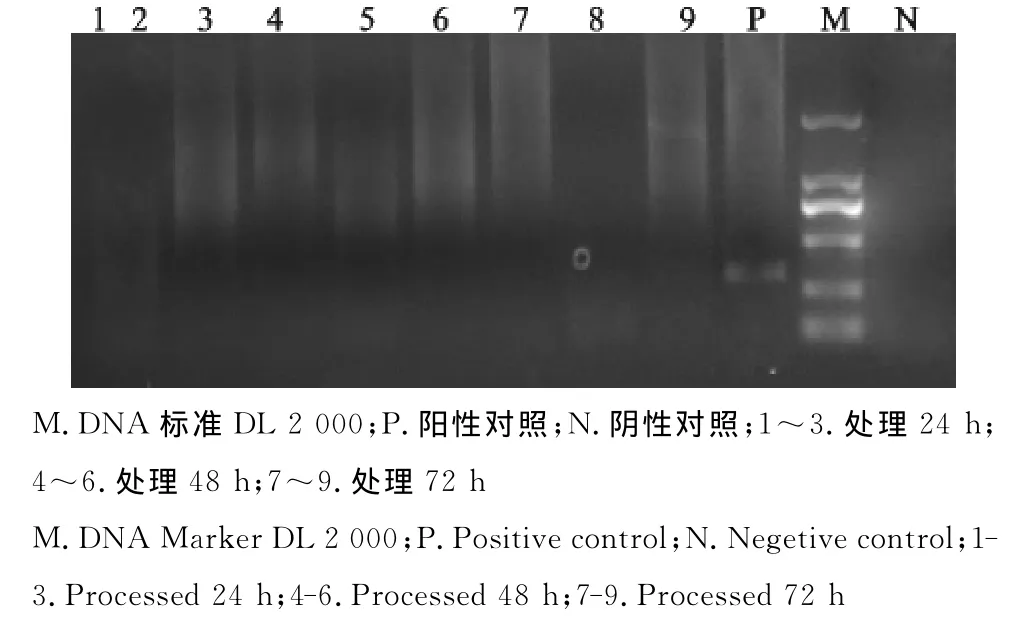
图10 处理后副猪嗜血杆菌PCR检测Fig.10 PCR test for Hps after the treatment
两种发酵菌种使用效果比较结果显示,使用发酵菌种Ⅰ的第1批、第4批次样品在处理24h时猪瘟病毒、猪圆环病毒仍有阳性,处理72h后猪瘟病毒等5种病原全部被杀灭,并且第1批样品中猪蓝耳病病毒、伪狂犬病病毒、副猪嗜血杆菌在处理24h后已经被杀灭;使用发酵菌种Ⅱ的第2批、第3批、第5批、第6批样品在处理72h后猪瘟病毒仍有活性。
2.2病毒分离培养鉴定
取4批经热辅快速生物发酵分解工艺进行无害化处理72h后的猪瘟病毒阳性样品在PK-15细胞上进行病毒的分离培养,并利用RT-PCR方法进行了鉴定,结果表明,只有第2批的猪瘟阳性样品未分离出猪瘟病毒,其他3批阳性猪瘟样品均分离出了猪瘟病毒。
3 讨论
自黄浦江漂浮死猪事件以来,国家加强了病死猪无害处理的监督工作,出台了一系列实施方案,制定了具体措施。但目前传统的工艺存在高污染、高成本、操作繁琐等缺点,不便于推广,不利于开展无害化处理工作,评价和筛选理想的无害化处理工艺无害化处理效果对推动全国病死猪无害化处理工作,保障畜产品安全具有重要意义。
本研究对处理前及处理24、48、72h时的样品进行11种病原检测的结果表明,发酵菌种的不同及处理时间的长短影响该工艺的处理效果。使用发酵菌种Ⅰ在处理24h时能检测到猪瘟病毒和猪圆环病毒阳性,处理48h样品检测所有病原均为阴性;而使用发酵菌种Ⅱ处理的样品处理48h时第2批次样品猪圆环病毒仍为病原学阳性,处理48h和72 h时,所有批次样品均为猪瘟病毒病原阳性。说明使用发酵菌种Ⅰ无害化处理所用时间短(该工艺一个周期为72h),且处理病原效果较好。使用该菌种
在一个处理周期内,能实现对病原的无害化处理;而使用发酵菌种Ⅱ无害化处理72h后猪瘟病毒仍具有活性,说明使用菌种Ⅱ在该工艺一个处理周期内无法彻底杀灭病原,仍需优化该菌种所需要的处理时间。
本研究采用PCR对6批次处理前后的样品进行比较,无害化处理72h后,除猪瘟病毒外,其他病原均被杀灭,该工艺基本达到了无害化处理要求。猪瘟病毒在处理72h后仍具有活性,可能是处理设备内温度、发酵菌种分布不均匀,温度较低、发酵菌种较少区域的猪瘟病毒未被杀灭,说明此工艺对猪瘟病毒的杀灭效果不理想,此工艺在温度控制、菌种选择、处理时间上仍需进一步优化;也可能是处理后样品在检测过程中被二次污染造成结果呈现阳性。但从总体处理效果上来说,基本达到了无害化处理要求,是目前较为理想的无害化处理工艺。
本研究首次采用PCR检测方法,评价热辅快速生物发酵分解工艺的无害化处理效果,建立了科学的评价体系。通过比较不同时间的处理效果,评价该工艺的无害化处理时间是否合理;通过对2种菌种无害化处理效果比较,评价了菌种的不同对该工艺处理效果的影响。充分证明了此工艺在病死动物尸体无害化处理上有很好的利用价值及研究空间,此工艺在菌种的选择、温度的调控、时间的控制等条件均需进一步的优化,为热辅快速生物发酵分解工艺的发展和推广应用提供有力的依据。
参考文献:
[1] 王兴平.病死动物尸体处理的技术与政策探讨[J].甘肃畜牧兽医,2011(6):26-29.
[2] 邓 敏,刘 莹,曾 吉,等.肺炎克雷伯菌分布特征及耐药性分析[J].中国抗感染化疗杂志,2001,1(2):98-99.
[3] 王新福.生物发酵无害化处理病死猪探讨[J].猪业科学,2013 (10):38-39.
[4] 农业部关于印发《病死动物无害化处理技术规范》的通知[Z].农医发2013[34]号.
[5] 浦 华,白裕兵.我国病死动物无害化处理与发展对策[J].生态经济,2013,30(5):135-136.
[6] 周开锋.病死猪无害化处理技术浅析[J].猪业观察,2014(2):90-91.
[7] 周开锋.几种病死猪生物降解技术应用实效分析[J].猪业科学,2013(10):46-49.
[8] 隋士元,许结红,胡俊苗.宜昌高温生物降解无害化处理技术应用与推广[J].中国畜牧业,2013(15):30-31.
[9] 陈淑才.生物发酵处理病死猪技术申请国家专利[J].农产品加工(上),2013(2):62-63.
[10] 安春霞,闫若潜,吴志明,等.高致病性与低致病性猪繁殖与呼吸综合征病毒二重RT-PCR检测方法的建立及应用[J].中国畜牧兽医,2013,40(5):66-70.
[11] 闫若潜,吴志明,张志凌,等.猪链球菌种与9型猪链球菌二重PCR检测方法的建立及应用[J].中国动物检疫,2009,26 (8):26-29.
[12] 赵雪丽,闫若潜,陈慧娟,等.鉴别猪伪狂犬病毒gE基因缺失疫苗和野毒感染的二重PCR诊断方法的建立和应用[A].中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集[C].徐州:中国畜牧兽医学会家畜传染病学分会、解放军军事医学科学院军事兽医研究所,2013:428-432.
[13] 王东方,安春霞,刘光辉,等.猪圆环病毒1、2型多重PCR诊断方法建立及应用[A].中国畜牧兽医学会动物传染病学分会.中国畜牧兽医学会家畜传染病学分会第七届全国会员代表大会暨第十三次学术研讨会论文集(上册)[C].南宁:中国畜牧兽医学会动物传染病学分会,2009:518-521.
Evaluation of Effect on Harmless Treatment of Dead Pig Carcass by Process of Rapid Biological Fermentation Decomposition
CHEN Teng-fei1,2,WU Zhi-ming2,LIU Yang-li1,2,YAN Ruo-qian2,XIE Cai-hua2,WANG Shu-juan2,LI Qin-nan2
(1.Henan Agricultural University,Zhengzhou,Henan,450002,China;2.Henan Centre for Animal Disease Control and Prevention,Zhengzhou,Henan,450008,China)
Abstract:In order to assess the effect on harmless treatment of the dead pig carcass by rapid decomposition of biological fermentation process;Pathogens in the dead pig carcass that were disposed by rapid decomposition of biological fermentation process were detected by the viral isolation culture,RT-PCR and PCR. The effect on harmless treatment of the dead pig carcass by this method was assessed through the comparison of pathogenic microorganism detection rate before and after the treatment.The results showed that porcine circovirus virus,pseudorabies virus,porcine parvovirus,Streptococcus suis and other common microorganisms in dead pigs can be killed except classical swine fever virus after 72hours.It can be proved that the method can basically meet the requirements of harmless treatment.
Key words:biological fermentation;harmless treatment;dead pig carcass;effect;assessment
通讯作者
作者简介:陈腾飞(1989-),男,河南人,硕士,主要从事动物传染病研究。*
基金项目:河南省科技攻关项目(142102310224)
收稿日期:2014-08-14
中图分类号:S851.4
文献标识码:A
文章编号:1007-5038(2015)05-0081-05
