牛羊日本血吸虫抗体检测试纸条的研制
2015-02-27阳爱国董国栋邓永强吴云飞田慧云朱银宝四川省动物疫病预防控制中心四川成都600湖北省动物疫病预防控制中心湖北武汉0000云南省动物疫病预防控制中心云南昆明600四川省广汉市动物疫病预防控制中心四川德阳68000南京路宝生物科技有限公司江苏南京0000
阳爱国,周 煜,郭 莉,董国栋,邓永强,侯 巍,吴云飞,田慧云,马 坤,陈 冬,文 豪,朱银宝(.四川省动物疫病预防控制中心,四川成都600;.湖北省动物疫病预防控制中心,湖北武汉0000;.云南省动物疫病预防控制中心,云南昆明600;.四川省广汉市动物疫病预防控制中心,四川德阳68000;.南京路宝生物科技有限公司,江苏南京0000)
牛羊日本血吸虫抗体检测试纸条的研制
阳爱国1,周煜2,郭莉1,董国栋3,邓永强1,侯巍1,吴云飞4,田慧云2,马坤3,陈冬1,文豪1,朱银宝5
(1.四川省动物疫病预防控制中心,四川成都610041;2.湖北省动物疫病预防控制中心,湖北武汉430000;3.云南省动物疫病预防控制中心,云南昆明650051;4.四川省广汉市动物疫病预防控制中心,四川德阳618000;5.南京路宝生物科技有限公司,江苏南京210000)
摘 要:为研制一种快速检测牛羊血吸虫抗体的试纸条检测方法,以乳胶微球标记兔抗牛羊IgG为免疫探针,血吸虫虫卵可溶性抗原为检测线,羊抗兔IgG为质控线,建立了快速检测牛羊血吸虫抗体的试纸条检测法。该方法可测出人工感染血吸虫尾蚴28d及以上的牛血纸抗体,检测东毕吸虫、肝片吸虫血样未见交叉反应;用试纸条检测人工接种血吸虫牛血纸20份、非疫区牛血纸30份,与Dot-ELISA法、粪孵法的阳性符合率和阴性符合率均为100%。血吸虫抗体检测试纸条在2℃~8℃保存14个月,室温保存8个月不失效。试验表明,血吸虫病血纸抗体检测试纸条具有很高的敏感性、特异性、可重复性和稳定性,适合于基层单位进行家畜血吸虫抗体的快速诊断、普查和检疫。
关键词:抗体检测试纸条;血吸虫病;家畜;快速诊断
血吸虫病是一种严重危害公共卫生安全的人畜共患寄生虫病,主要流行于亚洲、非洲和拉丁美洲。人体血吸虫主要有6种,分布于全球78个国家和地区[1],对人体影响较大的血吸虫主要有日本血吸虫
(S.japonicum)、曼氏血吸虫(S.mansoni)和埃及血吸虫(S.haematobium),我国目前仅有日本血吸虫流行[2]。日本血吸虫严重威胁着疫区人民的身体健康和生命安全,同时也给畜牧业带来巨大经济损失[3]。现在基层单位家畜血吸虫病的主要诊断方法是间接血凝试验(indirect haemagglutination assays,IHA)[4]和粪孵毛蚴法,前一方法抗原用量大、用时长,重复性与稳定性较差;后者需投入大量的人、财、物,易漏检且效率低,延误查治时机,这些方法已不能适应快速、简便、准确诊断的要求。
虽然近年来在诊断家畜血吸虫病的方法中出现了一种快速检测方法——双夹心金标免疫渗滤法(DIGFA),但由于该胶体金标记的抗原(或抗体)不稳定,保存期只有6个月,并且检测结果受NC膜质量和批次的影响较大,加上反应板体积大,试剂为液体,不能通过航空和铁路运输等原因[5]。血防人员迫切希望有一种更快速简便、敏感性高、特异性强、保存期长、经济实用、易于标准化的诊断新技术,以提高血吸虫病的监测监控水平。
本试验的抗体检测试纸条根据乳胶微球免疫层析法(DLIA)原理研制,该方法是近年来从胶体金免疫层析法(GICA)基础上发展起来的新技术,它用红色乳胶微球代替胶体金作为标记物。乳胶是工业化生产的高分子微球,颗粒大小均一,在液体中形成稳定的乳液体系,乳胶微球与胶体金相比,颗粒较大(200nm~300nm),用它作为显色示踪物可节省抗体或抗原用量;乳胶微球经羧基化后,可与兔抗牛羊IgG的氨基共价结合,形成的乳胶微球-兔抗牛羊IgG结合物结构稳定,可长期保存,较好地克服了胶体金标记物不够稳定的缺点。本试验利用乳胶微球标记兔抗牛羊IgG为免疫探针制备牛羊血吸虫病血纸抗体检测试纸条,并进行了敏感性、特异性、重复性、稳定性和操作性等研究,为该试纸条的推广应用提供科学依据。
1 材料与方法
1.1材料
乳胶微球、NHS、MES、DEC•HCl、硼砂、硼酸、BSA、KH2PO4、Na2HPO4、蔗糖等试剂及聚酯膜、玻璃纤维、硝酸纤维素膜等耗材全部采用SIGMA公司、Pall公司等进口产品;HCl、NaOH等试剂为国产分析纯试剂;吸水纸,PVC板、上不粘胶、下不粘胶等购自上海金标生物科技有限公司;血吸虫虫卵可溶性抗原,自制;兔抗牛羊IgG,自制。
1.2方法
1.2.1血纸及血清的制备
1.2.1.1血吸虫阳性血清及血纸的制备 ①人工接种牛血吸虫阳性血清及血纸的制备。选非疫区健康牛10头,经粪孵及Dot-ELISA检查血吸虫均为阴性,每头牛人工接种血吸虫尾蚴1 000条,接种前采血清及血纸,接种后第3周开始采血,以后每周采血一次直至第7周,分别制备血清及血纸各50份,置于-20℃保存备用。②人工接种羊血吸虫阳性血清及血纸的制备。选非疫区健康羊5只,经粪孵及Dot-ELISA检查血吸虫均为阴性,每只羊人工接种血吸虫尾蚴300条,接种前采血清及血纸,第3周开始采血,以后每周采血一次直至第7周,分别制备血清及血纸各25份,置于-20℃保存备用。③自然感染血吸虫病牛阳性血纸的制备。选择湖北、四川、云南血吸虫病疫区经粪孵确诊为血吸虫病阳性牛,按常规制备血纸,置于-20℃保存备用。
1.2.1.2血吸虫阴性血清及血纸的制备 选血吸虫病非疫区健康牛羊各10头(只),经粪孵无血吸虫毛蚴,Dot-ELISA检测为阴性,分别采血制备血清及血纸,置-20℃保存备用。
1.2.2血吸虫虫卵可溶性抗原的制备
1.2.2.1血吸虫虫卵的获取 挑选体重2.5kg新西兰兔10只,腹部剃毛,用接种环挑取液面尾蚴,置载玻片上,在显微镜下计数尾蚴,然后将有尾蚴的盖玻片贴于兔腹部皮肤暴露处感染5min~15min,每只兔接种2 000条尾蚴。接种45d后取出兔肝脏,除去胆囊、胆管及结缔组织,用4℃预冷的10g/L NaCl洗去血污,将肝脏剪成碎块,以8 000r/min捣碎,每次捣2min,停2min直至完全捣碎均匀。捣碎的肝脏加适量10g/L NaCl稀释,用60、80、100 和120目筛过滤,滤液再经260孔尼龙网过滤,用10g/L NaCl冲洗并收集尼龙网上的虫卵,然后以3 500r/min离心1min,弃去上、中层,下层金黄色虫卵反复用10g/L NaCl洗涤,离心,获得纯净的血吸虫卵,虫卵进行冻干保存。
1.2.2.2可溶性抗原的提取 取冻干的血吸虫卵,用玻璃匀浆器研磨30min,再加少量8.5g/L NaCl研磨30min,然后配成40mL/L悬液,置4℃冰箱浸泡2d,-20℃反复冻融8次,超声裂解30min (400W),将裂解液以9 000r/min离心50min,取上清即为血吸虫虫卵可溶性抗原。
1.2.3检测试纸条的制备
1.2.3.1检测线和质控线的制备 将硝酸纤维素膜粘贴在PVC底板的中间部位,将血吸虫卵可溶性
抗原蛋白稀释成4mg/mL,在硝酸纤维素膜上制作检测线(T线);将羊抗兔IgG蛋白稀释成0.2 mg/mL,在硝酸纤维素膜上制作质控线(C线)。
1.2.3.2乳胶微球标记兔抗牛羊IgG免疫探针干片的制备 ①兔抗牛羊IgG-乳胶微球结合物的制备。羧基活化的红色乳胶微球(以下简称乳胶微球)对pH8.2 0.1mol/L硼酸缓冲液稀释的兔抗牛羊IgG进行标记,然后用200mL/L的BSA封闭,然后以13 000r/min离心30min,用Tris-HCl缓冲液将牛血清白蛋白稀释成5mL/L的封闭液将沉淀重悬,超声波匀质后制成兔抗牛羊IgG-乳胶微球结合物。②免疫探针干片制备。将兔抗牛羊IgG-乳胶微球结合物以3.5μL/cm的流速喷涂于聚酯膜上,37℃烘干,制成免疫探针干片。
1.2.3.3试纸条的组装 将样品垫、兔抗牛羊IgG-乳胶微球结合物免疫探针干片、划有T和C线的硝酸纤维素膜(以下简称层析膜)及吸水纸组装在PVC板上组装成大卡,用切条机切成0.3cm×7.5 cm规格的试纸条;用铝箔袋将试纸条以50份/袋进行包装并封口。
1.2.3.4检测操作方法 ①操作前准备。试纸条从冰箱取出置室温平衡1h;②操作步骤。裁剪血纸圆片0.24cm2放在0.4mL血纸浸泡液中,室温浸泡30min;取试纸条,将带箭头端的试纸条插入已摇匀浸泡好的血纸液中(图1),待液体在NC膜上渗出0.5cm左右时,将试纸条平放在盘中或桌面上,5min~30min内观察结果;③结果判定。T、C线均出现红色带,判为阳性;仅C线出现红色带,则判为阴性;T、C线均不出现红色带,判为无效(图2)。

图1 试纸条浸入样品液Fig.1 The strip immerged into sample solution
1.2.4试纸条检测条件筛选
1.2.4.1最佳血纸浸泡液pH的选择 取人工接种血吸虫阳性牛血纸10份、羊血纸5份血纸及健康牛血纸10份、羊血纸5份,各自裁取0.24cm2面积血纸片4片,分别用pH6.4、pH6.8、pH7.2和pH7.6的0.1mol/L PBS血纸浸泡液(以下简称血纸浸泡液)0.4mL室温浸泡30min后,用试纸条进行检测,筛选最佳pH的血纸浸泡液。
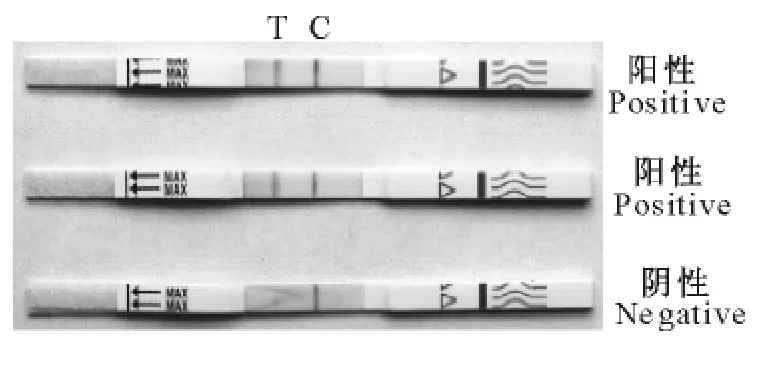
图2 结果判定标准Fig.2 The determination standard of results
1.2.4.2最佳血纸使用面积的选择 取人工接种血吸虫牛羊血纸与健康(阴性)牛羊血纸各5份,分别裁取0.12、0.24、0.36cm2的血纸用0.4 mL pH6.8 0.1mol/L的PBS浸泡液室温浸泡30min,用试纸条进行检测,筛选最佳血纸使用面积。
1.2.4.3最佳血清稀释液pH的选择 分别使用pH6.8、pH7.2和pH7.6 0.1mol/L PBS稀释液对人工接种血吸虫阳性牛血清及健康牛血清各10份作1∶1(2倍)稀释,使用试纸条进行检测,筛选最佳pH血清稀释液。
1.2.4.4最佳血清稀释倍数的选择 使用pH7.2 0.1mol/L的PBS稀释液对人工接种42d和49d的阳性牛血清及健康牛血清各10份分别作1∶1、1∶2和1∶3倍稀释,使用试纸条检测,筛选血清最佳稀释倍数。
1.2.4.5试纸条最佳平衡时间的选择 将试纸条从4℃~8℃冰箱取出置室温(15℃~32℃)进行平衡,每隔20min检测10份牛羊血吸虫阳性血纸及10份健康牛血纸,筛选试纸条在室温的最佳平衡时间。
1.2.5试纸条检测方法的初步评价
1.2.5.1敏感性试验 用试纸条检测人工接种血吸虫尾蚴1 000条0、21、28、35、42、49d的10头牛血纸,考察试纸条可检测出人工接种牛血吸虫抗体的最早时间。
1.2.5.2特异性试验 用试纸条分别检测人工接种血吸虫牛、羊阳性血纸各10份,自然感染东毕吸虫和肝片吸虫的牛阳性血纸各5份,考察试纸条对与血吸虫有亲缘关系的寄生虫是否有交叉反应。
1.2.5.3重复性试验 用5批次试纸条分别检测人工接种血吸虫尾蚴0、35、42、49d的5头牛血清及血纸,比较不同批次的检测结果,考察试纸条的可重复性。
1.2.5.4符合率试验 ①血纸与血清的阴、阳性符合率的比较。人工接种血吸虫牛血清和血纸各8份
及羊血清和血纸各5份,自然感染粪孵确诊血吸虫病牛血清和血纸各20份及羊血清和血纸各10份,非血吸虫病疫区牛羊阴性血清和血纸各50份,用pH6.8 0.1mol/L PBS 0.4mL浸泡0.24cm2血纸30min,用pH7.2 0.1mol/L PBS对血清进行2倍稀释,比较试纸条在血纸与血清之间的阴、阳性符合率。②试纸条与Dot-ELISA法的符合率比较。用试纸条和Dot-ELISA法分别检测人工接种血吸虫牛阳性血纸20份及非疫区健康牛血纸15份,比较试纸条与Dot-ELISA法的符合率。③试纸条与粪孵血吸虫法的符合率比较。用试纸条检测粪孵确诊为感染血吸虫病牛阳性血纸15份,比较试纸条与粪孵血吸虫法的符合率。
1.2.5.5保存期试验 将试纸条分别置室温(10℃~34℃)及2℃~8℃保存,每隔2个月取出室温和2℃~8℃保存的试纸条分别测定血吸虫病阳性牛血纸及阴性牛血纸各15份,观察不同保存条件下试纸条可正确判定阴阳性血纸的最长保存时间。
2 结果
2.1试纸条检测条件筛选
2.1.1最佳血纸浸泡液pH的选择 试验结果显示,用pH6.4 0.1mol/L PBS浸泡液虽能检出人工接种血吸虫牛羊血纸抗体阳性率达100%,但对健康牛羊血纸检测假阳性率达20%;当用pH6.8 0.1 mol/L PBS浸泡液浸泡人工接种血吸虫牛羊血纸及健康牛羊血纸时,其阴、阳性检出率均达100%;而用pH7.2和pH7.6 0.1mol/L PBS浸泡液浸泡,虽然健康牛、羊的阴性检出率均为100%,但检测人工接种血吸虫牛血纸的阳性检出率分别为90%和70%,羊血纸的阳性检出率分别为100%和80%。因此,以pH6.8 0.1mol/L PBS浸泡液为最佳pH血纸浸泡液(表1)。
2.1.2最佳血纸使用面积的确定 试验结果显示,当血纸使用面积为0.12cm2时,健康牛羊的血纸的阴性率虽然均为100%,但人工接种血吸虫的牛羊血纸的阳性率均只有60%;当血纸面积使用0.24 cm2时,健康牛羊和人工接种血吸虫的阴、阳性检出率均分别为100%;当血纸面积用0.36cm2,虽然阳性检出率为100%,但阴性血纸的假阳性率亦达20%。所以选择0.24cm2为血纸的最佳使用面积(表2)。

表1 使用不同pH血纸浸泡液的检测结果Table 1 The test results of blood paper soaked in different pH buffer

表2 血纸不同使用面积的检测结果Table 2 The test results of blood paper in different area
2.1.3最佳血清稀释液pH的选择 试验结果显示,用pH6.8 0.1mol/L PBS对血清进行稀释,虽然阳性检出率达100%,但阴性血清的假阳性率达10%;使用pH7.2 0.1mol/L PBS进行稀释,其阴、阳性检出率均为100%(10/10);但用pH7.6 0.1 mol/L PBS稀释的血清,虽然健康牛血清检测的阴性率为100%,但人工接种血吸虫的牛血清阳性检出率仅为60%(6/10)。因此选用pH7.2 0.1 mol/L PBS作为血清的最佳稀释液(表3)。
2.1.4最佳血清稀释倍数的确定 试验结果显示,血清作1∶1稀释时阳性检出率为100%;血清1∶2稀释的血清的阳性检岀率仅为90%;血清1∶3稀释的阳性检岀率仅达80%;健康牛血清用原液检测却岀现10%假阳性;健康牛血清进行不同比例稀
释,阴性率均为100%。所以血清进行1∶1稀释(2倍)作为最佳稀释倍数(表4)。

表3 血清使用不同pH的PBS稀释液检测结果Table 3 The test results of PBS with different pH
2.1.5试纸条最佳平衡时间的确定 试验结果显示,试纸条置室温20、40、60min,检测10份血吸虫阳性牛羊血纸及10份健康牛血纸其阳性检岀率分别为80%、100%、100%(表5)。试纸条刚从4℃~8℃冰箱取出因温度低,抗原与抗体反应速度慢,T、C线条带颜色浅,易造成漏检。因此,试纸条的最佳平衡时间为40min~60min。

表4 血清不同稀释比例的检测结果Table 4 The test results of serum in different dilutions

表5 试纸条不同平衡时间的检测结果Table 5 The test results of of strip in different equilibrium time
2.2试纸条检测方法的初步评价
2.2.1敏感性试验 试验结果显示,试纸条检测10头牛血纸在接种前均为阴性;1号、2号、4号、6号、7号和9号牛在接种血吸虫毛蚴的28d时出现阳性反应,检出率为60%,3号、5号、8号和10号牛在35d时也出现阳性反应,至此所有感染牛的血纸阳性检出率为100%;人工接种42d、49d,所有牛血纸的阳性检出率仍为100%(表6)。

表6 试纸条的敏感性试验结果Table 6 The sensibility test results of the strip
2.2.2特异性试验 试验结果显示,试纸条检测牛、羊血纸阳性率100%,检测为出现阳性反应,可见试纸条检测血吸虫不会与东毕吸虫和肝片吸虫出现交叉反应(表7)。
2.2.3重复性试验 试验结果显示,用5批次试纸条检测人工接种血吸虫尾蚴0、35、42、49d的5头牛血清及血纸结果,每批次试纸条均能检出感染35d~49d的血清和血纸抗体,阳性检岀率为100%,各批次重复率100%(表8)。
2.2.4符合率试验
2.2.4.1血纸与血清的阴、阳性符合率的比较 试验结果显示,人工接种牛羊血吸虫的血纸与血清、自然感染粪孵确诊血吸虫病牛羊血纸与血清的阳性符合率均为100%;非血吸虫病疫区牛羊血纸与血清的阴性符合率为100%,试纸条检测血清和血纸和符合率达100%(表9)。

表7 试纸条的特异性试验结果Table 7 The specificity test results of the strip
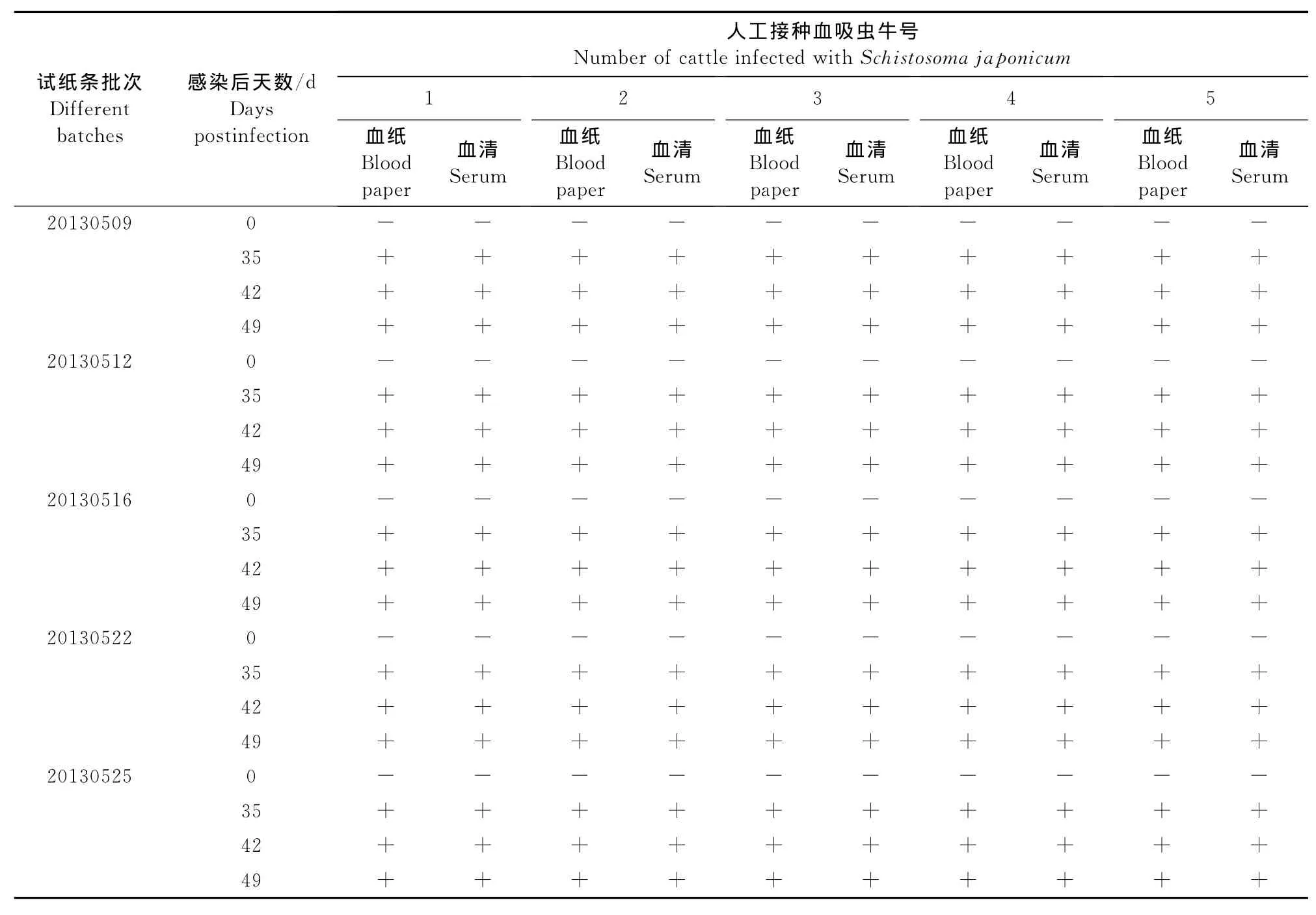
表8 试纸条的重复性试验结果Table 8 The repeatability test results of the strip
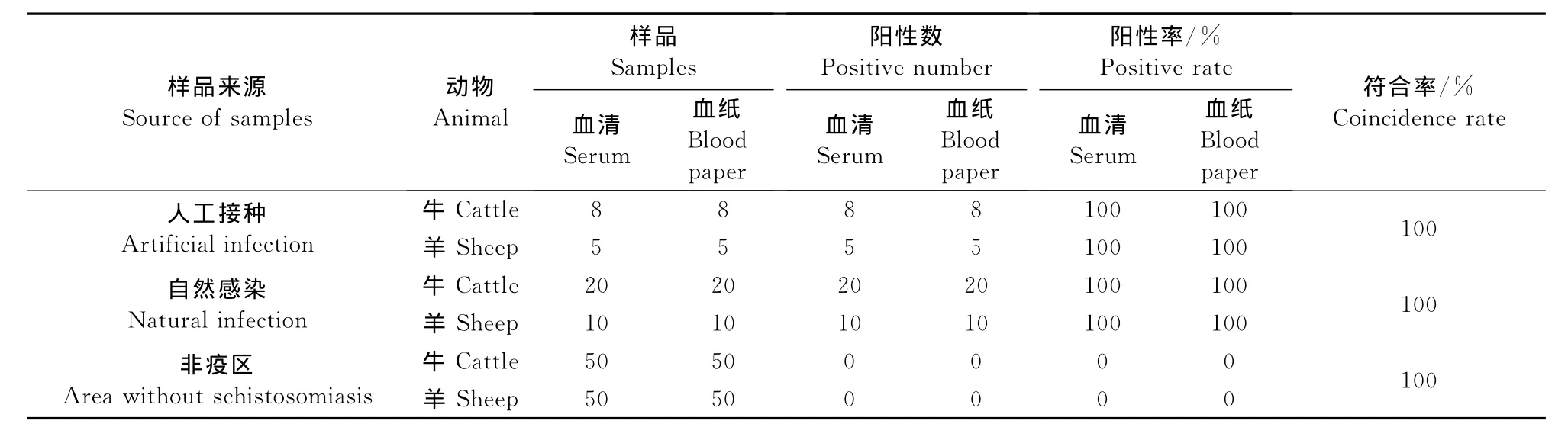
表9 血纸与血清阴、阳性符合率比较试验结果Table 9 Comparison of coincidence rates of detecting blood papers and sera
2.2.4.2试纸条与Dot-ELISA法的符合率比较试验结果表明,试纸条与Dot-ELISA法对人工接种血吸虫的20份牛血纸检测均为阳性,阳性符合率达100%;检测健康牛血纸15份均为阴性,阴性符合率达100%。试纸条与Dot-ELISA法的符合率为100%(表10)。

表10 试纸条与Dot-ELISA的阴、阳性符合率比较结果Table 10 The comparison of coincidence rates between the results determined with strip and Dot-ELISA
2.2.4.3 试纸条与粪孵血吸虫法的符合率比较
用试纸条测定粪孵确诊为感染血吸虫病牛血纸15份,所有牛血纸均呈阳性反应,试纸条与粪孵法的符合率达100%。
2.2.5试纸条保存期试验 试验结果显示,试纸条在2℃~8℃保存2个~14个月,15份阳性血吸虫病牛血纸均检测为阳性,检出率均为100%,保存至16和18个月时,15份阳性样品分别只能检测出14份和11份阳性,检出率分别仅为93.3%和73.3%;试纸条在室温保存2个~8个月时,15份阳性血纸均检测呈阳性,检出率均为100%,保存至10、12、14、16和18个月时,15份阳性血纸分别能检出14份、10份、9份、5份和4份阳性,检出率依次降为93.3%、66.7%、60%、33.3%和26.7%。试纸条在2℃~8℃和室温保存2个~18个月,15份阴性血纸检测均呈阴性,无假阳性出现。结果表明,试纸条在2℃~8℃保存有效期可长达14个月,在室温(10℃~34℃)保存的有效期为8个月。

表11 试纸条在不同温度的保存期试验结果Table 11 The detection results of preservation period of the strips under different temperatures
3 讨论
3.1试纸条与常用血吸虫抗体检测方法的比较
IHA法是最早用于检测血吸虫抗体的检测方法,它特点是以致敏红血球为标记物质,但致敏红血球的制备比较繁琐,制备过程需要二十多步[6],检测时间比较长,且需要一定的试验环境,敏感性不高,不利于基层快速、简便检测。ELISA法则是使用酶标记的抗抗体进行检测,该法首先要制备抗抗体,然后再使用辣根过氧化物酶标记,其制备过程又长又繁琐,在检测时还需要一定的试验环境和相应的试验仪器,需要具有一定专业技术的人员操作,不利于快速、广泛的使用。随后发展的金标法以及在此基础上研制的金标免疫渗滤法(DIGFA)和二抗金标免疫渗滤法(T-DIGFA)均采用胶体金作标记物,虽然有易操作、快捷等优点,但由该胶体金标记的抗原(或抗体)不稳定,保存期较短,并且检测结果受NC膜质量和批次的影响较大,加上反应板体积大,试剂为液体,不能通过航空和铁路运输,不利于工业化生产和航空运输。
本试验的抗体检测试纸条是依据乳胶微球免疫层析法(DLIA)进行研制,使用红色乳胶微球作为标记物。乳胶是工业化生产的高分子微球,颗粒大(200nm~300nm)且颗粒大小均一,用它作为显色示踪物用更少的抗体或抗原便能清晰显色;乳胶微球在液体中形成稳定的乳液体系,经羧基化后与兔抗牛羊IgG以氨基共价结合,其结构稳定,试验结果显示试纸条在2℃~8℃保存有效期可长达14个月,在室温保存的有效期为8个月,比T-DIGFA法还多保存2个月[7]。敏感性试验表明试纸条检测到血吸虫抗体的时间在28d~35d,早于李友等[8]使用间接ELISA诊断方法检测试验感染血吸虫尾蚴抗体阳性的时间35d~56d,具有较好的敏感性。在试验操作上,用试纸条检测过程仅需5min~30 min,操作简单;目测判断结果,不需特定试验仪器和环境;为全固态自显色测定装置,利用运输、邮寄和携带。
3.2试纸条符合率、特异性试验及检测样品的选择
符合率和特异性试验有利于考察试纸条检测的准确性和专一性,避免漏检或假阳性的出现。Dot-ELISA法[9]为血吸虫抗体检测最为普遍使用的方法,而粪孵血吸虫法又是最为准确确诊法,试纸条与Dot-ELISA法和粪孵血吸虫法的阴、阳符合率均达到100%,可见试纸条具有很好的普适性和准确性。特异性试验中选择东毕吸虫和肝片吸虫进行交叉反
应试验,东毕吸虫与日本血吸虫亲缘关系较近且生活史相似,而肝片吸虫与血吸虫同为吸虫纲,以这两种吸虫最特异性试验可避免在实际生产检测中出现假阳性、误诊现象,试验结果表明该试纸条不与毕吸虫和肝片吸虫产生交叉反应,具有良好的特异性。血纸与血清样品检测的阴阳性符合率均为100%,使用血纸为检测样品并不影响检测结果。本方法的检测样品血纸仅采集几滴血即可制成,样品采集方便,且比血清样品更易贮存、运输,又不需要冷藏,有利于基层推广使用。
3.3结语
试纸条检测操作仅需一步,可大批检测又可单份检测,短时间就能目测判断结果,不需任何仪器设备,携带方便,便于运输,适用于基层血吸虫病的监测、普查及检疫。该试纸条稳定性好,保存期长,反应结果也可长期保存,以利于回顾性分析和研究。该技术在血吸虫病流行区推广应用,可节省大量的人力、物力和财力,其推广使用对巩固血防成果,促进畜牧业和社会经济发展具有重要意义,具有良好的推广使用价值和市场开发前景。
参考文献:
[1] World Health Organization.Schistosomiasis:progress report 2001-2011,strategic plan 2012-2020[R].Geneva:WHO,2013:17.
[2] 官 威,李石柱,许 静.非洲主要血吸虫病诊断技术研究进展[J].国际医学寄生虫病杂志,2014,41(2):99-104.
[3] 林矫矫,胡述光,刘金明.中国家畜血吸虫病防治[J].中国动物传染病学报,2011,19(3):75-81.
[4] 陈年高,林丹丹,谢曙英,等.日本血吸虫病间接血凝试验诊断试剂盒临床诊断效能[J].中国血吸虫病防治杂志,2011,23(4):377-380.
[5] 徐 蓉.血吸虫抗体快速检测方法的建立及临床应用[J].中外医学研究,2011,9(24):64-65.
[6] 农业部血吸虫病防治办公室.动物血吸虫病防治手册[M].北京:中国农业科技出版社,1998:83-87.
[7] 卢福庄,方兰勇,张雪娟,等.检测家畜血吸虫抗体的二步金标免疫渗滤法研究[J].畜牧兽医学报,2006,37(7):687-692.
[8] 李 友,赵俊龙.牛血吸虫病分子ELISA诊断方法的建立和应用[D].湖北武汉,华中农业大学,2008.
[9] Si W M,Wang T P.Progress of researches on diagnostic antigens of schistosomiasis japonica[J].Chin J Schisto Control 2012,24(3):345-349.
Development of Diagnostic Strip for Detecting Cattle and Sheep Antibodies Against Schistosoma japomicum
YANG Ai-guo1,ZHOU Yu2,GUO Li1,DONG Guo-dong3,DENG Yong-qiang1,HOU Wei1,WU Yun-fei4,TIAN Hui-yun2,MA Kun3,CHEN Dong1,WEN Hao1,ZHU Yin-bao5
(1.Sichuan Animal Disease Prevention and Control Center,Chengdu,Sichuan,610041,China;2.Hubei Animal Disease Prevention and Control Center,Wuhan,Hubei,430000,China;3.Yunnan Animal Disease Prevention and Control Center,Kunming,Yunnan,650051,China;4.Guanghan City Animal Disease Prevention and Control Center,Deyang,Sichuan,618000,China;5.Nanjing Lubao Biological Technology Co.,LTD,Nanjing,Jiangsu,210000,China)
Abstract:In order to establish a rapid method to detect the antibodies of Schistosoma japomicumin cattle and sheep,a diagnostic strip was produced based on using rabbit anti-Cattle IgG labeled with red latex as an immunoprobe,the soluble egg antigen of Schistosoma japomicumand goat anti-rabbit IgG as a test line and control line,respectively.It could detect the circulating anti-schistosome antibodies in blood paper from cattle which had been infected with schistosome cercariae after 28days(including 28days).There was no cross reaction with the antibodies of Orientobilharziaand Faciola hepatica.In this study,20positive samples from cattle with schistosomiasis and 30negative samples from cattle without schistosomiasis were detected with the diagnostic strip,Dot-ELISA and feces hatching miracidium method.The positive and negative coincidence rates were 100%compared with Dot-ELISA and feces hatching miracidium method.The antibody detection strips still kept valid after storage in 2℃-8℃for 14months or kept in room temperature for 8months.The results showed that the strips have high sensitivity,specificity,repeatability and stability.It is suitable for fast diagnosis and general survey of animal schistosomiasis.
Key words:antibody detection strip;schistosomiasis;livestock;rapid diagnosis
作者简介:阳爱国(1967-),男,博士,研究员,主要从事动物寄生虫病及兽医公共卫生防控工作。
收稿日期:2014-09-18
中图分类号:S852.735
文献标识码:A
文章编号:1007-5038(2015)05-0073-08
