超声提取梵净山蝴蝶花根茎多糖的工艺优化
2015-02-27付素静高宇琼黄芙蓉田腊梅
付素静, 高宇琼, 王 岚, 黄芙蓉, 田腊梅
(1.铜仁学院 生物与农林工程学院, 贵州 铜仁 554300; 2.贵州省梵净山特色动植物资源重点实验室, 贵州 铜仁 554300)
注:不同大写字母表示差异极显著,不同小写字母表示差异显著。
Note: Different capitaland lowercase letters indicated 1% and 5% significant levels respectively.
超声提取梵净山蝴蝶花根茎多糖的工艺优化
付素静1,2, 高宇琼1,2, 王 岚1,2, 黄芙蓉1, 田腊梅1
(1.铜仁学院 生物与农林工程学院, 贵州 铜仁 554300; 2.贵州省梵净山特色动植物资源重点实验室, 贵州 铜仁 554300)
为获得较多的蝴蝶花多糖,采用超声波法对蝴蝶花多糖的提取工艺进行优化。结果表明:各因素对蝴蝶花根茎多糖提取率的影响依次为料液比>提取温度>提取时间>提取功率,蝴蝶花多糖最佳提取工艺为提取时间30 min,提取温度70℃,料液比1∶30。在最佳工艺条件下,超声提取蝴蝶花根茎多糖的验证性试验提取率为11.21%。进一步证实了该工艺的稳定性和可行性。
蝴蝶花; 根茎; 多糖; 超声提取
蝴蝶花(Irisjaponica)是鸢尾科鸢尾属多年生草本植物,根茎匍匐状,有长分枝。具有清热解毒,消肿止痛的功效且有小毒[1]。其根状茎在民间作为土药长期使用,主要用于治疗肝炎、食积胀满、咽喉肿痛、跌打损伤、子宫脱垂和蛇犬咬伤等[2]。蝴蝶花作为民族医药土家药和苗药土家药,主要用于治辽肝气郁结[3-4]。目前,对蝴蝶花的研究主要集中在生物学特性[5-6]、异黄酮的提取[7]、园林应用[8-9]、病虫害[10]、花形态可塑性[11]和组织培养[12]等。在化学成分的研究上,主要对同属植物射干的鸢尾苷、鸢尾酮和异黄酮的研究较多[13-15]。初步研究发现,蝴蝶花根茎内含有大量的黄酮类和多糖类物质。多糖是一种组分复杂的具有多种生物活性的天然产物,具有增强免疫力,降血脂,降血糖,抗辐射等功效,广泛应用于食品、医药、保健等领域[16]。蝴蝶花在贵州省产藏量较大,山上各处均有野生植株,而且药用价值大,为进一步开发利用其种质资源,笔者对蝴蝶花根茎多糖提取工艺进行优化,旨在为蝴蝶花资源的综合开发和利用提供理论基础和技术支持。
1 材料与方法
1.1 材料与仪器
试验材料:蝴蝶花根茎(采自贵州梵净山自然保护区)。葡萄糖标准品,蒽酮、浓硫酸、乙醇均为国产分析纯。
仪器:AR124CN型电子天平(奥豪斯仪器上海有限公司),101-3型电热鼓风干燥箱(北京科伟永兴仪器有限公司),SG5200HPT型台式超声波清洗器(上海冠特超声仪器有限公司),80-2型离心沉淀机(江苏金坛市中大仪器厂),SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司),HH-S6型电热恒温水浴锅(北京科伟永兴仪器有限公司),T6新世纪型紫外分光光度计(北京普析通用仪器有限责任公司)。
1.2 溶液的制备
蒽酮溶液的制备:称取0.1 g蒽酮,溶于80%浓硫酸100 mL中,冷却至室温,备用。
对照品溶液的制备:精密称取105℃干燥至恒重的葡萄糖标准品100 mg,加水溶解后用100 mL容量瓶定容,即得1 mg/mL的葡萄糖对照品液。
1.3 标准曲线的绘制
精密量取对照品液0.0 mL、0.025 mL、0.05 mL、0.10 mL、0.20 mL、0.30 mL于具塞试管中,分别加蒸馏水至1.0 mL,各加入5.0 mL蒽酮溶液,摇匀,置沸水浴保温20 min,取出后以冷水迅速冷却至室温,取2.0 mL蒸馏水为空白对照,在625 nm处测定吸光度。分别以质量浓度(C)、吸光度(A)为坐标绘制标准曲线(图1),得回归方程:
A=1.506 4C+0.003 7;R2=0.9994。

图1 葡萄糖标准曲线
1.4 蝴蝶花根茎多糖的测定
将蝴蝶花根茎清洗干净研碎,60℃烘干后、继续研磨得蝴蝶花根茎粉末。称取蝴蝶花根茎粉末0.5 g,用蒸馏水溶解在250 mL锥形瓶中,用超声波法提取多糖,3 000 r/min离心10 min,最后定容至100 mL。取1.0 mL样品溶液,再加入5.0 mL蒽酮,置沸水浴保温20 min,冷却至室温,625 nm测定吸光度。按以下公式计算多糖提取率:

式中,A为吸光值,D为样品液的稀释倍数,V为浸提液的体积(mL),M为取样质量(g)
1.5 不同因素提取效果的考察
1.5.1 提取时间 准确称取5份蝴蝶花根茎粉末各0.5 g,设定料液比为1∶30(g/mL),提取温度为60℃,分别提取10 min、20 min、30 min、40 min和50 min,测定蝴蝶花根茎多糖的提取率,每个水平3次重复试验后取平均值,得其平均提取率(下同)。
1.5.2 提取温度 准确称取5份蝴蝶花根茎粉末各0.5 g,设定料液比为1∶30(g/mL),提取时间为30 min,分别于40℃、50℃、60℃、70℃和80℃提取。
1.5.3 料液比 准确称取6份蝴蝶花根茎粉末各0.5 g,分别选定料液比为1∶10、1∶15、1∶20、1∶25、1∶30和1∶35,设定提取温度为60℃,提取时间为30 min,比较不同料液比对蝴蝶花根茎多糖提取率的影响。
1.6 梵净山蝴蝶花多糖提取的工艺优化
为优化蝴蝶花根茎多糖的提取条件,在单因素试验的基础上,以提取时间(A)、提取温度(B)、空白列(C)、料液比(D)为影响因素,每个因素各设3个水平,用蒽酮-硫酸法测定多糖含量,并以提取率为评价指标,选用L9(34)正交设计进行试验,按照所设计的正交试验组合,每个试验组合3次重复,分别计算提取率平均值,多糖提取的因素水平见表1。
表1 超声波提取梵净山蝴蝶花根茎多糖的正交试验因素及水平
Table 1 Factors and levels of the orthogonal test of extracting polysaccharides in the rhizome ofI.japonicaby ultrasonic-assisted method

水平Level提取时间/minExtractiontime提取温度/℃Extractiontemperature空白Blank料液比/(g/mL)Solid-liquidratio11(20)1(60)1(1∶25)22(30)2(70)2(1∶30)33(40)3(80)3(1∶35)
1.7 统计分析
分别用Microsoft Excel 2010和SPSS 19.0处理数据。
2 结果与分析
2.1 不同因素对蝴蝶花根茎多糖提取率的影响
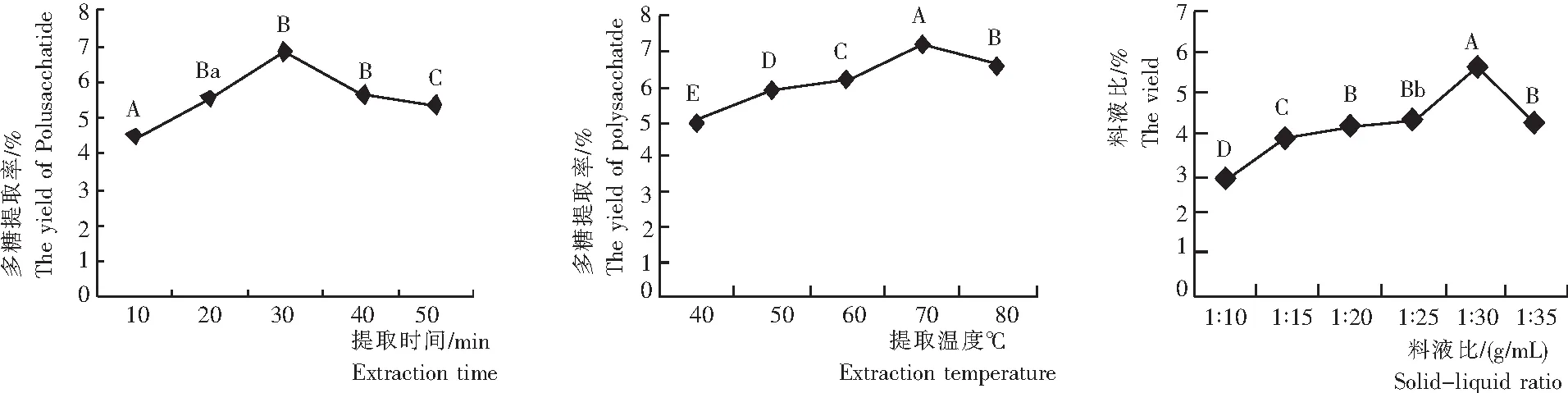
由图2可知,1) 蝴蝶花根茎多糖提取率随着提取时间的增加呈先提高后降低的变化趋势。当提取时间为30 min时,超声波对细胞的破碎作用最强,有利于多糖的溶出,蝴蝶花根茎多糖提取率达到最大,为6.82%。此后可能由于长时间的超声波处理促使多糖分解和大量杂质的溶出,降低了提取率。
对该结果进行方差分析可知,其F值为155.035,P<0.0001,F>F0.01(5.99),故提取时间对梵净山蝴蝶花根茎多糖提取率的影响是极显著,进一步比较各水平之间影响的差异程度,提取时间为20 min与40 min和50 min对蝴蝶花根茎多糖提取率的影响差异不显著,40 min和50 min差异显著,30 min与其他各水平之间差异极显著。
综合考虑试验结果和方差分析结果,超声提取蝴蝶花根茎多糖的提取时间宜为30 min左右。
2) 蝴蝶花根茎多糖提取率随着提取温度的升高呈先提高后降低的变化趋势。当提取温度为70℃时,蝴蝶花根茎多糖提取率达最大,为7.23%。这可能因为温度越高,作用越显著。对该结果进行方差分析可知,其F值为498.807,F>F0.01(5.99),即P<0.01,得知提取温度对多糖提取率的影响是极显著,进一步比较各水平间的差异,提取温度各水平间的影响都是极显著。综合考虑试验结果和方差分析结果,超声提取蝴蝶花根茎多糖的提取温度宜在70℃左右。
注:不同大写字母表示差异极显著,不同小写字母表示差异显著。
Note: Different capitaland lowercase letters indicated 1% and 5% significant levels respectively.
图2 不同提取时间、提取温度和料液比的蝴蝶花根茎多糖提取率
Fig.2 Extraction efficiency of polysaccharides from the rhizome ofI.Japonicawith different extraction time, temperature and solid-liquid ratio
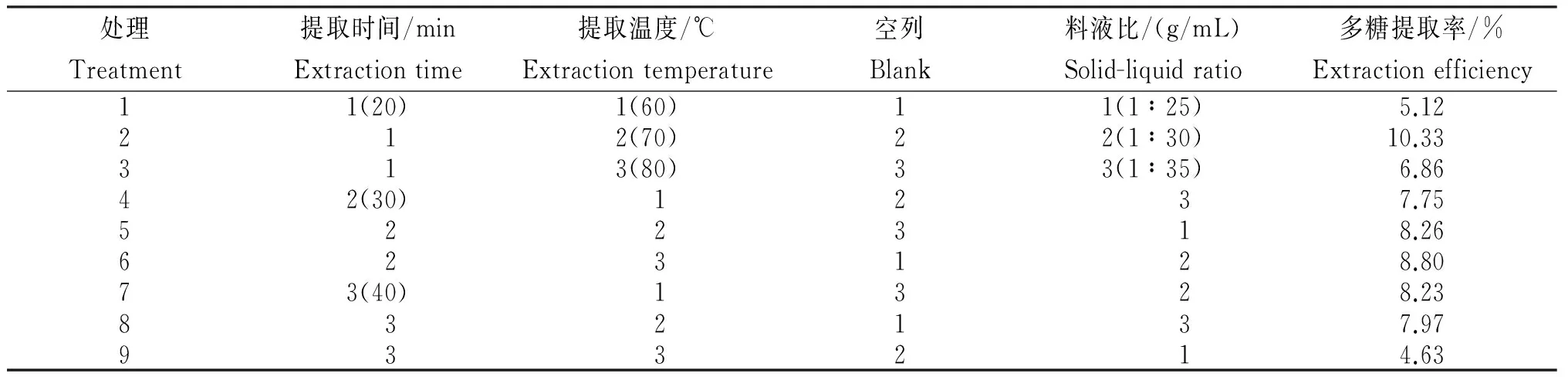
表2 超声提取梵净山蝴蝶花根基多糖正交试验各处理的提取率
表3 超声提取梵净山蝴蝶花根茎多糖各因素水平提取率的均值与极差
Table 3 Mean and range of different factors and levels of extracting polysaccharides from the rhizome ofI.japonicaby ultrasonic-assisted method
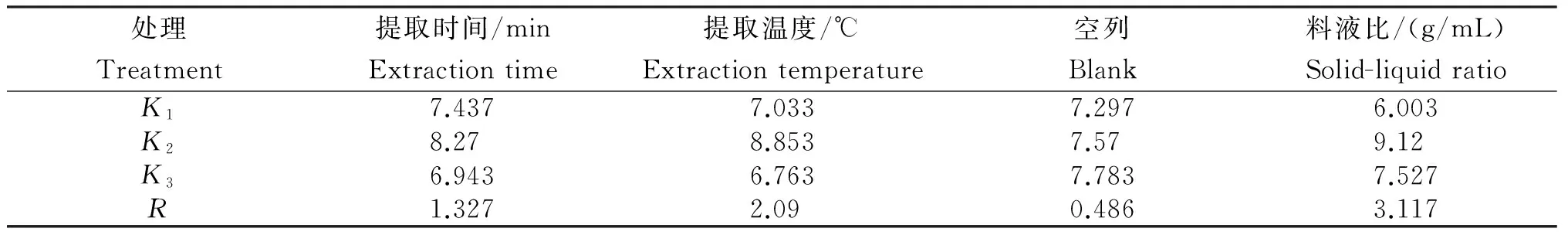
处理Treatment提取时间/minExtractiontime提取温度/℃Extractiontemperature空列Blank料液比/(g/mL)Solid-liquidratioK17.4377.0337.2976.003K28.278.8537.579.12K36.9436.7637.7837.527R1.3272.090.4863.117
3) 蝴蝶花根茎多糖提取率随着料液比的增加呈先提高后降低的变化趋势。随着料液比的增大,多糖的溶解量更多,当料液比为1∶30时,多糖提取率最高,为5.67;继续增加料液比,多糖提取率呈下降趋势。对该结果进行方差分析可知,其F值为440.780,F>F0.01(5.06),即P<0.01,知料液比对多糖提取率的影响是极显著,进一步比较各水平间的差异程度,料液比为1∶20与1∶35对蝴蝶花根茎多糖提取率的影响差异不显著,1∶20和1∶25差异显著,1∶25与1∶35差异显著,其他各水平之间差异极显著。综合考虑试验结果和方差分析结果,超声提取蝴蝶花根茎多糖的料液比宜在1∶30左右。
2.2 超声提取梵净山蝴蝶花根基多糖正交试验各处理的提取率
对超声提取梵净山蝴蝶花根茎多糖的正交试验结果(表2)进行极差分析(表3)可知,各因素对蝴蝶花根茎多糖提取率的影响依次为D>B>A,即料液比>提取温度>提取时间。对其进行方差分析可知,料液比和提取温度的F值分别为40.821和21.717,均大于F0.05(2,2)=19.00,达显著差异,其中,料液比对蝴蝶花根茎多糖提取率影响最大,其次是提取温度、提取时间。因此,超声波提取蝴蝶花多糖的最佳提取工艺组合为A2B2C2,即料液比为1∶30,提取温度为70℃,提取时间为30 min。在该条件下,对蝴蝶花多糖进行提取,重复3次试验,其多糖提取率平均值为11.21%,高于正交试验水平,说明该工艺稳定,可靠。
3 结论
多糖的研究集中在工艺条件的优化,可以用酶法[17]、微波法[18]、超声波法[19]等,采用的溶剂有水[20]、酸[21]、碱[22]等。蝴蝶花多糖的提取工艺尚无研究,试验采用超声波法提取蝴蝶花根茎多糖,最高得率为11.21%,与其同科的鸢尾的多糖提取率为4.95%[23]。
试验考查了提取时间、提取温度、料液比对蝴蝶花根茎多糖提取率的影响,通过正交试验得出各因素对蝴蝶花根茎多糖提取率的影响依次为料液比>提取温度>提取时间。
超声波提取蝴蝶花多糖的最佳工艺为料液比1∶30,提取温度70℃,提取时间为30 min。通过验证性试验结果可以看出,在最佳工艺条件下蝴蝶花根茎多糖提取率平均值为11.21%,高于正交试验中的最高值。说明,超声波法提取蝴蝶花多糖具有操作简单用时较短、稳定性好等特点,是可行的。
[1] 中国药材公司.中国中药资源志要[M].北京:科学出版社,1994:1420.
[2] 云雪林,杨碧仙.贵州鸢尾属植物种质资源及观赏药用价值[J].贵阳学院学报:自然科学版,2009,4(3):15-17.
[3] 雷启荣,罗 君,赵琳珺,等.鸢尾的化学成分和药理作用的研究进展[J].中国民族民间医药,2011(12):41-42.
[4] 中国科学院.中国植物志:第16卷[M].北京:科学出版社,1985:176.
[5] 蔡仕珍,李 西,潘远智,等.不同光照对蝴蝶花光合特性及生长发育研究[J].草业学报,2013,22(2):264-272.
[6] 王永健,钟章成,陶建平.缙云山不同生境蝴蝶花(IrisjaponicaThumb.)分株种群格局及对草本多样性的影响[J].生态学报,2008,28(7):3082-3091.
[7] 李宇伟,王文静,连瑞丽.正交试验优选鸢尾异黄酮的提取工艺[J].湖北农业科学,2010,49(5):1180-1182.
[8] 郭晋燕,张金政,孙国峰,等.根茎鸢尾园艺学研究进展[J].园艺学报,2006,33(5):1149-1156.
[9] 邓晓梅,付素静,王 浪.蝴蝶花的特征特性及栽培技术[J].安徽农学通报,2014(15):57,62.
[10] 宿巧燕.蝴蝶花枯斑病病原鉴定及其生物学特性研究[D].重庆:西南农业大学,2003.
[11] 李青雨,钟章成,何跃军.土壤养分对蝴蝶花的花形态可塑性的影响[J].武汉植物学研究,2005,23(6):564-567.
[12] 赵宏波,陈发棣,房伟民,等.蝴蝶花的组织培养和根状茎的诱导[J].园艺学报,2005,32(3):556-557.
[13] 段丽红,郭祀远,郑必胜.从射干中提取射干中鸢尾苷的工艺研究[J].现代食品科技,2006,22(1):70-71.
[14] 郭 涛,杨克迪,陈 钧.鸢尾中鸢尾酮的气相色谱-质谱联机分析[J].食品科学,2005,26(1):172-176
[15] 秦民坚,吉文亮,王峥涛.HPLC测定射干中6种异黄酮含量的动态变化[J].中国中药杂志,2006,31(20):1681-1683.
[16] 尹艳,高文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007(2):248-250.
[17] 贺 寅,王 强,钟 葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2011,32(2):79-83.
[18] 胡月芳.淮山多糖微波法提取及清除羟基自由基的研究[J].北方园艺,2014(2):135-137.
[19] 戴喜末,熊子文,罗丽萍.响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J].食品科学,2011,32(8):93-97.
[20] 邓 锷,杨 军,王立强,等.扯根菜多糖的提取[J].中药材,2009,32(1):121-123.
[21] 胡纱纱,汪一红,陈娟娟,等.响应面法优化黄连木多糖酸提取工艺的研究[J].粮油加工,2009(1):124-128.
[22] 诸爱士,沈晓强.正交设计碱提小米多糖[J].浙江科技学院学报,2013,25(3):205-209.
[23] 刘鹏举,付志慧,薛小刚,等.鸢尾多糖提取工艺的研究[J].安徽农业科学,2007,35(20):6121,6159.
(责任编辑: 孙小岚)
Ultrasonic Extraction Process Optimization of Polysaccharides in WildIrisjaponicafrom Fanjingshan Mountain
FU Sujing1,2, GAO Yuqiong1,2, WANG Lan1,2, HUANG Furong1, TIAN Lamei1
(1.CollegeofBiologyandA&FEngineering,TongrenUniversity,Tongren,Guizhou554300; 2.KeyLaboratoryofSpecialAnimalandPlantResourcesinFanjingMountain,Tongren,Guizhou554300,China)
The extraction technology conditions of polysaccharides from the rhizome ofI.japonicain Fanjing mountain were optimized to get the highest content of polysaccharides by ultrasonic-assisted.Results:The influencing factors of extraction ratio followed the sequence of solid-liquid ratio>extraction temperature> extraction time>extraction power, and the optimum extracting conditions included extraction time 30 min, extraction temperature 70℃ and solid-liquid ratio 1:30. Under these conditions, The rate of polysaccharides extracted reached 11.21%, indicating that this process is efficient and stable.
Irisjaponica; rhizome; polysaccharides; ultrasonic extraction
2015-01-05; 2015-07-06修回
贵州省野生动植物保护与利用重点支持学科建设项目[黔教合重点支持学科字(2011)232];梵净山特色动植物资源重点实验室资助项目[黔教合KY(2011)005];梵净山特色动植物资源保护与利用创新人才团队[黔教合人才团队字(2012)08];贵州省铜仁市科技局项目“梵净山野生蝴蝶花Iris japonica的露地栽培技术及药用成分的提取、分析”[铜市科研(2014)40-13];
付素静(1980-),女,副教授,从事花卉学、园林植物开发利用及相关科研工作。E-mail:fusujing_9973@163.com
1001-3601(2015)07-0386-0155-04
S38; Q949.95
A
加工贮藏·农产品质量
Processing and Storage·Agricultural Product Quality
