锂空气电池正极界面催化反应机理
2015-02-27王倍洲王有伟刘建军陆文聪
王倍洲,王有伟,刘建军,陆文聪
(1. 上海大学化学系,上海 200444)(2.中国科学院上海硅酸盐研究所 高性能陶瓷和超微结构国家重点实验室,上海 200050)


第一作者:王倍洲,男,1990年生,硕士研究生
Email: jliu@mail.sic.ac.cn
锂空气电池正极界面催化反应机理
王倍洲1,2,王有伟2,刘建军2,陆文聪1
(1. 上海大学化学系,上海 200444)(2.中国科学院上海硅酸盐研究所 高性能陶瓷和超微结构国家重点实验室,上海 200050)
摘要:高比能量锂空气电池是未来大容量纯电动汽车潜在的动力电源技术之一,然而由于充放电动力学速率低限制了其实际性能的提升,导致其充电过电位高、循环性能差、电流密度低、电极材料不稳定、电解质分解等问题。发展高活性的氧还原与析氧催化剂是锂空气电池研究的热点。单纯地通过实验观测过氧化锂在电极催化表面的形成与分解反应有很大挑战,利用第一性原理计算与实验相结合揭示催化反应机理、探求新型高效催化剂受到广泛重视。综述了催化剂与过氧化锂相互作用,建立电荷转移、界面结构、吸附能与催化活性之间关系,进而揭示了高活性氧还原与析氧反应催化剂的特征结构,通过催化剂的表面微观结构设计与晶体结构计算预测发展新型高活性催化剂,以改善锂空气电池电化学性能。
关键词:锂空气电池;氧还原反应;析氧反应;催化机理;界面催化;第一性原理计算
1前言
动力电池作为电动汽车的能量来源,是电动汽车产业发展的核心与基础,其中电池材料需求巨大,近年来每年增量在50%左右(工信部统计)。传统动力电池材料的电化学性能尚不能满足目前电动汽车发展的需求,主要表现在:比容量不足、充电时间长、充放电效率低、使用寿命短等问题。
锂空气电池是利用氧气作为正极活性物质,以金属锂或锂合金作为负极,在有机电解质体系中,通过溶解于电解质中的氧气与锂离子发生可逆的氧化还原反应实现充放电过程(2Li++O2+2e-↔Li2O2),基于空气电极和电解液的质量,其理论比能量达到 2 790 Wh·Kg-1。如果将其应用在电动汽车中,最终系统能量密度可达800 Wh·Kg-1,一次充电续航里程能够达到800 km, 可以与燃油汽车相比拟[1-3]。与已经商业化的动力锂离子电池比较,锂空气电池具有高比能量密度、价格低廉等优势,是未来大容量纯电动汽车产业化发展的重要技术保障。
价格高昂的特斯拉(Tesla Roadster)电动车采用日本松下公司研发的镍钴铝氧化物电池(NCR18650),69个电池被并联组合成一个电池分模块,99个电池分模块再经过串联形成一个电池模块,11个电池模块组成一个电池包,总计6 831节单电池,占电动车总重量的1/3,一次20 min充电续航里程仅仅200 km左右。中国生产的比亚迪电动汽车以磷酸铁锂为电池正极材料,续航里程仅为70~150 km。可见,发展高性能(高比能量、高循环性能、高充放电效率和快充电速率)动力电池对于发展电动汽车产业,解决能源危机和环境污染等问题具有重要意义。
但是作为一类全新的电池体系,锂空气电池用作电动汽车动力电池尚存在一些技术障碍,例如充电过电位高、循环稳定性差、电流密度低、电极材料不稳定、电解质分解等问题[1, 4-6]。究其根源是可逆电化学反应2Li++O2+2e-↔Li2O2的反应速率不能满足锂空气电池的应用需求,直接导致高的极化电位与Li2O2分解不完全,造成充放电效率低以及循环寿命降低;同时高充电电位间接导致电极与电解质分解等问题[7-8]。因此揭示催化活性与界面结构的关系,发展一种廉价的、高活性的催化剂,对改善锂空气电池充放电反应动力学过程非常重要。然而由于Li2O2在电解质中不可溶解,催化剂需要同时承担促进Li2O2的形成与分解动力学过程的双重作用,因此筛选这样具有双功能的催化剂(Bifuncational Catalyst)非常具有挑战性,该研究已经引起高度关注,但进展缓慢。
锂空气电池的充放电过程伴随着电子迁移、锂离子输运、界面反应等多种化学物理过程,并且耦合了纳米尺寸效应与表(界)面效应等,单纯的实验筛选高活性催化剂效率较低。近年来利用第一性原理计算与实验相结合,以充放电电位差与控速步骤(Rate-determinant Step)势垒的降低、充放电循环性能等作为参数来研究筛选催化剂受到广泛的重视。2014年美国新版材料基因组计划分别将“催化剂筛选”与“先进储能材料”列为重点发展领域。
2锂空气电池催化功效
近年来,针对锂空气电池电化学反应动力学性能差的物理机制与性能改进的实验探索层出不穷。放电过程Li+与O2在电极活性表面反应形成纳米尺寸的Li2O2,充电过程Li2O2从界面处发生分解反应,整个过程许多因素都可能影响到充放电反应动力学性能。例如放电产物Li2O2的尺寸[9]和形貌[10]、表面结构[11]、催化剂表面结构特征[12-13]、电极材料的结构稳定性[7]、充放电容量及时间等,其中通过添加催化剂到正极材料提高充放电动力学性能最为引人注目。目前锂空气电池中的催化剂可分为催化氧气还原反应(Oxygen Reduction Reaction,ORR)的ORR催化剂和催化氧气析出反应(Oxygen Evolution Reaction,OER)的OER催化剂。ORR催化剂能够提高锂空气电池的放电电压,降低锂空气电池的放电过电位,甚至可以提高电池的容量;OER 催化剂可以降低锂空气电池的充电电压,降低其充电过电位,并改善其充电容量。
2011年,McCloskey B D 等人利用原位差分电化学气相质谱(Differential Electrochemical Mass Spectrometry, DEMS)发现,将Au、Pt及MnO2等催化剂加入锂空气电池,与未加入催化剂的电池相比,其电流密度的提高并不大、氧气的释放速率也没有多少提高,反而是在高电位时释放出更多的CO2[8]。这表明,不论是过渡金属氧化物还是贵金属催化剂,都没有催化过氧化锂的分解,而是促进了副产物如LiCO3的分解,甚至可能加剧了副反应的发生。Harding J R等人认为McCloskey B D等的研究结果中过氧化锂大部分是非常薄的薄膜或者小的纳米团簇[14],而在实验上电化学合成的过氧化锂多数是圆饼状大块材料。用“正常”形貌的过氧化锂重新实验,他们发现Pt及Ru等贵金属还是能够提供显著电流密度的。目前锂空气电池中的催化问题已经成为了一个极具争议的话题。
事实上,Li2O2的分解电压与很多因素有关,例如放电产物的尺寸形貌、充电的电流密度等[15]。块体结构的Li2O2有较大的过电位,而薄膜状的Li2O2过电位并不高[16]。不同课题组利用第一性原理计算了Li2O2表面结构的分解电压,一致表明过电位的存在[17-18]。
3ORR催化机理
ORR放电过程(2Li++O2+2e-→Li2O2,ΔH=6.56 eV)是放热反应。Wen等[19-20]使用原位原子力显微镜(AFM)观测了其放电过程中Li2O2在多孔纳米金表面从纳米颗粒到Nanoplate的电化学生长过程,Li2O2薄膜厚度在5 nm左右。ORR催化作用发生在放电初始阶段Li2O2与催化剂接触的界面位置,随着放电深入催化剂被Li2O2覆盖失去效果。美国MIT的Yang等[21]通过旋转圆盘电极测定法研究了不同多晶贵金属对ORR的催化活性,获得了Pd>Pt>Ru≈Au>GC(Glassy Carbon)的催化活性序列(如图1所示),建立了催化活性与O2吸附能之间的Volcano关系,这为进一步预测更广泛的催化体系奠定了基础。美国ORNL的Xu等[22]通过第一性原理热力学计算确定了贵金属催化活性与O2吸附能的相关性, 并且计算结果与实验结果相一致。尽管如此,贵金属催化应用仍受到较大限制,而预测过渡金属氧化物等廉价材料作为锂空气电池ORR催化剂的研究报道较少。美国LANL的Wu和Xu等[23]利用一步溶液法合成Mn3O4/还原氧化石墨烯(RGO)作为ORR催化剂,性能超越了Pt/C,这为发展廉价催化剂奠定了基础。
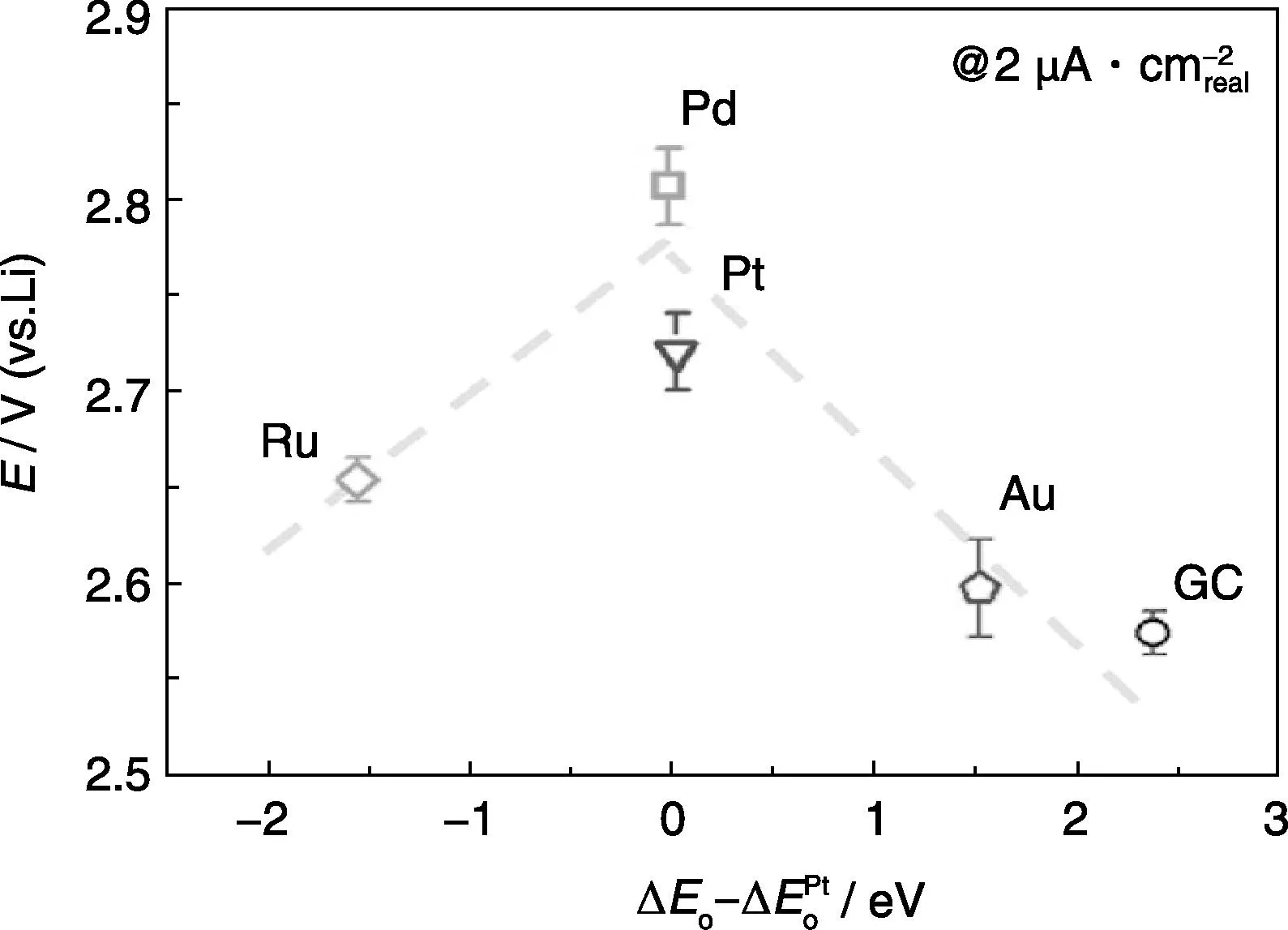
图1 不同贵金属ORR催化活性与氧气吸附能“火山状”关系图[21]Fig.1 Volcano-shape relation between ORR catalytic activity and oxygen absorption energy[21]
除了贵金属外,还有相当多的的实验研究报道了多孔石墨烯[24]、N-doped石墨烯[25]、金属氧化物复合的石墨烯等对ORR具有催化活性[26]。然而总体来看,碳做电极催化载体ORR性能非常不好,Li2O2的形成位置、尺寸效应和产物组成与形态等都不清晰,机理研究也非常缺乏,对进一步发展新型高活性ORR催化剂造成阻碍。
4OER催化机理
相对而言,OER充电过程(Li2O2→2Li++O2+2e-,ΔH=-6.56 eV)是强吸热反应。美国MIT的Yang等[27]利用原位透射电镜(TEM)研究充电过程表明,Li2O2的氧化分解是在Li2O2/电极的界面处发生的。由于过电位与循环寿命及充电过程有直接关系,强吸热反应以及较高的活化势垒导致OER反应速率较低,而电子转移速率远远快于OER反应与锂离子迁移速率,因此严重的电化学极化导致了高过电位;未分解的Li2O2沉积在催化剂表面,阻碍了其进一步促进OER反应的催化能力;循环寿命与容量逐渐降低,间接导致高电位下的电解质与电极副反应。2011年IBM的McCloskey和Luntz等[8]利用差分电化学质谱(DEMS)研究了Pt、Au、MnO2等催化剂对充电过电位的影响,认为这些催化剂对OER的过电位降低效果有限,但是他们的研究因仅仅采用薄层Li2O2受到很大质疑;美国MIT的Yang等[10]针对Li2O2形貌对过电位影响也进行了系统研究,表明薄层Li2O2确实不会产生较大过电位,但是块体性质的Li2O2不可避免会产生高过电位。朱金振等[17]基于第一性原理热力学计算,确认了Co3O4某些晶面有降低过电位与提高循环容量的催化作用,证明了催化剂对动力学性能的促进作用。
MIT的Ceder课题组[18]与IBM的Luntz课题组[28]分别对Li2O2表面OER机理进行了第一性原理计算,然而Li2O2在催化剂表面上的固-固界面催化机理研究鲜有报道。 朱金振等[13,17]利用理论计算与实验验证相结合,率先构筑了三相界面模型(O2/Li2O2/Co3O4),研究了不同晶面催化机理,通过计算过电位与快速反应步骤势垒决定催化活性。如图2所示,计算确定催化活性的晶面效应Co3O4(111)> Co3O4(110),并进一步预测了Pd掺杂Co3O4(111)对OER有更高的催化活性[17],并很快被实验验证[12]。最近,作者课题组计算预测了多种掺杂石墨烯对OER的催化活性[29-30],但尚未确立微观结构特征与OER催化活性(过电位、Li+与O2脱附势垒)关系、以及与双功能ORR/OER的催化活性关系。

图2 催化活性的晶面效应示意图及过渡金属掺杂Co3O4(111)C面导致的充电过电位降低、氧气脱附势垒与相应过渡金属电离势关系图[17]Fig.2 Illustration of facet-dependent catalytic activity (top); Decreased overpotential and O2-desorption barrier in the OER of Li2O2supported on Transitional Metal (TM) doped Co3O4(111)C as a function of ionization potential of doped TM (bottom)[17]
最近,Kim 等[31]利用第一性原理方法系统研究了PtCo (PtTi)合金团簇结构作为锂空气电池正极OER的催化剂,揭示了Li与LiO2的吸附能作为OER催化活性的催化特征。然而将中间体的吸附能力作为特征催化参数在实验上很难表征,因此发展OER催化特征结构参数非常重要。
实际上ORR与OER反应对应着Li2O2形成与分解相反的化学反应过程,在不同电化学环境(主要体现在电动势不同)下,对O2与Li+具有适当吸附能力,同时对O2与Li+有适当的促进脱附作用,这种材料性能的多物理参量协同调控非常困难。
5ORR-OER双功能催化剂
近年来,对ORR与OER双功能催化作用的研究报道较多,但除了贵金属有较好的催化效果外,其余催化剂体系还存在诸多问题。根据电极催化剂组分可归纳为3类:①美国MIT的Yang等[32]报道的贵金属类Pt-Au纳米合金对ORR与OER有双功能催化效果,充电电位在3.4~3.8 V;英国Peter Bruce 在《Science》上报道的纳米多空金(NPG)作为锂空气电池催化电极,大大提高了O2释放速率,充电电位降到3.4 V,循环到100次时容量仍然保持在95%[33]。然而缺乏内在机理研究,不利于廉价催化剂的设计研究。② 过渡金属氧化物作为锂空气电池ORR和OER催化剂受到广泛关注。上海硅酸盐研究所的温兆银课题组率先研究了Co3O4对过电位降低的催化效应,充电电位降到3.5 V左右,比容量达到4 000 mAh·g-1。但是电流密度较低且循环性能不尽理想[34]。复旦大学余爱水等[35]报道了由钴/锰氧化物纳米线和镍泡沫组成的三维网络结构电极材料,其结构特点有利于反应物与电极接触并且为产物沉积提供了较大空间,在电流密度0.05 mA·cm-2下容量达到3 605 mAh·g-1,截止容量为500 mAh·g-1时,循环次数达到50次,然而循环稳定性有待进一步优化。合肥工业大学张大伟等[36]利用钙钛矿结构氧化物LaNi1-xMgxO3(x=0, 0.08, 0.15)作为锂空气电极双功能催化剂也取得进展,将LaNiO3中的Ni部分取代为Mg可以抑制Ni2+形成,使Ni3+浓度增加,有利于ORR/OER反应电流密度的提升,容量则会随着掺杂浓度的提升而降低 。③ Bruno Scrosati等[37]研究了TiC与TiN等作为锂空气电池电极材料,容量与倍率分别可达到5 000 mAh·g-1与3 A·g-1。随着充放电循环次数增加,表面结构不稳定部分氧化为TiOC以及TiON的“氧化层结构”。作者团队近期进行了初步计算研究,表明这种氧化层结构对OER具有一定的催化效应,揭示了微观结构与催化活性关系对于进一步设计高活性催化剂非常必要。青岛能源所崔光磊课题组最近报道了利用多孔Co3Mo3N纳米结构作为锂空气电池ORR与OER双功能催化剂[38]。
6结语
未来几年,锂空气电池的基础研究将会围绕发展高活性电极催化剂、提高电解质与电极在电化学环境下的稳定性、延长电池充放电循环寿命、阐明电极与电解质界面的锂离子与电子输运机理等问题展开。就催化剂而言,未来研究发展趋势:① 将会从催化活性的电化学表征向催化机理探索发展,揭示界面结构-催化活性关系规律、开展高活性双功能催化剂微观结构设计与界面结构调控。② 从贵金属催化剂的基础研究转向过渡金属氧化物等廉价催化材料体系的筛选探索研究。③ 由于电化学反应环境较为复杂,OER与ORR反应机理的原位观测非常具有挑战性,因此将理论计算与精准实验检测相结合是未来的主要研究策略。
参考文献References
[1]Girishkumar G,McCloskey B,Luntz A C,etal.PhysChemLett[J],2010, 1:2 193-2 203.
[2]Bruce P G,Freunberger S A,Hardwick L J,etal.NatMate[J],2012, 11:19-29.
[3]Zu C X,Li H.EnergyEnvironSci[J],2011, 4:2 614-2 624.
[4]Christensen J,Albertus P,Sanchez-Carrera R S,etal.JElectrochemSoc[J],2012, 159:R1-R30.
[5]Li F J,Zhang T,Zhou H S.EnergyEnvironSci[J],2013, 6:1 125-1 141.
[6]Shao Y Y,Ding F,Xiao J,etal.AdvFunctMater[J],2013, 23:987-1 004.
[7]Thotiyl M M O,Freunberger S A,Peng Z Q,etal.JAmChemSoc[J],2013, 135:494-500.
[8]McCloskey B D,Scheffler R,Speidel A,etal.JAmChemSoc[J],2011, 133:18 038-18 041.
[9]Hu Y,Han X,Cheng F,etal.Nanoscale[J],2014, 6:177.
[10]Gallant B M,Mitchell R R,Kwabi D G,etal.JPhysChemC[J], 2012, 116:20 800-20 805.
[11]Radin M D,Rodriguez J F,Tian F,etal.JAmChemSoc[J],2012, 134:1 093-1 103.
[12]Su D,Dou S,Wang X.SciRep[J],2014, 4:5 767-5 775.
[13]Gao R,Zhu J,Xiao X,etal.JPhysChemC[J], 2015, 119:4 516-4 523.
[14]Harding J R,Lu Y C,Tsukada Y,etal.PhysChemChemPhys[J],2012, 14:10 540-10 546.
[15]Gallant B M,Kwabi D G,Mitchell R R,etal.EnergyEnvironSci[J],2013, 6:2 518-2 528.
[16]Lu Y C,Shao-Horn Y.JPhysChemLett[J],2013, 4:93.
[17]Zhu J,Ren X,Liu J,etal.ACSCatal[J],2015, 5:73.
[18]Mo Y F,Ong S P,Ceder G.PhysRevB[J], 2011, 84:205 446.
[19]Wen R,Hong M,Byon H R.JAmChemSoc[J],2013, 135:10 870-10 876.
[20]Wen R,Byon H R.ChemCommun[J],2014, 50:2 628.
[21]Zhong L,Mitchell R R,Liu Y,etal.NanoLett[J],2013, 13:2 209-2 214.
[22]Lu Y C,Gasteiger H A,Shao-Horn Y.JAmChemSoc[J],2011, 133:19 048-19 051.
[23]Krishna G,Dathar P,Shelton W A,etal.JPhysChemLett[J],2013, 3:891-895.
[24]Li Q,Xu P,Zhang B,etal.ChemCommun[J],2013, 49:10 838-10 840.
[25]Xiao J,Mei D H,Li X L,etal.NanoLett[J],2011, 11:5 071-5 078.
[26]Jiao Y,Zheng Y,Jaroniec M,etal.JAmChemSoc[J],2014, 136:4 394-4 403.
[27]Ren X M,Zhang S S,Tran D T,etal.JMaterChem[J],2011, 21:10 118-10 125.
[28]Hummelshoj J S,Blomqvist J,Datta S,etal.JChemPhys[J],2010,132:071 101.
[29]Ren X,Zhu J,Du F,etal.JPhysChemC[J],2014,118:22 412-22 417.
[30]Ren X,Wang B,Zhu J,etal.PhysChemChemPhys[J],2015,17:14 605-14 612.
[31]Kim H J,Jung S C,Han Y K,etal.NanoEnergy[J],2015,13:679.
[32]Lu Y C,Xu Z C,Gasteiger H A,etal.JAmChemSoc[J],2010, 132:12 170-12 171.
[33]Peng Z Q,Freunberger S A,Chen Y H,etal.Science[J], 2012, 337:563-566.
[34]Cui Y M,Wen Z Y,Liu Y.EnergyEnvironSci[J],2011,4:4 727-4 734.
[35]Lin X,Shang Y,Huang T,etal.Nanoscale[J],2014,6:9 043-9 049.
[36]Du Z Z,Yang P,Wang L,etal.JPowerSource[J] ,2014,265:91-96.
[37]Jung H G,Hassoun J,Park J B,etal.NatChem[J],2012,4,579-585.
[38]Zhang K J,Zhang L X,Chen X,etal.JPhysChemC[J],2013,117:858-865.
(编辑王方)
Catalytic Reaction Mechamism in the Positive ElectrodeInterface of Lithium Air Battery
WANG Beizhou1,2, WANG Youwei2, LIU Jianjun2, LU Wencong1
(1. Department of Chemistry, College of Sciences, Shanghai University, Shanghai 200444, China)
(2. State Key Laboratory of High Performance Ceramics and Superfine Microstructure, Shanghai Institute of Ceramics,
Chinese Academy of Sciences, Shanghai 200050, China)
Abstract:The Li-Air battery with high energy density is considered as one of important energy storage technologies which can be applied in electric vehicles. However, the practical application of Li-Air battery is currently prevented by the slow kinetic rates of discharge/charge reactions, which further results in many electrochemical problems such as high overpotential, poor cyclic performance, low current density, unstable electrodes, and electrolyte decomposition. Developing highly active catalysts in oxygen reduction (ORR) and oxygen evolution (OER) reactions is a hot research topic of Li-Air battery. Directly observing these reactions mechanisms is a challenging task since they occur in the interface between cathodes and Li2O2. The experimental techniques and first-principles calculations are used to reveal catalytic reaction mechanism and develop novel high active catalysts, which have become increasingly important. Herein, we review the interfacial interaction between catalyst and Li2O2with the aim to make a correlation of catalytic activity with electron transfer, interfacial structure, and adsorption energy of O2and Li2O2. These discussions are helpful to reveal catalytic descriptor of ORR and OER, design catalytic surface structure and predict new crystal structure, and improve electrochemical performance.
Key words:Li-Air battery;oxygen reduction reaction;oxygen evolution reaction;catalytic mechanism;interfacial catalysis;first-principles calculations
中图分类号:TM911.41;TQ152
文献标识码:A
文章编号:1674-3962(2015)12-0933-05
DOI:10.7502/j.issn.1674-3962.2015.12.11
通讯作者:刘建军,男,1973年生,研究员,博士生导师,
基金项目:国家自然科学基金资助项目(21573272)
收稿日期:2015-08-04
