流式荧光技术检测CA242对胰腺癌的临床诊断价值
2015-02-27陈园园薛苗李铭一张乐之
陈园园 薛苗 李铭一 张乐之
·论著·
流式荧光技术检测CA242对胰腺癌的临床诊断价值
陈园园 薛苗 李铭一 张乐之
目的对流式荧光技术检测血清CA242进行方法学评价,并评估其辅助诊断胰腺癌的临床价值。方法 收集临床确诊的胰腺癌(140例)、肺癌等其他肿瘤(69例)、消化道良性疾病(48例)及健康体检者(159名)的血标本,采用流式荧光发光法检测血清CA242水平,并与常规酶联免疫吸附(ELISA)法进行比较,评价流式荧光技术检测CA242的敏感性和特异性。结果 流式荧光发光法的CA242检测低限为0.89 U/ml,线性范围经验证为1~500 U/ml。方法不精密度批内变异系数(CV)为3.37%~5.30%,批间CV为7.43%~9.60%。与常规的ELISA法进行方法学比对,存在线性回归方程Y=1.0398X-0.947,相关系数r=0.9687。受试者工作特征(ROC)曲线下面积为0.811±0.025(95%CI0.763~0.859),以18.625 U/ml为最佳临界值,诊断胰腺癌的特异性达92.0%,敏感性为62.1%。结论 流式荧光技术检测血清CA242具有时间短,高通量,多指标检测的优势,值得临床进一步推广。
胰腺肿瘤; 流式荧光技术; 糖链抗原242; 实验室技术和方法
胰腺癌因具有高浸润性、缺乏早期诊断方法、对化疗不敏感而成为一种凶险的恶性肿瘤[1-3],在我国居恶性肿瘤发病第7位,发病率为7.28/106[4]。糖类抗原242(CA242)作为血清肿瘤标志物用于胰腺癌的辅助诊断具有重要价值[5-6],且在临床应用较长时间。目前CA242常规检测方法为酶联免疫吸附
(ELISA)法,该法性能稳定,用于临床已有数十年时间。随着临床对项目检测周期的要求提高,传统ELISA方法因耗时较长而显得落后。流式荧光法又称xMAP、悬浮阵列、液相芯片等,它是以荧光编码微球为核心,集流式原理、激光分析、高速数字信号处理等多种技术于一体的多指标同时进行分析的技术平台,可一次同时准确定量检测100种不同的生物分子,具有高通量、高灵敏度、多指标检测等优势,可用于免疫分析、核酸研究、酶学分析、受体及配体识别分析等多方面、多领域的研究。目前该方法已逐渐进入临床检测的各个领域[7]。本研究采用流式荧光法检测血清CA242水平,分析其检测效能,评估其应用于临床的诊断价值。
材料与方法
一、检测标本
收集2013年8月至2015年6月间第二军医大学长海医院诊治的血标本416例,包括胰腺癌140例,其他肿瘤69例(肺癌27例,肝癌13例,食管癌10例,乳腺癌6例,胃癌3例,食管癌、卵巢癌、子宫颈癌各2例,其他肿瘤4例),消化道良性疾病48例(慢性胰腺炎20例,急性胰腺炎15例,胰腺假性囊肿5例,慢性胃炎2例,肝炎2例,其他良性疾病4例),健康体检者159名。各种疾病的诊断根据临床症状、影像学检查、实验室检查和(或)病理学检查结果。
二、检测方法
CA242定量检测试剂盒(流式荧光发光法)由上海透景公司提供,多功能流式点阵仪为Luminex公司产品,型号Luminex200。严格按照试剂盒说明书进行检测。
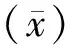
三、统计学处理
结 果
一、流式荧光发光法最低检测限及线性范围
流式荧光发光法检测CA242的最低检测限为0.89 U/ml,线性范围上限为500 U/ml,下限为1 U/ml。将从临床收集的接近线性范围上限的高值CA242样本(CA242 492.43 U/ml)和接近线性范围下限的CA242样本(CA242 1.12 U/ml)按1∶0、1∶4、2∶3、3∶2、4∶1、0∶1体积比混合成为6组等距浓度样本,每个浓度样本均重复检测2次,各个浓度点实测值与理论值相关系数r=0.9928,说明CA242在声明线性范围内线性良好。
二、流式荧光发光法检测的组内、组间差异
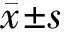
三、流式荧光发光法准确度与ELISA法比对
162例血样本在同天内分别用流式荧光法与ELISA法检测,两方法间存在线性回归方程:Y=1.0398X- 0.947,相关系数r=0.9687(图1),表明两种方法检测CA242的相关性良好,系统误差小,存在较好的可比性。
四、不同疾病组血清CA242水平
胰腺癌、其他肿瘤、胰腺及消化道良性疾病患者及健康人群的CA242水平分别为(159.96±277.40)、(31.02±107.95)、(32.76±114.62)、(4.69±4.97)U/ml。胰腺癌患者CA242水平显著高于其他3组,差异均有统计学意义(P值均<0.001),其他肿瘤组、胰腺及消化道良性疾病组与健康人群组差异无统计学意义(P=0.692)。
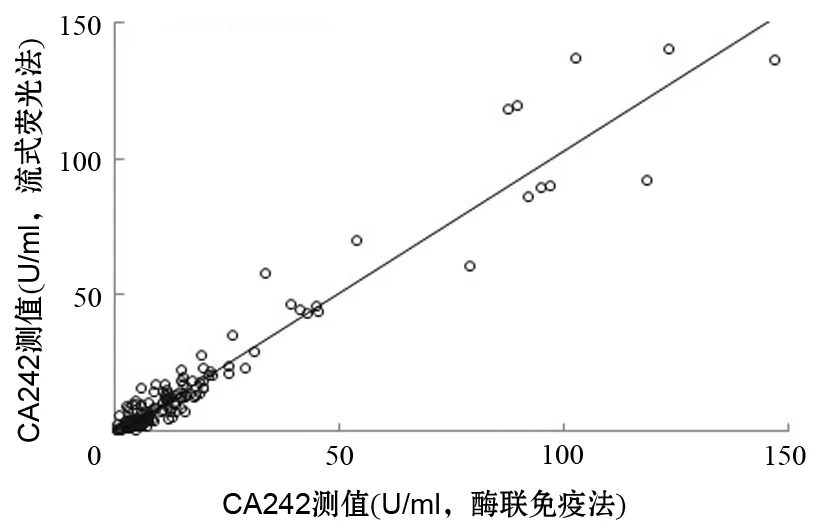
图1 流式荧光发光法与ELISA法检测CA242值的相关性
五、ROC曲线分析
416例临床血清样本的CA242的AUC为0.811±0.025,95%CI为0.763~0.859(图2)。以18.625 U/ml为界,诊断胰腺癌的敏感性为62.1%,特异性为92.0%,阳性预测值为79.8%,阴性预测值为82.7%。
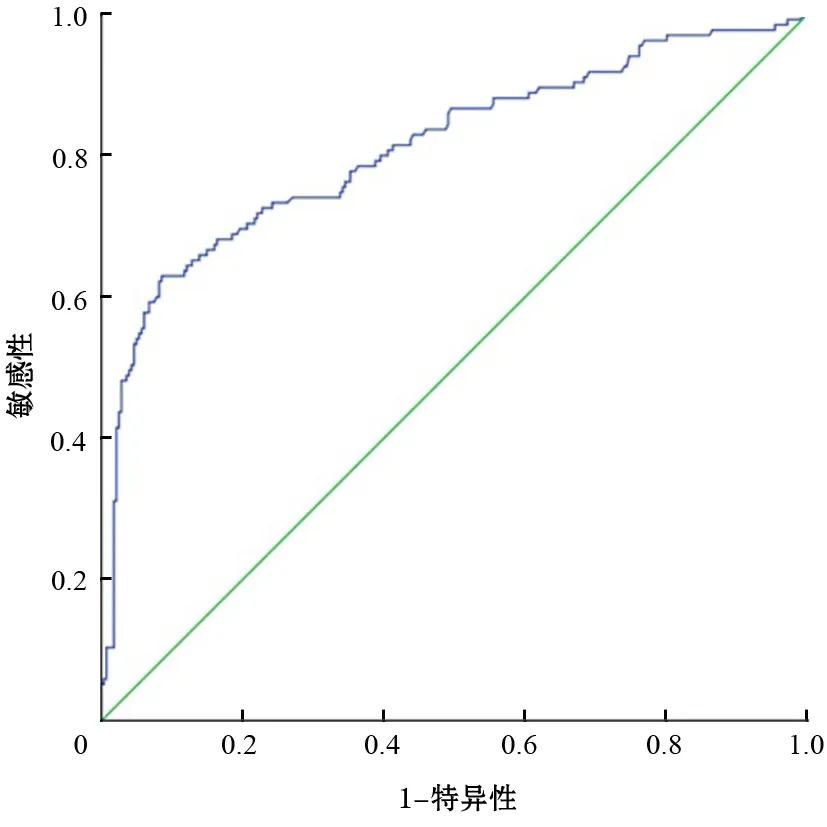
图2 CA242诊断胰腺癌的ROC曲线
讨 论
CA242在1985年由Lindolm等分离出来,识别CA242的抗体来源于人大肠癌Colo205细胞株[10],其抗原决定簇是一种唾液酸化的碳水化合物[11]。CA242是胰腺重要的肿瘤标志物,它相对于CA19-9在相似敏感性下具有更高的特异性[12]。在不同良恶性疾病时,CA242、CA19-9的抗原决定簇出现的机会和程度并不相同。恶性肿瘤时,两种抗原决定簇的出现均较正常时明显增多。而良性疾病尤其是良性肝、胰、胆道疾病时,CA19-9常常会升高,但CA242不升高。因此,检测CA242诊断恶性肿瘤比CA19-9和CA50更具特异性[6,12]。
目前临床检测CA242的常用方法为ELISA法、化学发光法(CLIA)、蛋白芯片法等[6,12-14]。流式荧光技术检测CA242是一种新方法,在流式荧光法平台上利用藻红蛋白(PE)标记CA242抗体,与血清中的CA242反应,加入交联有抗CA242的捕获单克隆抗体的荧光编码微球的混悬液,最终形成了微球-捕获抗体-CA242抗原-PE标记抗体的复合物。在流式点阵分析仪上,荧光编码的微球可被微量液体传送系统排成单列,通过两束激光,一束判定微球的编码从而决定被测肿瘤标志物的种类,另一束测定微球上的PE荧光强度,通过标准曲线,从而计算出待测血清中的CA242浓度。它是一种基于荧光编码微球和流式技术临床应用型高通量发光检测技术[15],具有灵敏度高、线性范围宽、精密度好等优点[15-17]。10 mg/ml三酰甘油或1 mg/ml胆红素不会干扰流式荧光法检测,而ELISA法在8 mg/ml三酰甘油或0.6 mg/ml胆红素水平以下才不受干扰。流式荧光技术反应特点属于液相反应,反应效率高,可以大大缩短反应时间。
本研究结果显示,采用流式荧光技术整体反应时间仅为1 h,远短于ELISA法4 h的反应时间;流式荧光技术的CA242定量检测试剂盒灵敏度为0.1 U/ml,高于ELISA试剂盒1 U/ml的敏感性;流式荧光技术对CA242检测的线性范围较宽,其上线可达到500 U/ml;批内、批间不精密度CV均<10%;流式荧光法与ELISA法的相关系数r=0.9687,存在较好的可比性。应用流式荧光技术检测CA242诊断胰腺癌的特异性92.0%时,敏感性为62.1%,与文献报道的特异性86.5%、敏感性70.3%接近[18]。流式荧光技术多重检测的特点为多指标联合检测诊断胰腺癌提供了良好的方法学工具。
[1] Pall G. Pancreatic cancer[J]. memo,2008, 1: 259-262.
[2] 赵平. 我国胰腺癌诊治策略的研究[J].胰腺病学, 2002,2(4):193-195.
[3] 李明欣,尚东,徐贺,等.首发症状为急慢性胰腺炎的胰腺癌诊断与治疗[J].中华消化外科杂志,2014,13(11):859-863.
[4] 赫捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012.
[5] Li HY, Cui ZM, Chen J, et al. Pancreatic cancer: diagnosis and treatments[J]. Tumor Biol, 2015,36(3):1375-1384.
[6] 张乐之,龚燕芳,屠振兴. 胰腺癌患者血清CA242定量测定及其意义[J]. 胰腺病学,2002,2(1):20-21.
[7] 徐京昕, 鲁劲松,张宏印. 流式荧光免疫法检测多肿瘤标志物的方法学评价[J]. 检验医学,2010, 25(3):167-170.
[8] NCCLS EP6-A. Evaluation of the linearity of quantitative measurement procedures:a statistical approach; approved guideline[S]. NCCLS, 2003.
[9] NCCLS EP5-A2. Evaluation of precision performance of quantitative measurement procedures; approved guideline-second rdition[S]. NCCLS, 2004.
[10] Haglund C, Lundin J, Kuusela P, et al. CA242, a new tumour marker for pancreatic cancer: a comparison with CA19-9, CA50 and CEA[J]. Ar J Cancer, 1994, 70: 487-492.
[11] 李春海. 肿瘤标志学临床与基础[M].北京:军事医学科学出版社,2007:291-292.
[12] Kawa S, Tokoo M, Hasebel O, et al. Comparative study of CA242 and CA19-9 for the diagnosis of pancreatic cancer[J]. Br J Cancer,1994,70(3):481-486.
[13] 徐有青,王丽华,刘慧丰. 肿瘤标志物CA242与CA19-9对胰腺癌的诊断作用研究[J]. 中国肿瘤临床,1999,26(2),113.
[14] 刘勇,李芙泉,王嘉嘉,等. 蛋白芯片检测多肿瘤标志物及对三种癌症的诊断价值[J]. 标记免疫分析与临床,2005,12(2):100-103.
[15] Dunbar SA. Applications of LuminexR xMAP technology for rapid,high-throughput multiplexed nucleic acid detection[J]. Clin Chim Acta, 2006, 363(1):71-82.
[16] Seideman J, Peritt D. A novel monoclonal antibody screening method using the Luminex-100 microsphere system[J]. J Immunol Methods,2002,267(2):165-171.
[17] Croft H, Malinowski T, Krizbaic L, et al. Use of Luminex xMAP-derived Bio-Plex bead-based suspension array for specific detection of PPV W and characterization of epitopes on the coat protein of the virus[J]. J Virol Methods,2008, 153(2): 203-213.
[18] Li X , Guo X , Li H, et al. Serum carbohydrate antigen 242 expression exerts crucial function in the diagnosis of pancreatic cancer[J]. Tumor Biol,2014,35(6):5281-5286.
(本文编辑:屠振兴)
·读者·作者·编者·
本刊已正式启用稿件远程管理系统
为顺应当今期刊网络化、数字化的发展趋势,更好地为广大作者、读者提供高质量的服务,中华医学会杂志社开发了稿件远程管理系统。该系统根据中华医学会系列杂志稿件处理流程、编辑加工规范、审稿制度、管理规范等业务需求设计,采用先进的数据库及网络技术,具有强大的数据处理和分析能力。稿件远程管理系统将协助作者、编辑、审稿专家、编委、定稿会专家、总编等相关人员多位一体地进行稿件业务处理,解决编辑部对稿件网络化流程管理的需要,并实现各类查询功能。2010年1月,本刊已正式启用稿件远程管理系统(登录网址为:http:∥www.cma.org.cn/ywzx/ywzx.asp)。
该系统包括作者在线投稿、在线查稿、专家在线审稿、编委在线定稿、总编办公、远程编辑等功能,通过网上投稿、网上查稿、网上审稿,实现作者、编辑、审稿专家的一体化在线协作处理,从而构建成为一个协作化、网络化、角色化的编辑稿件业务处理平台。对于广大作者而言,该系统最大的优点是支持在线投稿、方便作者及时了解稿件进程、缩短稿件处理时滞。使用过程中具体注意事项如下:(1)第一次使用本系统进行投稿的作者,必须先注册,才能投稿。注册时各项信息请填写完整。作者自己设定用户名和密码,该用户名和密码长期有效。(2)已注册过的作者,请不要重复注册,否则将导致查询稿件时信息不完整。如果遗忘密码,可以从系统自动获取,系统将自动把您的账号信息发送到您注册时填写的邮箱中。向中华医学会系列杂志中不同杂志投稿时无须重复注册,进入系统后即可实现中华医学会系列杂志间的切换。本刊的审稿专家使用同一个用户名作为审稿人进行稿件审理和作为作者进行投稿。(3)作者投稿请直接登录中华医学会业务中心下信息管理平台的稿件远程管理系统,点击“作者在线投稿”。投稿成功后,系统自动发送回执邮件。作者可随时点击“在线查稿”,获知该稿件的审稿情况、处理进展、审稿意见、终审结论等;有关稿件处理的相关结果编辑部不再另行纸质通知。
编辑部建议作者首选网络在线投稿。如有任何问题请与编辑部联系。
联系电话:021-31161362。Email:yixianbingxue@163.com。
Value of flowcytometry fluorescence immunoassay of CA242 in the diagnosis of pancreatic cancer
ChenYuanyuan,XueMiao,LiMingyi,ZhangLezhi.DepartmentofLaboratoryMedicine,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:ZhangLezhi,Email: 13661924186@163.com
Objective To conduct a methodological evaluation on flowcytomotry fluorescence detection of serum CA242, and to evaluate its value in the diagnosis of pancreatic cancer. Methods The blood samples of 40 cases of pancreatic cancer, 49 cases of other tumors, 48 cases of benign digestive diseases and 159 healthy volunteers were collected. Fowcytometry fluorescence immunoassay was used to detect serum level of CA242, and it was compared with routine ELISA method to measure its sensitivity and specificity. Results The detection limit of CA242 by flowcytometry fluorescence immunoassay was 0.89 U/ml, the linear range was 1~500 U/ml after confirmation. The within-batch CV was 3.37%~5.30%, between batch CV was 7.43%~9.60%. When compared with routine ELISA, flowcytometry fluorescence immunoassay showed the equation of linear regression is Y=1.0398X-0.947,r=0.9687. Area under ROC curve was 0.811±0.025 (95%CI0.763~0.859), with 18.625 U/ml as the best cutoff value, the specificity was 92.0% and the sensitivity was 62.1%. Conclusions Flowcytometry fluorescence immunoassay for CA242 testing has the advantage of shorter detection time, miltiple sample and testing project detection, which is worth of clinical application.
Pancreatic neoplasms; Flowcytometry fluorescence immunoassay; CA242; Laboratory techniques and procedures
10.3760/cma.j.issn.1674-1935.2015.06.003
200433 上海,第二军医大学长海医院实验诊断科
张乐之,Email:13661924186@163.com
2015-07-14)
