异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响
2015-02-26李雅娟王占洋邱理红营营马成俊孙喜灵王振华
李雅娟,甘 露,王占洋,邱理红,营营,张 红,马成俊,李 忌,孙喜灵,王振华
(1.石河子大学药学院,新疆石河子 832005;2.中国科学院近代物理研究所,甘肃兰州 730000;3.烟台大学生命科学学院,线粒体与健康衰老研究中心,山东烟台 264005;4.滨州医学院中西医结合学院,山东烟台 264003)
异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响
李雅娟1,甘 露2,王占洋1,邱理红1,营营3,张 红2,马成俊3,李 忌3,孙喜灵4,王振华3
(1.石河子大学药学院,新疆石河子 832005;2.中国科学院近代物理研究所,甘肃兰州 730000;3.烟台大学生命科学学院,线粒体与健康衰老研究中心,山东烟台 264005;4.滨州医学院中西医结合学院,山东烟台 264003)
中国图书分类号:R-332;R284.1;R329.24;R394.2;R730.264;R739.41
摘要:目的 研究异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响。方法 采用磺酰罗丹明B(SRB)比色法和克隆形成实验考察异甘草素对C6胶质瘤细胞增殖抑制作用;Giemsa染色观察细胞形态学变化;半定量RT-PCR、Western blot鉴定细胞分化相关基因及蛋白表达水平。结果 大鼠C6胶质瘤细胞经异甘草素诱导后,以浓度依赖性抑制细胞增殖(P<0.01);光镜观察到异甘草素诱导前的C6胶质瘤细胞呈两极长梭形或多角形,胞质多,胞突短;而诱导后细胞突起数目不同程度增多,细胞形态变细变长。诱导前克隆形成出现早,数量多,直径大,克隆形成率高;异甘草素处理组克隆形成率降低,与对照组相比差异有统计学意义(P<0.01)。RT-PCR、Western blot结果显示,异甘草素诱导后C6细胞GFAP mRNA和蛋白表达均明显上升(P<0.01)。结论 异甘草素能抑制大鼠C6胶质瘤细胞的增殖,并能诱导C6细胞分化。
关键词:异甘草素;C6胶质瘤;增殖;分化;克隆形成;吉姆萨染色;星形胶质细胞;GFAP
网络出版时间:2015-8-10 14:37 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.023.html
胶质瘤(glioma)属于神经上皮源性肿瘤,是颅内最常见的原发性肿瘤,约占颅内肿瘤的60%[1]。在我国,胶质瘤的发病率居颅内肿瘤之首,是预后较差的肿瘤之一,病死率高。尽管目前临床上采用传统的外科手术,内科化疗,先进的放射治疗手段以及应用各种新型的抗癌药物,但胶质瘤患者预后效果不佳,患者多于明确诊断后1年内死亡[2]。因此,探索新的、更加有效的胶质瘤的治疗方案及方法具有十分重要的意义。
Pierce等[3]于1961年首次提出肿瘤的诱导分化治疗的理论。该理论认为肿瘤细胞在一定条件下,如应用诱导分化药物等,可以继续分化,甚至达到终末分化,成为正常细胞,从而治愈肿瘤。寻找一种新的低毒的天然的抗肿瘤成分,以增强常规的抗肿瘤药物治疗肿瘤临床效果是当前医学研究的重点和难点之一。
异甘草素(isoliquiritigenin,ISL)是甘草中的一种黄酮类化合物,具有广谱抗肿瘤[4]、抗氧化[5]、清自由基[6]等多种药理学作用。也有文献报道,ISL可能通过非竞争性钙拮抗作用松弛豚鼠气管平滑肌[7],可改善反复脑缺血/再灌注小鼠认知功能障碍[8]。大鼠C6胶质瘤细胞,它被认为是较完美的研究神经胶质细胞发育毒性的实验模型[9]。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞的标志蛋白[10],通过检测它们的表达水平研究ISL 对C6细胞的分化影响。本课题组相关研究表明,ISL可抑制白血病和黑色素瘤细胞增殖,并诱导其分
化[11-12]。由于ISL对中枢神经系统肿瘤作用的研究还少见报道,同时亦有研究表明其在神经保护方面亦有一定作用,因此,本实验选用ISL为研究对象,研究其对大鼠C6脑胶质瘤细胞的诱导分化作用。
1 材料与方法
1.1材料与试剂 大鼠C6神经胶质瘤细胞购自中国典型培养物保藏中心(武汉),由烟台大学线粒体与健康衰老中心传代保存;DMEM培养基、胎牛血清(fetal bovine serum,FBS),美国Gibco公司;ISL(纯度98%),江西本草天工科技有限公司;磺基罗丹明B (SRB),上海晶纯生化科技股份有限公司;Giemsa干粉,北京拜尔迪生物技术有限公司;逆转录试剂盒,TaKaRa公司;引物合成,上海生工;GFAP抗体,美国CST公司。
1.2仪器与设备 AE31型荧光倒置显微镜,Motic公司;SpectraMax Paradigm型多功能酶标仪,美国美谷分子仪器有限公司;垂直电泳仪及转膜系统,北京六一仪器厂;PCR扩增仪,美国Bio-Rad公司;Tanon 5500凝胶成像系统,上海天能公司。
1.3细胞培养及分组 C6细胞培养于含10%FBS、100 kU·L-1青霉素和100 mg·L-1链霉素的DMEM培养基中,置于37℃、5%CO2、饱和湿度的培养箱中培养传代。
异甘草素储备液:以DMSO溶解ISL,配成浓度为100 mmol·L-1的贮存液,-20℃保存备用。使用前以含1%FBS的DMEM培养液稀释,使ISL的终浓度为20、30、40 μmol·L-1。
1.4SRB法测定异甘草素对细胞生长的抑制效应异甘草素对C6细胞生长抑制效应测定采用SRB法。取对数生长期细胞,消化计数,调整细胞密度至5× 104·mL-1,接种于96孔板中,每孔体积200 μL,接种24 h后,弃去培养基,分别加入含终浓度为0、20、30 和40 μmol·L-1异甘草素的培养基(含1%FBS),于37℃培养72 h。细胞培养结束后,取出培养板,每孔加入50 μL预冷的三氯乙酸(TCA)溶液(30%,W/V)固定细胞,TCA的终浓度为10%,然后在4℃冰箱中放置1 h。各孔用去离子水洗涤5遍,自然晾干后,每孔加入100 μL 0.4%的SRB溶液(1%的乙酸配制),静置染色30 min后,倒掉染液,用1%乙酸洗涤5遍,去除未结合的染料,空气中干燥后用100 μL Tris碱液(10 mmol·L-1,pH=10.5)溶解,在微孔板振荡器上振荡20 min,多功能酶标仪在540 nm波长下测量各孔的吸光值。按下式计算药物对细胞增殖的抑制率:
抑制率/%=(对照组OD值-给药组OD值)/对照组OD值×100%
1.5Giemsa染色观察细胞形态 取对数生长期细胞,用0.25%胰蛋白酶消化,制成单细胞悬液,接种于含灭菌盖玻片的6孔培养板中,待细胞贴附到盖玻片后,吸去培养液,分别加入含不同浓度异甘草素的培养基,对照组用含1%FBS的DMEM培养基,培养72 h,取出盖片,PBS洗涤2次,用甲醇固定10 min,PBS洗涤2次,滴加Giemsa染液显色5 min,自然晾干,二甲苯透明,甘油封片;于显微镜下观察并拍照。光镜下观察细胞核呈紫红色或蓝紫色,细胞质成粉红色。
1.6平板克隆形成实验 取对数生长期C6细胞接种于培养瓶,用不同浓度的异甘草素处理72 h,弃去培养液,用预冷PBS洗2遍,用0.25%胰蛋白酶消化并吹打成单个细胞,把细胞悬浮于含10%FBS的DMEM培养液中备用。将细胞接种于6孔板中,每孔200个细胞。置37℃、5%CO2及饱和湿度的培养箱,静置培养10 d。终止培养,弃去上清,PBS漂洗2次,甲醇固定10 min,弃固定液,Giemsa染色液染30 min,PBS冲尽多余染液,空气干燥。在倒置相差显微镜下观察集落形成情况并拍照。拍照并计算肉眼可见的集落数,最后计算克隆形成率。

1.7RT-PCR检测GFAP mRNA表达 参照文献[13]进行,检测异甘草素处理后GFAP mRNA的表达情况。取对数生长期的C6细胞消化制成细胞悬液,接种于中号培养瓶中,置于5%CO2、37℃恒温培养箱中过夜,待细胞贴壁。吸去培养液,换用含有不同浓度异甘草素的新鲜培养基,继续培养72 h后,用TRIzol试剂提取总RNA。逆转录反应体系扩增反应条件:94℃预变性3 min,94℃变性40 s,不同引物选择不同温度,退火45 s,72℃延伸1 min,循环30次后于72℃延伸10 min,得PCR产物,进行琼脂糖凝胶电泳分离分析。用Tanon 5500凝胶成像系统拍照并分析产物条带的相对光密度值。表1为实验所需的引物序列:

Tab 1 The designed primers and reaction condition for detecting different genes
1.8Western blot检测GFAP表达 取对数生长期
C6细胞接种于培养瓶,用不同浓度的异甘草素处理72 h,弃去培养液,用预冷PBS洗2遍,加入RIPA细胞裂解液,冰上裂解30 min,用细胞刮刀收集细胞,12 000×g离心30 min。取上清,BCA法测定裂解液中的蛋白浓度。取30 μg蛋白样品进行SDS-PAGE电泳,300 mA电转移120 min至PVDF膜,TBST漂洗3次,将PVDF膜放入含5%BSA的封闭液中,置于水平摇床,室温孵育120 min。取出PVDF膜,放入含有5%BSA的TBST的小鼠GFAP单克隆抗体一抗中(1 ∶1 000),4℃冰箱孵育过夜,再用TBST漂洗3次,与辣根过氧化物酶标记二抗(1∶5 000)室温孵育2 h,漂洗后,用Tanon 5500凝胶成像系统拍照并分析蛋白产物条带的相对光密度值。
2 结果
2.1异甘草素浓度依赖性抑制C6神经胶质瘤增殖不同浓度ISL处理C6细胞72 h,20 μmol·L-1ISL处理即表现出对C6细胞增殖的抑制作用,随着ISL浓度的增加,存活细胞数目逐渐减少,ISL对细胞的抑制作用逐渐增强,呈浓度依赖性。
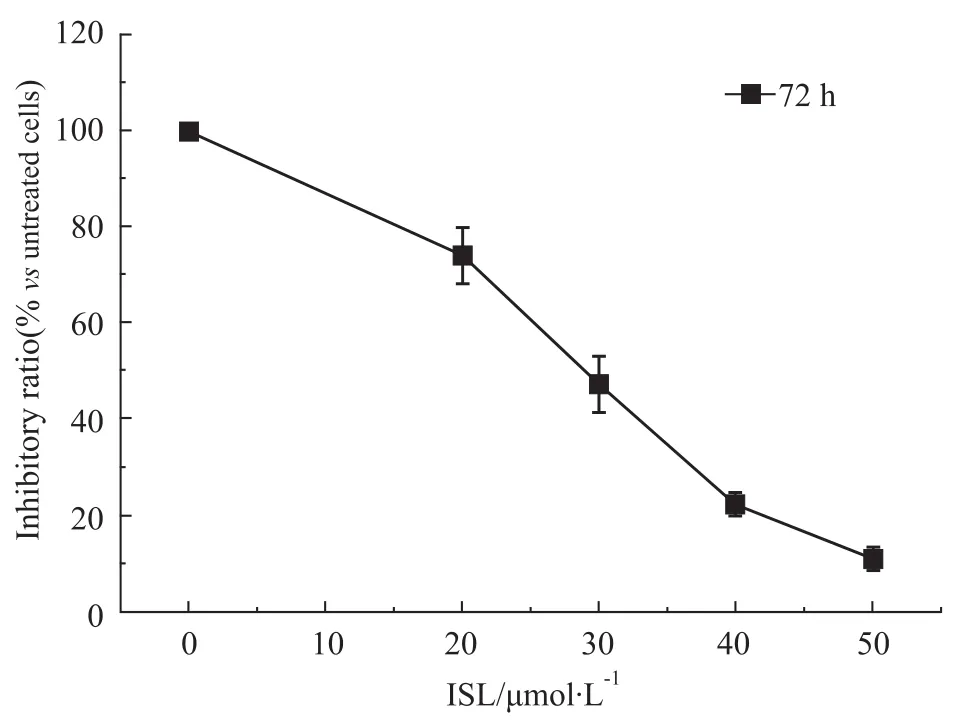
Fig 1 Effects of ISL on proliferation of C6 cells
2.2异甘草素对C6细胞的形态学的影响 光镜下观察,发现对照组胶质瘤细胞多数呈两极长梭形,有的呈多角形,胞质多,胞突短;而72 h ISL处理组细胞突起数目不同程度增多,细胞形态逐渐变细变长,ISL 20 μmol·L-1处理组(Fig 2)中细胞形态即开始出现变化,细胞胞体变圆,胞体两端突起变细变长,但部分细胞突起细而短,有的细胞突起长度可达细胞胞体的数倍,与对照组相比,阳性延展细胞数差异具有显著性;随着异甘草素处理浓度的增加、作用时间的延长,阳性延展细胞越来越多,72 h ISL处理组可见细胞突起明显变长,ISL 40 μmol·L-1处理组细胞形态学改变较其他组相比最明显(Fig 2A)。经吉姆萨染色后显微镜下观察,大鼠C6胶质瘤细胞胞质丰富,呈淡蓝色或深蓝色,有非特异性嗜天青颗粒(呈紫红色),两极呈短梭形,胞突短,胞质丰富,如图2所示,ISL处理后,细胞胞质变少,胞突明显变细变长,胞质呈紫红色。
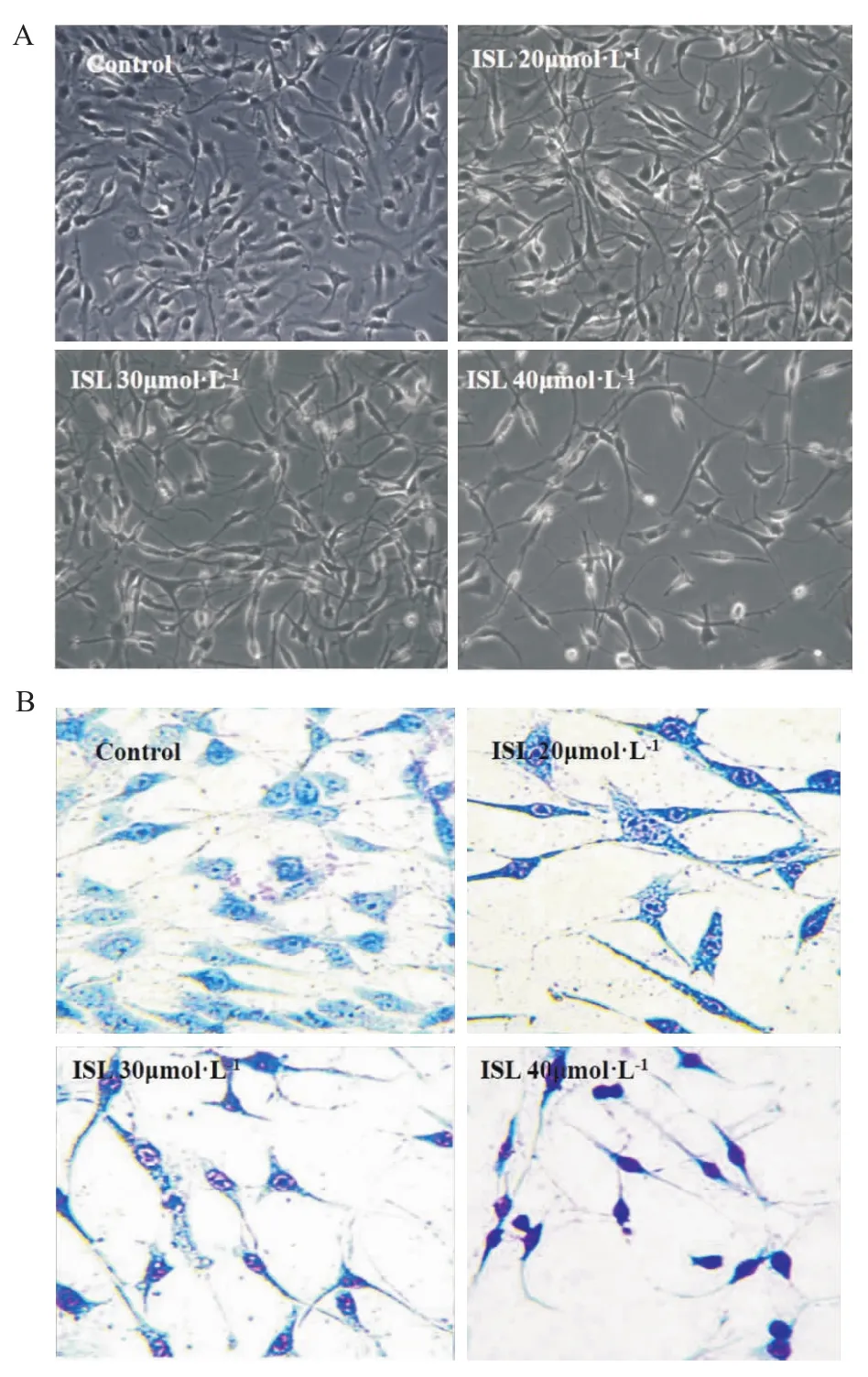
Fig 2 Morphological transformation induced by ISL in C6 glioma cells(×200)
2.3异甘草素对C6细胞的克隆形成率的影响 ISL诱导C6细胞分化后,神经胶质瘤C6细胞会向星型胶质细胞分化,因而集落生成能力降低。对照组克隆形成出现早,数量多,直径大,克隆形成率高(36%),20 μmol·L-1ISL处理组克隆形成率为25%,与对照组相比差异有统计学意义(P<0.01),40 μmol·L-1ISL处理组克隆形成率为6%,与对照组相比差异有统计学意义(P<0.01)。
ISL处理组与对照组相比,其形成的集落的个数明显少于对照组的克隆数,其恶性程度降低,增殖能力下降,集落形成能力也减弱(Fig 3);统计细胞形成的平均集落数,可以看出,对照组细胞的克隆形成率36%,明显多于40 μmol·L-1ISL处理组克隆形成率16%;ISL处理组最大与最小集落较对照组相比均明显变小,并且大多数细胞不能形成明显的集落,说明ISL使C6细胞分化。
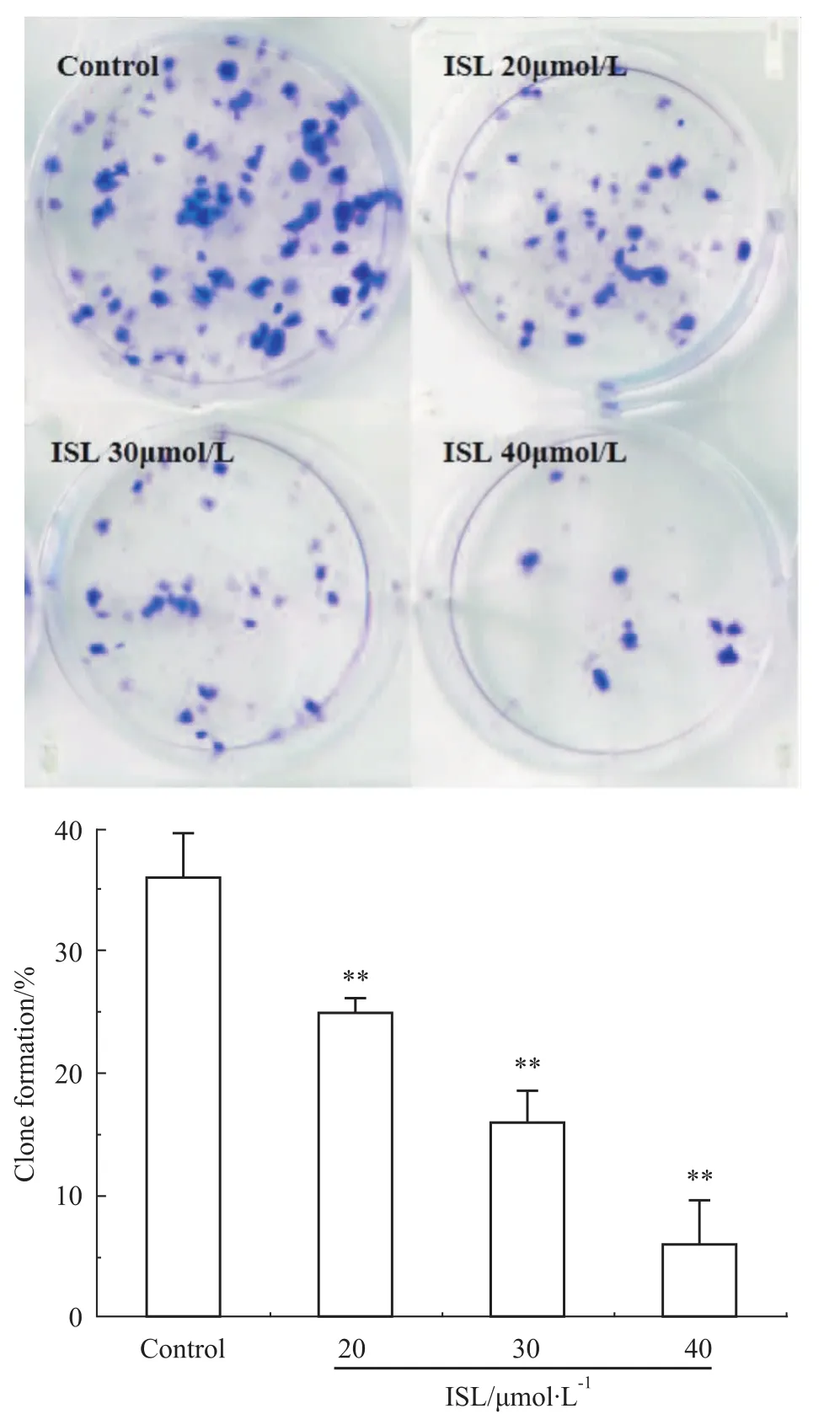
Fig 3 ISL significantly reduced number of colony formation in C6 cells
2.4异甘草素对C6细胞的GFAP mRNA表达的影响 采用RT-PCR方法,分析不同浓度的ISL对细胞分化相关蛋白GFAP mRNA表达情况的影响。结果如Fig 4所示,不同浓度的ISL(20、30、40 μmol· L-1)作用72 h后,能够诱导细胞分化相关蛋白GFAP mRNA上调,在40 μmol·L-1作用时,GFAP mRNA表达水平最高,与对照组相比差异有显著性(P< 0.01)。
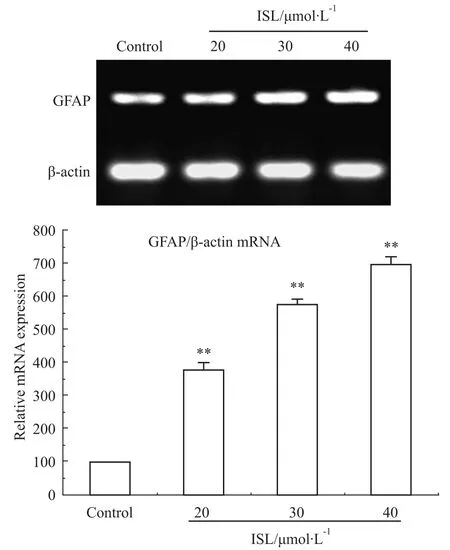
Fig 4 ISL significantly increased expression of GFAP mRNA in C6 glioma cells(n=3)
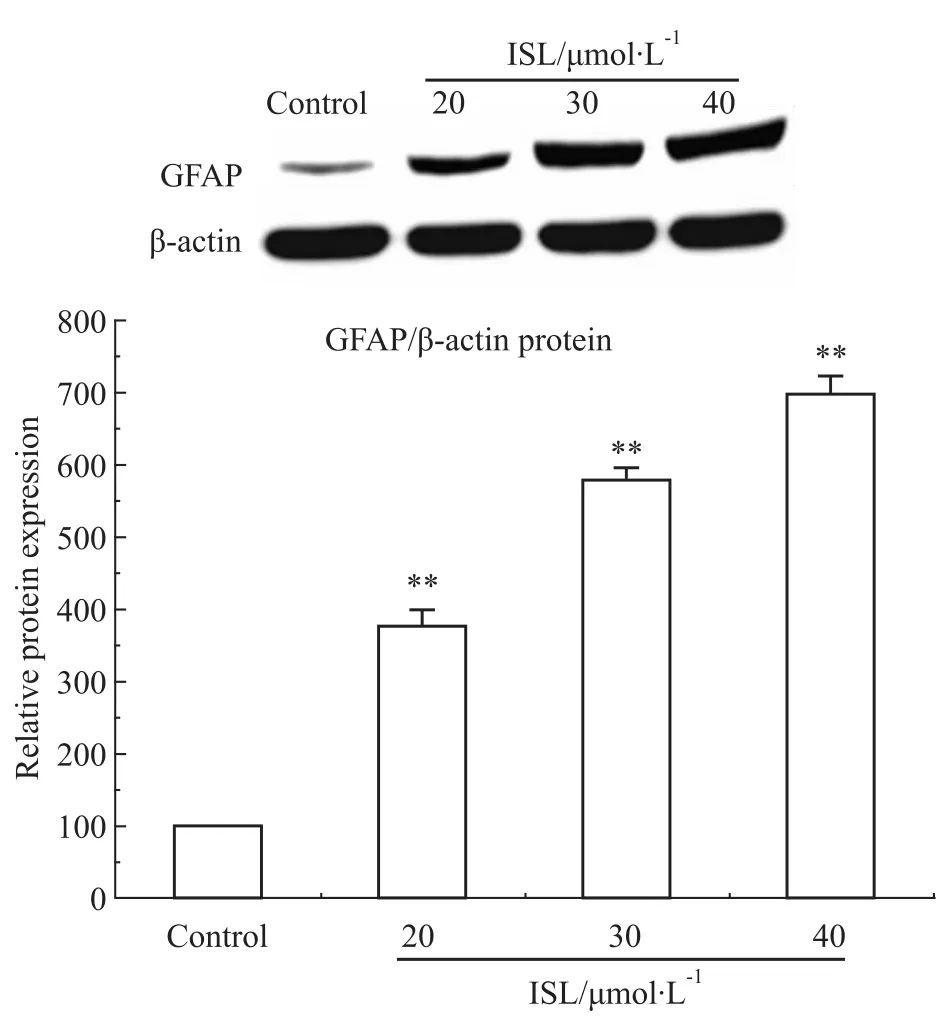
Fig 5 ISL significantly increased expression of GFAP protein in C6 cells
2.5异甘草素对C6细胞GFAP蛋白表达的影响采用Western blot方法,分析不同浓度的ISL对细胞分化相关蛋白GFAP表达情况的影响。结果如Fig5
所示,不同浓度的ISL(20、30、40 μmol·L-1)作用72 h后,均能够诱导细胞分化相关蛋白GFAP上调,与对照组相比差异均具有统计学意义(P<0.01)。在40 μmol·L-1作用时,GFAP表达水平最高。
3 讨论
胶质瘤是脑肿瘤中发病率较高的一种肿瘤,其手术治疗效果不佳,容易复发,因此是神经肿瘤治疗的一个难点和热点。为了更好地探索胶质瘤的治疗策略,国内外学者探索从传统的中医药中寻找解决的办法。诱导分化是指恶性肿瘤在体内外分化诱导剂存在下,重新分化向正常方向逆转的现象。大量研究报道和体外实验表明,在某些诱导分化剂作用下,肿瘤细胞可被诱导分化,出现类似正常细胞的表型或恢复正常细胞的某些功能。
ISL是从中药材甘草中提取和分离得到的黄酮类化合物,在药用植物中广泛存在,研究表明其有多种药理学活性,是甘草所提取出来的黄酮类成分中研究较多的重要化合物之一[14]。异甘草素对其他系统肿瘤的抑制作用已经陆续有相关报道,而对中枢神经系统肿瘤作用的研究少见报道,所以本实验用ISL对胶质瘤细胞C6进行研究,探讨ISL的增殖抑制及诱导分化作用。
SRB比色法,主要用来检测细胞增殖情况。实验分别测定了20、30、40 μmol·L-1的异甘草素,在72 h 对C6细胞活性的影响。如Fig 1所示,ISL低剂量组(20 μmol·L-1)、24 h即开始表现出对C6细胞生长有抑制作用,随着剂量的增加、ISL的抑制作用也加大,呈剂量效应(P<0.01)。
本实验对C6细胞形态学观察显示,异甘草素在浓度为20 μmol·L-1时就对C6有抑制作用,ISL处理72 h后,对胶质瘤细胞的抑制作用呈浓度依赖性,倒置显微镜下观察可见,与对照组相比细胞两端变细变长的增多。
克隆形成率反映细胞群体依赖性和增殖能力两个重要性状,形成克隆的细胞必为贴壁和有增殖活力的细胞。如Fig 3所示,对照组克隆形成出现早,数量多,直径大,克隆形成率高,而ISL处理组克隆形成率低,与对照组相比差异有统计学意义(P<0.01),且绝大多数不能形成有效克隆。
GFAP是星形胶质细胞及其肿瘤的特异标志物,是胶质细胞特有的细胞骨架蛋白,它的表达对于维持胶质细胞的正常形态以及调节细胞的生长速度具有重要的作用,是判断胶质细胞分化程度的一个重要标准之一,它与分化程度呈正相关[15]。本实验采用检测RT-PCR、Western blot鉴定ISL对C6的诱导分化作用,如Fig 4和5所示,ISL对C6细胞作用72 h后,mRNA和蛋白水平的实验结果均显示GFAP的表达随着ISL的作用剂量增加而增加,特别是40 μmol·L-1ISL处理组增加最明显(P<0.01)。
课题组前期研究表明,NADPH氧化酶活化及活性氧生成介导了ISL诱导的HL-60细胞分化[16]。本研究证实异甘草素可诱导C6细胞向星形胶质细胞分化,但异甘草素是否通过调控细胞内氧化还原状态诱导C6胶质瘤分化,有待进一步研究。
综上所述,异甘草素能抑制大鼠C6胶质瘤细胞的增殖,并能诱导C6细胞分化。本研究以传统中药材甘草的活性成分异甘草素作为研究对象,研究其在中枢神经系统肿瘤中的作用,并讨论其对细胞增殖和分化的影响,对于异甘草素的开发应用及异甘草素对中枢神经疾病及其他恶性肿瘤的分化治疗相关研究提供了一定的理论依据和实践基础,对新疆地区的甘草产业的发展有重要意义。
(致谢:本实验在烟台大学生命科学学院,线粒体与健康衰老研究中心完成,衷心感谢实验室全体教师的指导和同学的帮助!)
参考文献:
[1] Dolecek T A,Propp J M,Stroup N E,et al.CBTRUS statistical re-port:primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J].Neuro Oncol,2012,14(sup-pl 5):v1-v49.
[2] Bao S,Wu Q,McLendon R E,et al.Glioma stem cells promote ra-dioresistance by preferential activation of the DNA damage response [J].Nature,2006,444(7120):756-60.
[3] Pierce G B,Verney E L.An in vitro and in vivo study of differentia-tion in teratocarcinomas[J].Cancer,1961,14(5):1017-29.
[4] 木合布力·阿布力孜,王永波,徐方野,阿布力孜·阿布杜拉.异甘草素和3-甲氧基异甘草素对人肝癌Bel-7402细胞的抗癌活性[J].中国药理学通报,2014,30(6):887-8.
[4] Ablise M,Wang Y B,Xu F Y,Abulizi A.Anticancer property of isoliquiritigenin and 3-oximethyl-isoliquiritigenin in human Bel-7402 hep-atoma cell lines[J].Chin Pharmacol Bull,2014,30(6):887 -8.
[5] Zhang X,Zhu P,Zhang X,et al.Natural antioxidant-isoliquiritige-nin ameliorates contractile dysfunction of hypoxic cardiomyocytes via AMPK signaling pathway[J].Mediators Inflamm,2013,2013:390890.
[6] Hirchaud F,Hermetet F,Ablise M,et al.Isoliquiritigen induces caspase-dependent apoptosis via down regulation of HPV16 E6 ex-pression in cervical cancer ca ski cells[J].Planta Med,2013,79 (17):1628-35.
[7] 刘 斌,杨 静.异甘草素对豚鼠离体气管平滑肌收缩功能的
影响[J].中国药理学通报,2005,21(7):892-2.
[7] Liu B,Yang J.Effects of isoliquiritigen on the contraction of isola-ted guinea pig racheal smooth muscle[J].Chin Pharmacol Bull,2005,21(7):892-2.
[8] 詹 春,杨 静,詹 莉,等.异甘草素对脑缺血再灌注小鼠认知功能障碍及能量代谢的影响[J].中国药理学通报,2005,21 (2):213-6.
[8] Zhan C,Yang J,Zhan L,et al.Effects of isoliquiritigen in on cog-nition dysfunction and brain energy metabolism following repeated cerebral ischemia-reperfusion in mice[J].Chin Pharmacol Bull,2005,21(2):213-6.
[9] Garcia S J,Seidler F J,Slotkin T A.Developmental neurotoxicity of chlorpyrifos:targeting glial cells[J].Environ Toxicol Pharmacol,2005,19(3):455-61.
[10]Leisewitz A V,Urrutia C R,Martinez G R,et al.A PPARs cross-talk concertedly commits C6 glioma cells to oligodendrocytes and in-duces enzymes involved in myelin synthesis[J].J Cell Physiol,2008,217(2):367-76.
[11]Zhao H,Yuan X,Li D,et al.Isoliquiritigen enhances the antitu- mour activity and decreases the genotoxic effect of cyclophosphamide [J].Molecules,2013,18(8):8786-98.
[12]Li D,Wang Z,Chen H,et al.Isoliquiritigenin induces monocytic differentiation of HL-60 cells[J].Free Rad Biol Med,2009,46 (6):731-6.
[13]Dhuna K,Dhuna V,Bhatia G,et al.Cytoprotective effect of meth-anolic extract of Nardostachys jatamansi against hydrogen peroxide induced oxidative damage in C6 glioma cells[J].Acta Biochim Pol,2013,60(1):21-31.
[14]Shibata S.A drug over the millennia:pharmacognosy,chemistry,and pharmacology of licorice[J].Yakugaku Zasshi,2000,120 (10):849-62.
[15]Eng L F,Ghirnikar R S,Lee Y L.Glial fibrillary acidic protein:GFAP-thirty-one years(1969-2000)[J].Neurochem Res,2000,25(9-10):1439-51.
[16]Chen H,Zhang B,Yao Y,et al.NADPH oxidase-derived reactive oxygen species are involved in the HL-60 cell monocytic differentia-tion induced by isoliquiritigenin[J].Molecules,2012,17(11):13424-38.
Effect of Isoliquiritigenin on C6 glioma cell proliferation and differentiation
LI Ya-juan1,GAN Lu2,WANG Zhan-yang1,QIU Li-hong1,SI Ying-ying3,ZHANG Hong2,MA Cheng-jun3,LI Ji3,SUN Xi-ling4,WANG Zhen-hua3
(1.School of Pharmacy,Shihezi University,Shihezi Xinjiang 832005,China;2.Institute of Modern Physics,Chinese Academy of Sciences,Lanzhou 730000,China;3.Center of Mitochondrion and Healthy Aging,College of Life Sciences,Yantai University,Yantai Shandong 264005,China;4.Shandong Key Laboratory of TCM Heart-spleen Foundation,Binzhou Medical University,Yantai Shandong 264003,China)
Abstract:Aim To investigate the effects of isoliquiri-tigenin(ISL)on C6 glioma cell proliferation and differ-entiation.Methods C6 glioma cells’viability and proliferation were respectively measured by SRB test.Colony formation of C6 glioma cells from different groups was assayed.After culturing the cells from each group,giemsa staining was used to observe cell mor-phology.RT-PCR was applied to detect mRNA expres-sion of GFAP.Western blot was applied to detect the expression of GFAP.Results ISL effectively inhibited the viability of C6 glioma cells when compared with the control group in a concentration-dependent manner(P <0.01).The morphological observation under light mi-croscope showed that:in the control group,most of the undifferentiated C6 cells showed long fusiform and po-lygonal shape.Compared to the control group,the C6 cells treated with ISL revealed alteration in morphology such as astrocytes with smaller smooth,round body and much finer longer,tapering processes.The cloning for-mation rate detection revealed that:the colonies in the control group semerged earlier and were larger than those experimental ones,the cloning formation rate was higher,while almost no effective cells colony emerged in ISL treated groups(P<0.01).Western blot and RT-PCR analysis showed that GFAP expression in the ex-perimental groups increased(P<0.01).Conclusion ISL may inhibit the proliferation of C6 glioma cells and induce their differentiation.
Key words:Isoliquiritigenin;C6 glioma cell;prolifera-tion;differentiation;colony formation;giemsa staining;astrocyte;GFAP
作者简介:李雅娟(1989-),女,硕士生,研究方向:分子药理学,E-mail:yajuanli@sina.cn;王振华(1973-),男,博士,副教授,研究方向:自由基生物医学,通讯作者,E-mail:zhenhuawang@tom.com
基金项目:国家自然科学基金面上项目(No 11175222,21372190);石河子大学重大科技攻关计划项目(No gxjs2012-zdgg02);山东省泰山学者建设工程专项经费(tshw201502046);教育部新世纪优秀人才支持计划(NCET-10-0967)
收稿日期:2015-03-12,修回日期:2015-05-28
文献标志码:A
文章编号:1001-1978(2015)09-1298-06
doi:10.3969/j.issn.1001-1978.2015.09.023