国家生物医学材料工程技术研究中心
2015-02-25顾忠伟
国家生物医学材料工程技术研究中心
编者按:国家生物医学材料工程技术研究中心(四川大学)顾忠伟课题组的主要研究方向涉及生物医用高分子、药物/基因高效传递系统、功能纳米生物材料与有序组装等,从可控合成、结构调控、新功能与多功能构筑等方面做了一系列开创性工作。近5年来,在AdvMater,AngewChemIntEd,ACSNano,AdvFunctMater,Biomaterials,JControlRel,Small等国际著名学术期刊上发表论文150余篇,国际及全国学术会议提交报告摘要100余篇;获授权国家发明专利20余项;编写及翻译10余部专著及章节(含英文专著/章节),研究成果得到了国际国内学术界的高度评价。
肽类树状大分子的可控合成、选择性功能化与生物医学功能构筑
在国际上率先建立了用“点击化学”可控合成结构精确规整、分子量单一,并由不同氨基酸组成的链结构有序排列的高代数(≥5代)肽类树状大分子(PD)新技术;建立了以表面含多官能团的无机纳米粒(如:八官能团倍半硅氧烷(POSS)、超顺磁氧化铁纳米粒(SPIO)、介孔二氧化硅等)为核可控合成PD,以及选择性多功能化PD的新技术和新方法;为深入开展新一代肽类树状大分子生物医用高分子材料的研究奠定了基础。主要成果:①成功研发了具有靶向功能的肽类树状大分子磁共振(MRI)分子探针,解决了单个PD分子上靶向基团(硫代半乳糖)与显影基团(Gd-DTPA)精确调控的难题;发现PD的多价特征和纳米尺度效应使该系列MRI分子探针显示出良好的水相弛豫率、成像质量,以及高出临床试剂~7倍的信号强度,并具有血液长循环特点;揭示了探针的生物学效能与PD外围官能团分子结构、性质、数量等具有相关性,调控PD外围功能团可实现低Gd (III)含量下MRI的高效能成像,以及高的水相弛豫率(达临床试剂的~10倍)。②研发了结构精确的高代数杂化肽类树状大分子,发现了肽类树状大分子的分子结构、链结构及其序列分布与基因转染效率及生物安全性之间的关系与规律,获得了数倍于国际金标准聚乙烯亚胺(PEI)的细胞转染效率的PD非病毒基因载体。③利用特定生物微环境可触发断裂的动态化学键(腙键、肽键、配位键等)构建了PD外围的生物活性功能分子,研发了系列基于肽类树状大分子的高效能药物递送系统;首次发现并确证了酶促分子的肽键断裂位点,实现了高分子偶联药物在肿瘤组织的快速及精确控释,保持了药物分子结构的完整性并维持其生理活性;生物分布显示铂类药物在肿瘤组织的富集量超过了8%(是文献报道同类药物递送系统的两倍以上,临床药物的25倍),为解决药物递送系统在血液循环中的稳定性与肿瘤组织/细胞内药物快速释放(高富集)这一矛盾奠定了科学基础。
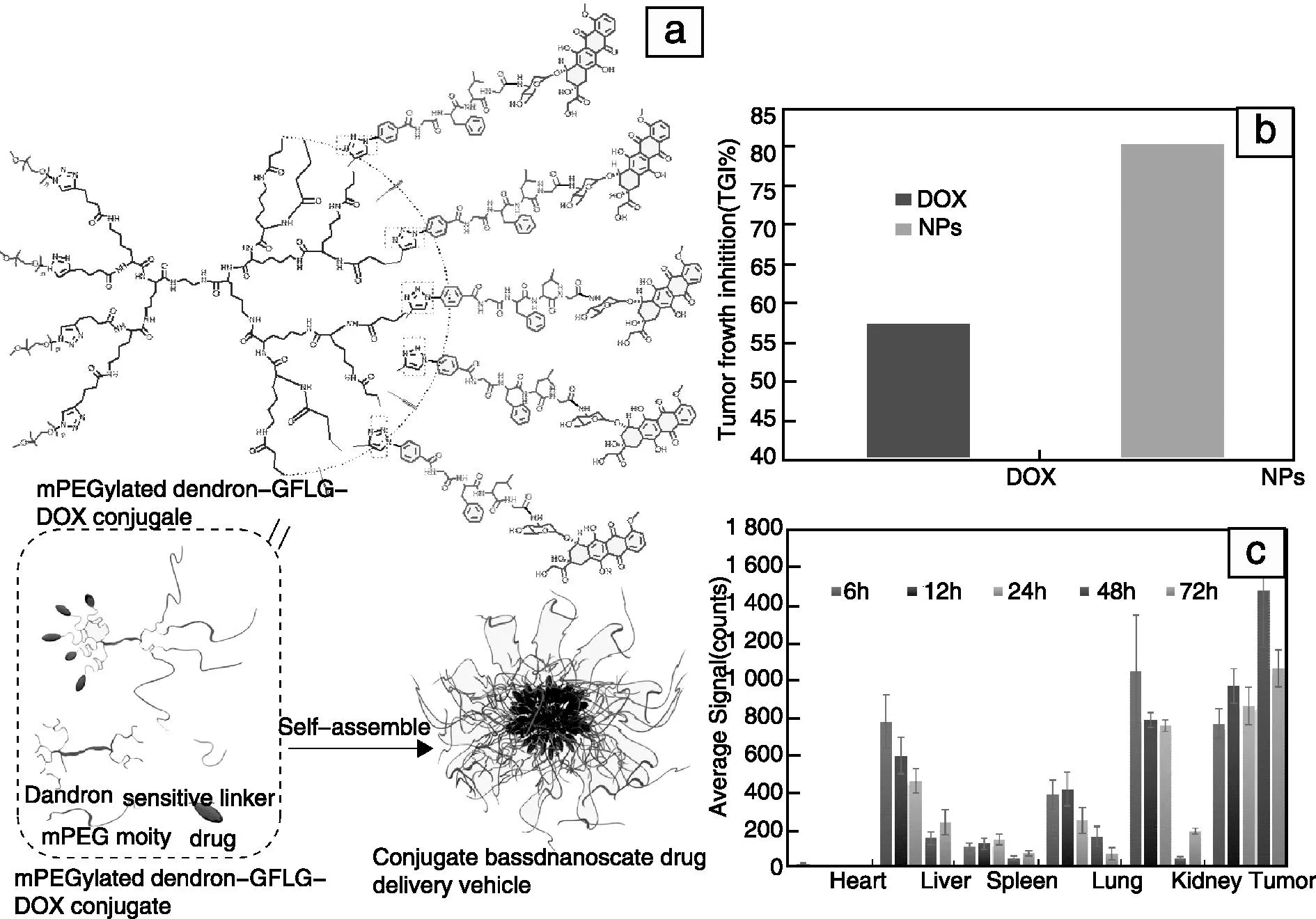
图1 肽类树状大分子纳米载药系统(a),显著调高抗肿瘤效果(b)和肿瘤部位高聚集(c)
肽类树状大分子可控超分子自组装及仿生生物医学功能构筑
于国际上首次发现了特定端基的线型多肽与肽类树状大分子能发生“协同自组装”现象,实现了肽类树状大分子聚集态结构的有序调控,建立了低代数PD与聚氨基酸协同自组装的方法,发现了分子间的弱相互作用形成了α-螺旋、β-折叠、β-转角等二级结构,并驱动组装基元形成了具有多层次结构的仿病毒衣壳,揭示了肽类组装基元的pH感知特性,赋予了肽类树状大分子组装体的细胞微环境响应性,实现了高效的药物和基因递送功能。构建了低代数杂化PD在量子点QD表面的光促模板组装的新方法,发现了生物医学功能组装增强的机理,获得的细胞转染效率比相应的PD高出5万倍,而且在体内的基因转染特别是p53抑癌功能基因的表达也十分显著,并实现了实时监测与示踪。发现具有精确结构并富含色氨酸的肽类树状大分子能与肿瘤细胞的DNA发生超分子反应而使其凋亡,揭示了三维空间结构、高度支化并富含外围功能团的PD抑制肿瘤细胞乃至耐药肿瘤细胞等生物功能倍增效应的机理,开创了治疗性肽类树状大分子这一新的研究方向。

图2 治疗型肽类树状大分子结构式及其抗肿瘤机制(a),肽类树状大分子二元协同自组装策略及仿病毒衣壳组装体纳米结构(b),肽类树状大分子自组装/解组装机制及其药物控释(c)和肽类树状大分子光促模板组装策略及其可示踪的基因递送系统(d)
生物降解高分子仿病毒基因递送系统
受病毒结构和功能的启发,仿病毒基因递送系统得到了业界高度的关注。课题组取得的成果如下:①提出了利用著名的特洛伊木马(Trojan Horse)策略,构建了基于双硫键修饰的透明质酸衍生物仿病毒包膜,克服了基因递送系统体内循环及靶向的生理屏障,并揭示其规律与作用机理;利用双硫/双硒键特定生物微环境敏感断裂,提出了分级解组装与基因程序化控释的策略,构建了具有仿病毒衣壳和包膜的基因靶向递送系统,经静注后体内基因转染效率提高了150倍以上,实现了仿病毒基因递送系统在血液循环中酶解保护、靶向及肿瘤靶组织/细胞的高效表达;成功介导抑癌基因p53抑制肿瘤细胞增殖并促进其凋亡,为研发高效能仿病毒基因靶向递送系统提出了新的设计理念。②利用特定氨基酸持有的如穿膜、质子海绵等功能,设计构建了基于壳聚糖-氨基酸的仿病毒包膜的基因递送系统,使多个细胞系的转染效率提高近千倍,而体内基因表达也超过PEI百余倍,阐明了促进细胞内吞、DNA逃逸与入胞是大幅度提升细胞转染效率的关键缘由。③针对肿瘤组织及细胞内弱酸性以及细胞内谷胱甘肽浓度比循环系统高千余倍的微环境特征,利用腙键、双硫键等构建了动态“隐身”功能的仿病毒基因递送系统,确证了特定细胞微环境能触发动态化学键断裂而解离PEG并显著提高基因转染,为解决利用PEG长循环功能并消除其影响基因转染之弊端提供了新的设计思路;发现了Schiff-base碳氮双键在弱酸环境断裂导致DNA复合物的解组装与DNA释放,以及咪唑分子介导DNA的内涵体逃逸是提高基因转染效率的重要因素;为研发隐身可控的仿病毒基因递送系统研究奠定了基础。
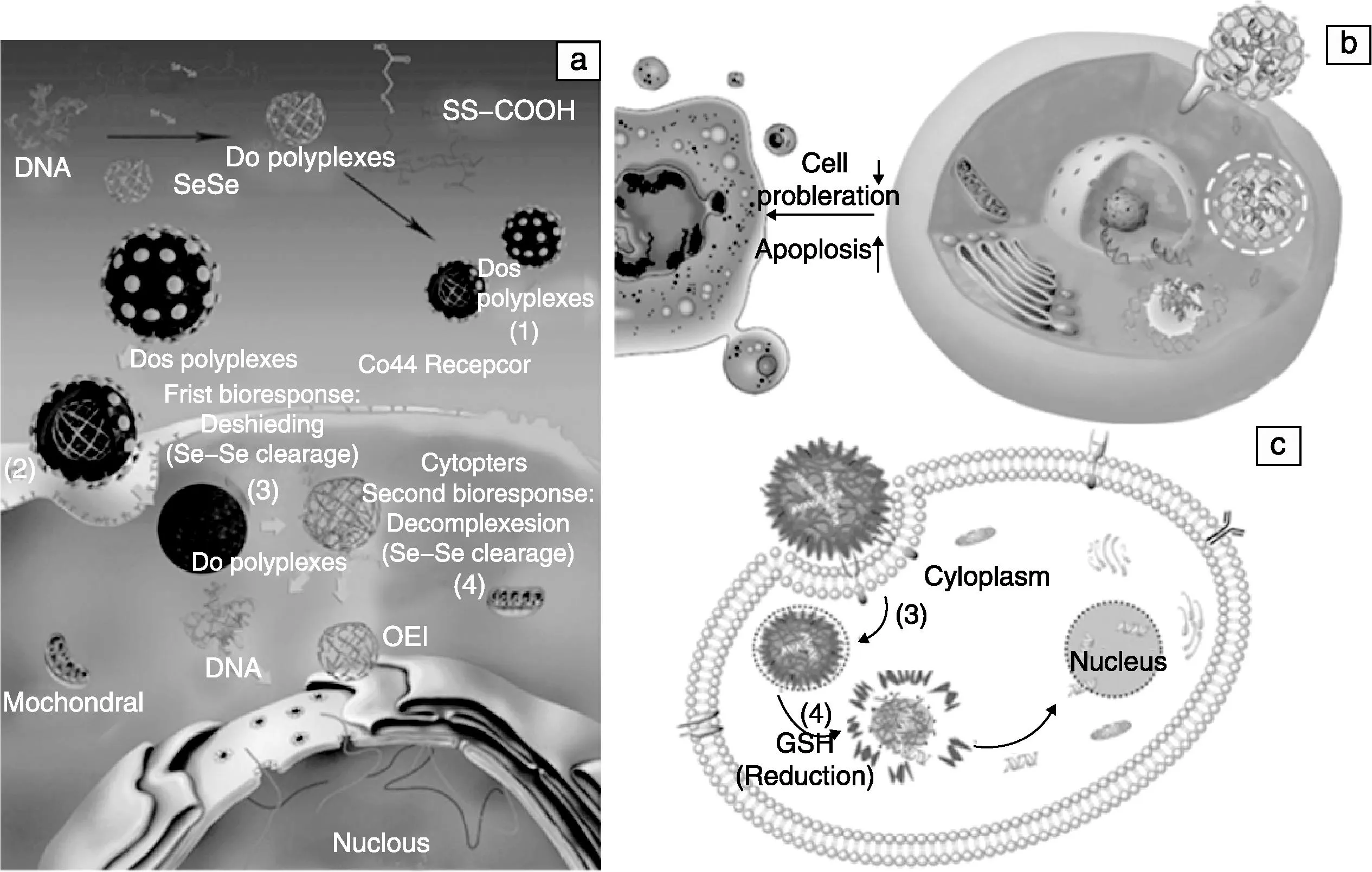
图3 可分级解组装及基因程序化控释的仿病毒基因递送系统的组装、解组装及DNA程序化释放(a),介导抑癌基因p53(b)和报告基因的仿病毒基因递送系统(c)
生物降解高分子与先进药物递送系统

图4 具有立构复合结构的双壳-核纳米载药系统(a),成胶速度快并可逆的水凝胶(b),具有π-π共轭结构高分子胶束(c)和集肿长循环、瘤微环境敏感和线粒体靶向的多功能脂质体药物递送系统(d)
生物降解高分子是构建先进药物递送系统的重要基础。课题组重要研究成果如下:①于国际上率先创建了基于环状碳酸酯的可控化学交联聚合的新方法,获得了一系列具有三维网络结构的聚碳酸酯聚/共聚物,解决了低分子量(<15万)聚碳酸酯在生理环境易发生蠕变,而高分子量聚碳酸酯体内降解速率快的关键难题;发现了交联与共聚分子/链结构调控降解行为的协同作用,揭示了体内外的降解规律与调控机制,创建了基于聚碳酸酯的恒速释药功能;研发了聚合-成型一体化技术,克服了交联聚合物难于加工成型的关键瓶颈;为无酸性降解产物的长效恒速释药埋植剂的临床应用提供了理论基础与技术支撑。②提出了弱酸环境触发咪唑基团质子化并溶胀高分子纳米载药系统使药物快速释放的策略,设计并构建了以生物降解聚丙交酯为疏水链段、聚组氨酸与PEG为亲水链段的双壳-核生物触发式高分子纳米载体,建立了精确定量调控其嵌段共聚组成比的方法;发现纳米粒尺度在pH由中性降低至聚组氨酸链段pKa值时增加近20倍,获得了弱酸环境触发的药物快速释放,明显增强了抗肿瘤效果。研究还发现具有不同光学异构体聚丙交酯链段的三嵌段共聚物在水相自组装形成立构复合的双壳-核纳米载体,使其临界凝聚浓度降低90%,实现了双壳-核纳米载药系统在体内循环系统中的高稳定性。③提出了基于药物-载体材料相互作用构建新型高分子载药胶束的思想,设计合成了一系列具有π-π共轭结构小分子疏水单元以替代传统高分子胶束中生物降解疏水高分子链的新型高分子胶束,系统揭示了疏水单元结构及药物-载体间的π-π作用对载药胶束性能的影响规律,获得了临界胶束浓度(CMC)比传统高分子胶束低一个数量级、载药量高3倍的高稳定性载药胶束材料。以光动治疗中的光敏剂卟啉为疏水单元,构建了集化疗和光动治疗于一体的具有联合治疗功能的高分子胶束载药系统,实现了肿瘤高效治疗过程中的实时成像。④脂质体是最具临床使用价值的载药递送系统。我们以脂质体的体内长循环及肿瘤细胞器靶向等关键问题为切入点,设计构建了具有pH触发电荷翻转及靶向细胞线粒体的长循环脂质体;发现了其负电荷表面降低了非特异性蛋白吸附而减少蛋白晕(Protein Corona),避免了传统PEG化脂质体重复使用而产生抗体并引发加速血液清除(ABC)的现象,而且由于电荷翻转还大幅度提高了细胞内吞(>8倍);实现了线粒体的有效靶向和药物的高富集,加速了肿瘤耐药细胞的凋亡,提高了抗肿瘤效果,为克服肿瘤治疗中的多药耐药(MDR)这一世界性难题提供了科学基础。
(国家生物医学材料工程技术研究中心顾忠伟)
