榛花粉不同提取物组分抗炎症活性研究
2015-02-25曹思明韩立杰张玲金铁岩
曹思明, 韩立杰, 张玲, 金铁岩,*
( 1.延边大学理学院 化学系, 吉林 延吉 133002; 2.延边大学农学院 食品科学系, 吉林 延吉 133002 )
榛花粉不同提取物组分抗炎症活性研究
曹思明1,韩立杰2,张玲2,金铁岩1,2*
( 1.延边大学理学院 化学系, 吉林 延吉 133002; 2.延边大学农学院 食品科学系, 吉林 延吉 133002 )
摘要:以榛花粉为原材料,得到榛花粉乙醇提取物,然后分别利用不同溶剂对榛花粉乙醇提取物进行提取得到不同组分;将榛花粉不同提取组分对RAW 264.7细胞进行抗炎症实验、PGE2生成实验、诱发胃炎和肝炎的动物实验,实验结果表明:二氯甲烷组分和乙酸乙酯组分都对RAW 264.7细胞中NO和PGE2的生成具有明显的抑制效果,且均存在较高的浓度依存性关系;二氯甲烷组分对胃炎病变部位有一定治疗作用,对肝损伤细胞中的ALT活性的升高具有一定抑制作用. 榛花粉; 乙醇提取物; 抗炎症活性 TS202.1
文献标识码:A
榛花为桦木科(Betulaceae)植物榛和毛榛的雄花,含有蛋白质、维生素、碳水化合物、脂肪等大多数与人体生命活动相关的营养成分,主要生长在我国东北、华北地区,资源丰富[1].研究表明,榛花具有消炎、降血糖、止血等作用[2].目前,针对榛花性质和作用的研究大多集中在抗氧化、降血糖领域,例如:2005年蔡英兰等[3]通过生化检测、免疫组织化学、透射电子显微镜技术等研究方法,观察了榛花在降糖过程中所起到作用,结果表明榛花具有降低糖尿病实验小鼠高血糖的作用.2011年师伟[4]对榛花的抑菌活性及其药学活性进行了研究.2007年高国粉等[5]研究发现榛花中存在大量的黄酮类化合物,并通过邻苯三酚氧化法检测了榛花的抗氧化能力.
榛花花粉作为榛花的雄性生殖细胞,几乎含有榛花全部的营养元素,而对其研究较少;因此,有必要对榛花粉的相关性质进行研究.本文实验选取野生榛花花粉为实验对象,对榛花粉乙醇提取物在不同溶剂下的各个提取组分,进行RAW 264.7细胞的抗炎症实验、PGE2(前列腺素E2)生成实验、诱发胃炎和肝炎的动物实验,并对榛花粉各提取组分的抗炎症活性进行了评价.
1材料与仪器
1.1 实验材料与试剂
长白山野生榛花花粉;乙醇(C2H5OH)、正己烷(n-hexane)、盐酸(HCl)、二氯甲烷(CH2Cl2)、四氯化碳(CCl4)、乙酸乙酯(EtOAc)、正丁醇(BuOH)为AR级,均购于Aladdin试剂公司;二甲亚砜(DMSO)、Griess试剂Sigma公司生产;灭活胚牛血清(FBS)为江苏恩莫阿赛生物技术有限公司生产;细菌脂多糖(LPS)为上海前尘生物科技有限公司生产;乳酸脱氢酶(LDH)为上海酶联生物科技有限公司生产.
1.2 实验仪器
电子天平:B224S型,立特电子(德国)科技公司;旋转蒸发仪:EE-5250型,西安省太康科技集团;分光光度计(紫外):LS576型,美国Bwtek高科技(上海)公司;恒温水浴锅:HS -1型,南京舜异仪器有限公司;恒温摇床:HZ-2411K型,常州市凯航仪器有限公司;CO2培养箱:SHELLAB 2514-2型,北京伯乐有限公司;水平振荡器:MS-l型,德国IKA公司;酶标仪:Sergy型,深圳爱康科技(美国)有限公司;DMEM培养基.
2实验方法
2.1 榛花粉提取物组分的制备
取干燥后的榛花粉1 g加入10 mL体积分数为95%的乙醇溶剂,室温下浸泡12 h后将粗提取物过滤,旋转蒸发除去其中溶剂,得到干燥的榛花粉乙醇提取物.
将干燥好的榛花粉乙醇提取物利用正己烷、二氯甲烷、乙酸乙酯、正丁醇和水5种溶剂分别进行梯度提取,采用超声震荡30 min,过滤并收集滤液,得到榛花粉在不同溶剂中的各个提取组分,低温避光保存,备用.
2.2 榛花粉不同提取物组分抗炎症活性的测定
2.2.1细胞培养根据文献[6-7],将巨噬细胞RAW264.7培养在加入抗生素(青霉素、链霉素)100 units/mL、10%FBS的DMEM培养基中,在37 ℃和5% CO2的条件下续代培养,每3 d 1次.
2.2.2动物实验雄性昆明小鼠,6~8周龄,体质量17~21 g,按照常规方法饲养在塑料笼子中.
2.2.3NO的生成测定在添加10%灭活FBS的DMEM培养基中,将RAW 264.7细胞调节到1.5×105cells/mL,然后接种到细胞培养板上,用榛花粉各个提取组分和LPS(1 μg/mL)同时处理,并培养24 h.由于NO不稳定,它在细胞培养的上清液内会快速代谢生成亚硝酸基(NO2-),因此本实验参考Griess法测定NO2-的浓度,以此作为衡量NO水平的指标[8].具体方法是:将100 μL细胞培养液的上清液和100 μL Griess试剂[2.5%(v/v)磷酸中添加1%(w/v)对氨基苯磺酰胺和0.1%(w/v)N-萘乙二胺盐酸盐]混合,在细胞培养板中反应10 min,然后在540 nm下测定吸光值.
2.2.4细胞毒性测定分别利用榛花粉各个提取组分和LPS(1 μg/mL)同时处理RAW 264.7细胞(1.5×105cells/mL),并在DMEM培养基中培养24 h.在3 000 r/min下离心5 min.对培养上清液中的LDH进行测定,以此评价细胞毒性.LDH测定是利用试剂盒方法进行的,具体方法为:在96孔板离心分离得到的上清液50 μL中加入稀释的WST底物混合物50 μL,在室温中反应30 min.在490 nm波长处测定吸光度,求得各个实验组的平均吸光值,并与对照组(LDH对照,1∶5 000)的吸光度值比较,以此评价不同提取组分对细胞毒性的影响.
2.2.5PGE2的生成评价根据文献[9],利用DMEM培养基将RAW 264.7调节到1.5×105cells/mL后接到24孔板上,并在恒温状态含5% CO2的条件下培养18 h.将培养基去除,对含调到10倍浓度的(1 mg/mL)榛花粉提取组分50 μL和450 μL LPS(1 μg/mL)的新培养基同时进行处理,并在上述相同条件下培养24 h.为测定PGE2,将培养基进行离心分离(12 000 r/min,3 min)获得上清液.用PGE2 ELISA试剂盒测定,R2值大于0.99.
2.2.6C2H5OH/HCl诱发胃炎的动物实验根据文献[10]方法,利用C2H5OH/HCl诱发小鼠胃炎.选取同批次的健康雄性小鼠40只,每组10只.第I组为正常对照组,第II组为模型组,第III组为待测物组,第IV组为阳性对照组.第I、II组灌胃等量生理盐水,第III组口服榛花粉提取物200 mg/kg,第IV组以雷尼替丁(40 mg/kg)灌胃[11],每天2次,持续3 d.榛花粉提取组分在体内剂量的选择根据文献[11]进行,即给予小鼠以50~300 mg/kg的量.在对小鼠最后灌胃30 min以后,除正常对照组外,另外3组均给予口服60% C2H5OH、150 mmol/L的HCl 400 μL.用乙醚麻醉小鼠,将其致死.无菌条件下开腹,结扎幽门部位,并将胃部切除,用流动水冲洗[11]后展开并观察病变部位.
2.2.7CCl4诱发肝炎的动物实验根据文献[12]方法,通过腹腔注射CCl4诱发小鼠肝炎.选取同批次的健康雄性小鼠30只,每组10只.第I组为正常对照组,第II组为肝损伤模型组,第III组为待测物组.第I、II组灌胃等体积生理盐水,第III组口服榛花粉提取组分200 mg/kg,每天1次,持续1周.实验期间,小鼠正常摄食,饮水,鼠笼每天更换垫料.
在对小鼠最后灌胃60 min以后,正常对照组除外,其他组腹腔注射CCl4,乙醚麻醉小鼠,将其致死.将肝脏切除,用流动水冲洗.采血后,对血液进行离心分离,得到血清后按照试剂盒测定丙氨酸氨基转氨酶(ALT)、天冬氨酸转氨酶(AST)的活性.
2.2.8数据分析利用SPSS对实验所得数据进行分析,数值表示均是平均值+标准偏差,P<0.05可以认为具有显著性差异.
3实验结果与讨论
3.1 榛花粉不同提取物组分抗炎症活性评价
3.1.1榛花粉不同提取物组分对RAW 264.7细胞中NO的生成和细胞毒性的影响榛花粉不同提取组分(25 μg/mL)对RAW 264.7细胞中NO的生成和细胞毒性的影响如图1所示.CH2Cl2组分和EtOAc组分比对照组(LPS单独处理)具有更强的NO生成抑制效果;在LDH分析中,CH2Cl2组分表现出60%的细胞毒性.(本文所有图中“*”表示差异显著(P<0.05),“**”表示差异极其显著(P<0.01)).
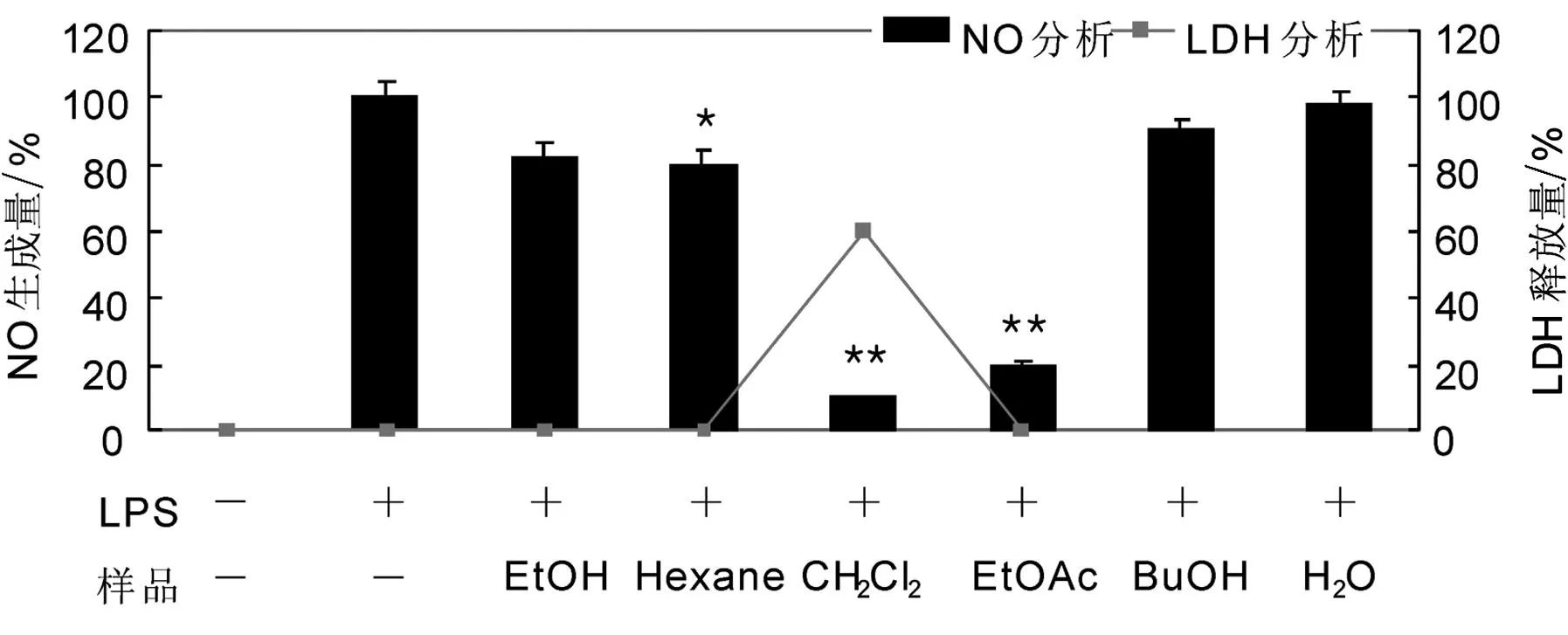
图1 榛花粉各提取组分对RAW 264.7细胞中NO的生成和细胞毒性的影响
榛花粉CH2Cl2提取组分对RAW 264.7细胞中NO生成的影响如图2所示.CH2Cl2组分比对照组(LPS单独处理)表现出更高的浓度依存性(6.25、12.5、25 μg/mL),由此能够确认其对NO生成的抑制效果;CH2Cl2组分在12.5、25 μg/mL浓度下各表现出18%、60%的细胞毒性.

图2 榛花粉CH2Cl2组分对RAW 264.7细胞中NO生成和细胞毒性的影响
榛花粉EtOAc提取组分对RAW 264.7细胞中NO生成的影响如图3所示.EtOAc组分比对照组(LPS单独处理)仍表现出较高的浓度依存性(6.25、12.5、25 μg/mL),并对NO的生成具有明显的抑制效果,但未表现出细胞毒性.

图3 榛花粉EtOAc组分对RAW 264.7细胞中NO生成和细胞毒性的影响
3.1.2榛花粉不同提取组分对RAW 264.7细胞中PGE2生成的影响榛花粉不同提取组分对RAW 264.7细胞中PGE2生成的影响如图4所示.CH2Cl2组分和EtOAc组分比对照组(LPS单独处理)对PGE2的生成具有更强的抑制效果.

图4 榛花粉各提取物对RAW 264.7细胞中PGE2生成的影响
榛花粉CH2Cl2提取组分对PGE2生成的抑制效果如图5所示.CH2Cl2组分相比对照组(LPS单独处理)表现出更高的浓度依存性(6.25、12.5、25 μg/mL),由此可确认其对PGE2的生成具有明显抑制作用.

图5 榛花粉CH2Cl2组分对RAW 264.7细胞中PGE2生成的影响
榛花粉EtOAc提取组分对PGE2生成的影响如图6所示.EtOAc组分相比对照组表现出更高的浓度依存性,且同样可确认其对PGE2的生成具有显著的抑制效果.

图6 榛花粉EtOAc组分对RAW 264.7细胞中PGE2生成量的影响
3.1.3动物实验结果利用C2H5OH/HCl对实验性小鼠进行诱发胃炎的实验结果如图7所示.由图7可知,榛花粉提取物对病变部位有较好的减轻效果,但不如雷尼替丁明显.

图7 榛花粉提取组分对小鼠胃炎病变的影响
CCL4能对肝脏造成严重损害,其主要作用机制是四氯化碳在机体内部的活性代谢和直接的膜溶解作用,引起胞浆内Ca2+浓度上升,造成肝细胞受损[13].榛花粉提取物对小鼠血清中AST和ALT测定结果如图8所示.
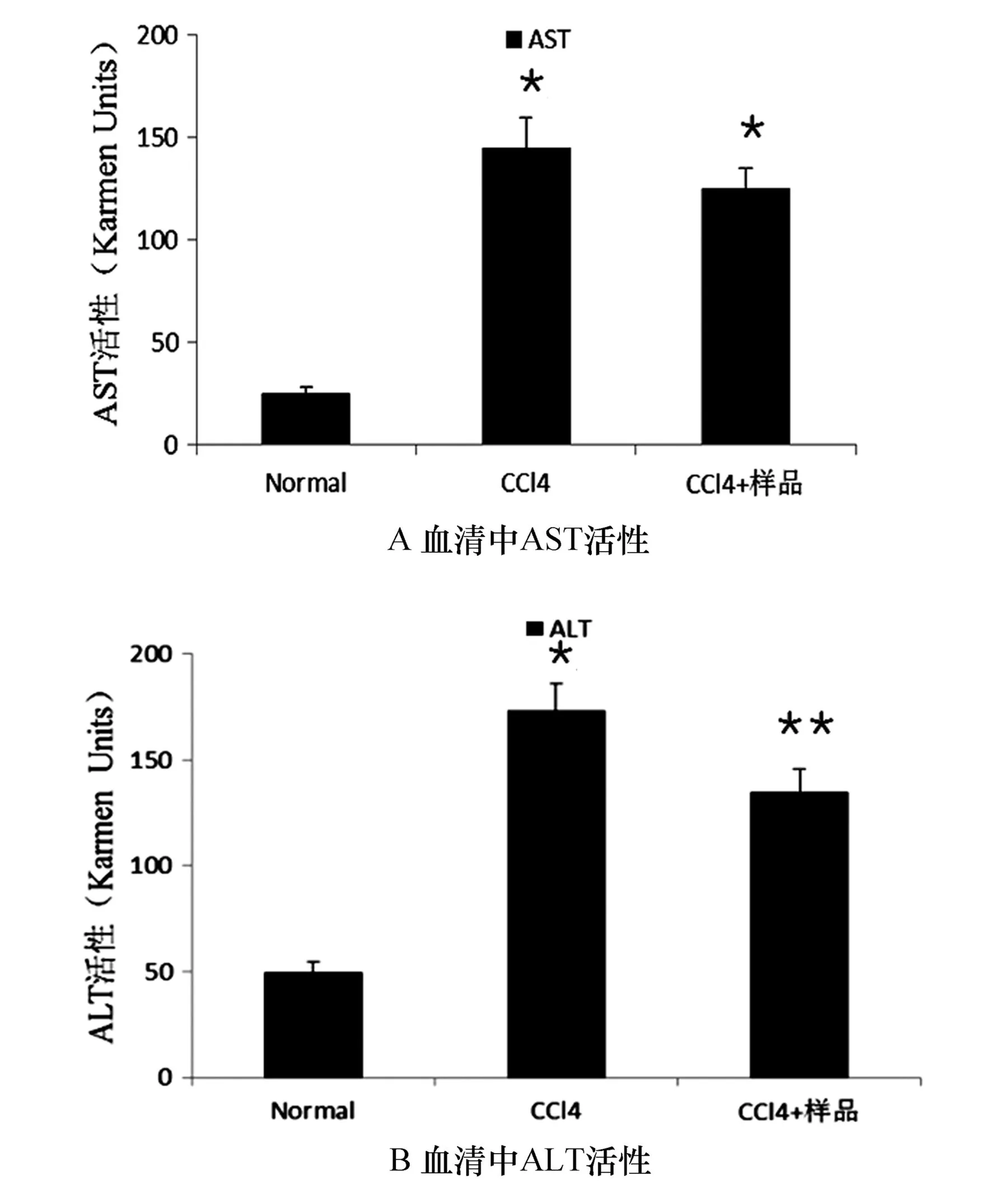
图8 榛花粉提取物对小鼠血清中AST和ALT活性的影响
正常肝细胞中的AST和ALT不能被释放到血液中,但是,当肝细胞受到损伤时,血液中AST和ALT的活性增加[14-15],其中ALT反应灵敏性优于AST.由图8可以看出,AST和ALT的活性有显著提高(P<0.05).相比较而言,榛花粉提取物能抑制血清中ALT活性的升高(P<0.05),但对AST活性的抑制不是非常明显.
4结论
对榛花粉各个提取组分进行了抗炎症活性实验,结果表明:各提取物组分对NO和PGE2的生成有明显抑制效果,且无细胞毒性;提取物组分对胃炎病变部位有较好的减轻效果,各提取物组分能明显抑制小鼠血清中ALT的活性,对肝脏有一定的保护作用.从实验结果推测,榛花粉中存在着某些活性化学成分,对治疗炎症可能具有很好的治疗功能.
参考文献:
[1]刘新成,孙佳明,白路,等.榛花化学成分研究[J].中国现代医药,2013,15(11):940-942.
[2]南京中医药大学.中药大辞典:下册[M].上海:上海科技技术出版社,2006:3561.
[3]蔡英兰,金政,金香子,等.榛花对糖尿病小鼠降糖作用及对肝脏和胰岛病理学影响[J].辽宁中医杂志,2005,32(12):1324-1326
[4]师伟.榛花中抑制金黄色葡萄球菌化合物的筛选及抑菌机制的研究[D].沈阳:辽宁师范大学,2011:26-47
[5]高国粉,衰利佳,刘仙,等.榛花总黄酮的提取及抗氧化活性的研究[J].中华中医药杂志,2007,8:547-549.
[6]Limsuwan S, Hesseling-Meinders A, Voravuthikunchai S P, et al. Potential antibiotic and anti-infective effects of rhodomyrtone fromRhodomyrtustomentosa(Aiton) Hassk.on Streptococcus pyogenes as revealed by proteomics[J]. Phytomedicine, 2011,18(11):934-940.
[7]黄桂东,钟先锋,吴龙奇,等.共轭亚油酸混合物对人结肠癌细胞(Caco-2)的抑制作用[J].食品与机械,2007,23(4):49-51.
[8]Jeong D, Yang W S, Yang Y, et al. In vitro and in vivo anti-inflammatory effect of Rhodomyrtus tomentosa methanol extract[J]. Journal of Ethnopharmacology, 2013,146(1):205-213.
[9]Yang Y, Yu T, Jang H J, et al. In vitro and in vivo anti-inflammatory activities of Polygonum hydropiper methanol extract[J]. Journal of Ethnopharmacology, 2011,139(2):616-625.
[10]Lee S J, Park J Y, Choi K S, et al. Efficacy of Korean red ginseng supplementation on eradication rate and gastric volatile sulfur compound levels afterHelicobacterpylorieradication therapy[J]. Journal of Ginseng Research, 2010,34(2):122-131.
[11]Abu-Ghefreh A A, Canatan H, Ezeamuzie C I. In vitro and in vivo anti-inflammatory effects of andrographolide[J]. International Immunopharmacology, 2009,9(3):313-318.
[12]Cho J Y, Yeon J D, Kim J Y, et al. Hepatoprotection by human epidermal growth factor (hEGF) against experimental hepatitis induced by D-galactosamine (D-galN) or D-GalN/lipopolysaccharide[J]. Biological & Pharmaceutical Bulletin, 2000,23(10):1243-1246.
[13]刘建文.药理实验方法学:新技术与新方法[M].北京:化学工业出版社,2008.
[14]Palmes D, Spiegel HU. Animal models of liver regeneration[J]. Biomaterials, 2004,25(9):1601-1611.
[15]齐志宏.天门冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)37 ℃参考测定程序的建立及其临床应用[D].北京:中国协和医科大学,2006.
Research of anti-inflammatory activity for difference Hazel pollen extracts
CAO Siming1,HAN Lijie2,ZHANG Ling2,JIN Tieyan1,2*
( 1.DepartmentofChemistry,CollegeofScience,YanbianUniversity,Yanji133002,China;
2.DepartmentofFoodScience,CollegeofAgriculture,YanbianUniversity,Yanji133002,China)
Abstract:We used Hazel pollen as raw material, obtained Hazel pollen ethanol extract, then using different solvents to extract them to get different components which were checked with RAW 264.7 cells anti-inflammatory, PGE2, induced gastritis and hepatitis animal. The results show that methylene chloride and ethyl acetate extracted components have significant inhibitory effect on generation of NO and PGE2 of RAW 264.7 cells and higher concentration dependence relationship; Methylene chloride extracted component has the rapeutic effect on gastritis lesions and can reduce elevated ALT activity in injured liver cells with a certain extent.
Key words:Hazel pollen; ethanol extract; anti-inflammatory activity
文章编号:1004-4353(2015)04-0326-05
*通信作者:金铁岩(1968—),男,博士,副教授,研究方向为功能性食品.
收稿日期:2015-11-07
