Glucobacteroxydans全细胞直接催化秸秆稀酸预处理水解液产木糖酸
2015-02-24麻艺聪缪园园余世袁
麻艺聪, 周 鑫,2, 缪园园,2, 徐 勇, 勇 强,2, 余世袁,2
(1.南京林业大学 化学工程学院, 江苏 南京 210037; 2.江苏省生物质绿色燃料与化学品重点实验室, 江苏 南京 210037)
·研究报告——生物质化学品·
Glucobacteroxydans全细胞直接催化秸秆稀酸预处理水解液产木糖酸
麻艺聪1, 周 鑫1,2, 缪园园1,2, 徐 勇, 勇 强1,2, 余世袁1,2
(1.南京林业大学 化学工程学院, 江苏 南京 210037; 2.江苏省生物质绿色燃料与化学品重点实验室, 江苏 南京 210037)
以长期驯化选育得到的耐抑制物氧化葡萄糖酸杆菌GlucobacteroxydansNL71为催化菌株,对全细胞直接催化木质纤维(麦秆)稀酸预处理水解液产木糖酸的工艺进行研究。结果表明:未脱毒水解液对催化反应生产木糖酸具有抑制作用,且随浓度提高,抑制作用增强。提高细胞浓度和提高供氧能力可以有效抵抗麦杆稀水解液的抑制效应。在摇瓶体系中以2 g/L细胞接种量直接催化未经脱毒的麦秆稀酸水解浓缩液,当初始木糖质量浓度超过100 g/L时,细胞的催化性能受到严重抑制,木糖酸得率均低于50%;当细胞接种量提升至8 g/L时,木糖酸得率可以达到85.7%;在机械搅拌式通氧加压反应体系中,采用密封加氧技术对100 g/L木糖浓度的麦秸稀酸水解浓缩液全细胞催化24 h的细胞接种量8 g/L,木糖酸终质量浓度达到103.1 g/L,木糖酸得率可达到93.1%,产生速率为摇瓶体系的1.6倍。
木糖酸;木糖;全细胞催化;氧化葡萄糖酸杆菌;麦秆水解液
植物纤维素资源中可利用的糖类主要是纤维素和半纤维素,其中以纤维素为原料的葡萄糖发酵工业相对成熟。然而,植物纤维中以木糖为主的半纤维素约占20%~35%,其高效转化与利用则成为整个生物炼制系统的关键性技术瓶颈之一[1-5]。近年来,木糖酸作为植物纤维资源木糖高效生物转化利用的新兴产品具有广阔的工业应用潜力[6-9],被美国能源部确定为植物纤维资源生物质炼制最具发展前途的30种目标产品或化工基本构件单元之一。Zhou等[10]利用长期驯化选育的菌株葡萄糖酸杆菌(Gluconobacteroxydans) NL71优良的生产性能,在富含D-木糖经CaCO3或Ca(OH)2中和吸附脱毒后的玉米秸秆稀酸预处理浓缩液中,直接采用全细胞催化转化生产木糖酸,产量可达到143.9 g/L。Buchert等[11]研究表明G.oxydans可催化经脱毒后玉米秸秆稀酸水解液中100 g/L木糖转化为88 g/L木糖酸。Zhou等[10]对G.oxydans在摇瓶体系单一木糖催化生产木糖酸,得率可达98%以上,因此认为利用氧化葡萄糖杆菌直接以半纤维素水解液为底物催化生产木糖酸具有较好前景。本研究以小麦秸秆稀酸预处理水解浓缩液为原料,以NaOH替代CaCO3作为中和剂保留所有的抑制物阴离子,对G.oxydansNL71全细胞直接催化制取木糖酸的生产工艺进行优化,期望为麦秆木糖的高效生物转化与利用提供借鉴和指导。
1 实 验
1.1 原料、试剂及仪器
小麦秆,来自江苏连云港。NaOH、山梨醇、硫酸、硫酸镁、磷酸二氢钾、磷酸氢二钾和硫酸铵,均为分析纯;酵母粉为生化级。
Agilent 1260液相色谱,美国安捷伦公司;ICS-5000离子色谱,美国赛默公司;Ledend Mach 1.6R型离心机,美国赛默公司;Spectrumlab 752s紫外可见分光光度计;BioFlo®/CelliGen®115发酵罐,美国新布朗什维克科学公司;FB6410火焰光度计,上海精科有限公司。
1.2 菌种及培养基
氧化葡萄糖酸杆菌(G.oxydans)NL71,经南京林业大学在木质纤维水解液长期驯化选育后保藏。
活化培养基(g/L):山梨醇50,酵母粉5。摇瓶及发酵罐水解液培养基(g/L):MgSO4·7H2O 0.5,KH2PO41,K2HPO4·3H2O 2,(NH4)2SO45,酵母粉5[5]。
1.3 麦秆水解液全细胞催化
1.3.1 麦秆稀酸预处理水解液制备 称取一定质量的麦秆(直径1~3 cm)按固液比为1 ∶10(g ∶mL)加入质量分数为1.0%的硫酸浸泡过夜,置于蒸煮反应器中,在150 ℃的条件下反应30 min[9],取出物料后经磨浆、过滤得滤液即为麦秆稀酸预处理水解液。
1.3.2 不同初始浓度麦秆水解液的全细胞催化 麦秆稀酸预处理水解液经减压真空浓缩至木糖质量浓度分别为60.2、 73.6、 89.2、 100.9、 121.7、 139.7、 164.5和179.3 g/L,并以30% 的NaOH溶液调至pH值6.0。在250 mL三角摇瓶中加入50 mL水解液并按2 g/L菌体接入量加入活化后的G.oxydansNL71细胞,于30 ℃和220 r/min条件下催化反应96 h,每6 h检测并加入30%的NaOH溶液维持pH值6.0。
1.3.3 不同细胞浓度的全细胞催化 麦秆稀酸预处理水解液经减压真空浓缩至木糖质量浓度100 g/L,以30% NaOH溶液中和至pH值6.0,在250 mL三角摇瓶加入50 mL水解液并分别加入2、4 和8 g/L活化后的G.oxydansNL71细胞,于30 ℃和220 r/min条件下催化反应96 h,每6 h检测并加入30%的NaOH溶液维持pH值6.0。
1.3.4 机械搅拌通氧加压全细胞催化 麦秆稀酸预处理水解液经减压真空浓缩至木糖质量浓度100 g/L,以30%NaOH溶液调至pH值6.0,在机械搅拌反应体系加入1 L麦秆稀酸水解液并按8 g/L菌体接入量加入活化后的G.oxydansNL71细胞,于30 ℃和500 r/min条件下采取通氧加压方式催化反应24 h,使用30%的NaOH溶液在线调节pH值6.0。
1.4 分析检测及计算方法
1.4.1 糖及糖酸的色谱分析检测[8]采用离子色谱分析。色谱柱,CarboPacTMPA10(2 mm × 250 mm);柱温30 ℃;流动相采用0.2 moL/L NaOH溶液梯度洗脱,流速0.3 mL/min,四电位脉冲安培检测器(PAD)以外标法检测;进样量10 μL。糖利用率=消耗糖含量×100%/初始糖含量;己糖酸(半乳糖酸、葡萄糖酸和甘露糖酸)得率=己糖酸含量×100%/(己糖含量×1.089);戊糖酸(阿拉伯糖酸和木糖酸)得率=戊糖酸含量×100%/(戊糖含量×1.107);糖酸产生速率=糖酸含量×100%/催化反应时间。
1.4.2 抑制物的色谱分析检测 采用液相色谱分析抑制物甲酸、乙酸及乙酰丙酸。色谱柱,Aminex Bio-Rad HPX-87H;流动相5 mmol/L H2SO4,流速0.6 mL/min;柱温55 ℃;示差折光检测器温度30 ℃;进样量10 μL。
1.4.3 菌体浓度的测定 采用比浊法,取全细胞催化水解液经8 000 r/min离心5 min后再以0.9%生理盐水重复洗涤2遍,稀释至一定浓度后在0.5 cm光径的比色皿中测定600 nm处的吸光度值,即为菌体浓度(OD600)。
1.4.4 钠离子浓度测定 采用火焰光度法按照按罗马金公式进行定量分析,取全细胞催化水解液经8 000 r/min离心5 min后由0.22 μm滤膜过滤,稀释1 000倍,再经雾化器将试液雾化通过光电系统测量。
2 结果与讨论
2.1 麦秆稀酸水解液成分
麦秆经过稀酸水解预处理并经过过滤得到麦秆稀酸水解液,其主要成分如下:木糖26.82 g/L,葡萄糖6.02 g/L,阿拉伯糖4.69 g/L,半乳糖2.63 g/L,纤维二糖2.11 g/L,甲酸1.17 g/L,乙酸2.89 g/L,乙酰丙酸0.12 g/L。由数据可以看出在稀酸预处理液中,主要成分为木聚糖的降解产物木糖;此外木聚糖侧链基团阿拉伯糖基在高温下降解而释放的阿拉伯糖,少量纤维素在高温酸性条件下降解成纤维二糖和葡萄糖[9];降解生成的糖类物质以及木质素降解的多种单环芳香族化合物在高温或酸的作用下还会进一步发生分解和氧化反应,产生有机酸(甲酸、乙酸和少量的乙酰丙酸)、醛类(糠醛、羟甲基糠醛)及芳香族化合物等对微生物生长和代谢具有抑制作用的副产物。这些副产物通过抑制微生物的有氧呼吸、增加细胞膜的透性、破坏酶活性等抑制微生物菌体生长和产物生成,甚至具有致死毒性[12]。
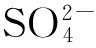
2.2 初始木糖浓度对全细胞催化的影响
为了测试未经任何脱毒处理的麦秆稀酸水解液浓度对全细胞催化的影响,选取了不同浓度的麦秆水解液进行实验,实验结果如表1所示。当麦秆水解液木糖质量浓度在60~80 g/L之间时,木糖利用率高于90%,木糖酸得率在70%左右。然而,当麦秆水解液浓缩木糖质量浓度达100 g/L时,全细胞催化明显受到抑制,产生的木糖酸质量浓度36.5 g/L,残余木糖质量浓度57.1 g/L,木糖酸得率仅32.7%。当浓缩木糖质量浓度超过120 g/L,细胞催化几乎难以维系。
尽管木质纤维素预水解液中的木糖占总糖的70%以上,但是除此之外其中还含有其它多种单糖、低聚糖和抑制物组分,它们对微生物的木糖代谢存在着如糖底物竞争效应、膜蛋白与通透性改变、酶活力抑制、关键酶与蛋白质基因的表达调控、细胞生长和遗传等多方面的影响,并且还可能与发酵工艺条件形成复杂的交互效应,最终限制木糖的代谢和木糖酸的产出,并且该抑制效应在细菌发酵过程中的表现更加突出[14]。实验结果表明,即使在低浓度的水解液中的糖酸催化生产性能也会受到严重抑制,此时即使木糖被完全代谢木糖酸的得率仍低于70%,换言之消耗的木糖并未完全转化为木糖酸。此外,伴随着秸秆水解液浓度的增加木糖酸得率明显下降。基于G.oxydans的细胞代谢特征,分析认为:在低浓度麦秆稀酸水解液中,G.oxydans可能会通过Dahms途径消耗部分木糖或木糖酸[15],用以维持细胞生长或碳骨架分解以抵御抑制物的抑制作用;而随着秸秆水解液浓度增加抑制物含量也随之增加,最终使得G.oxydans的细胞活性被严重抑制,仅能够在细胞催化初期利用细胞膜上原有的木糖脱氢酶,表现出对木糖的基本催化能力,仅有木糖酸产出且得率低于10%。
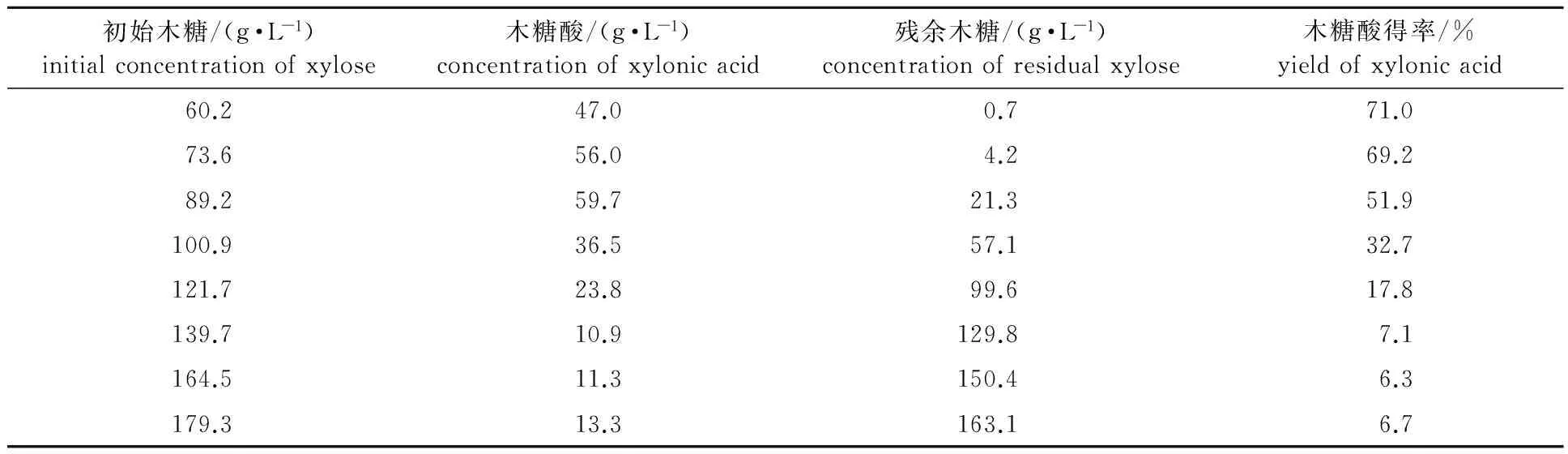
表1 不同初始木质纤维水解液质量浓度催化反应结果对比
2.3 细胞浓度对全细胞催化的影响
在微生物发酵过程中采用高接种量可以缩短菌体调整适应期,使产物生成高峰提前,并可减少杂菌污染风险。同时,利用生物的种群体密度及感应效应(如种内互助)还可以有效消减抑制效应,提高微生物转化生产性能。在含100 g/L木糖的麦秆水解液中分别加入2、 4和8 g/L 的G.oxydans细胞催化反应96 h,以考察高浓度细胞接入是否能改变高浓度水解液对全细胞催化的抑制作用,结果如图1所示。
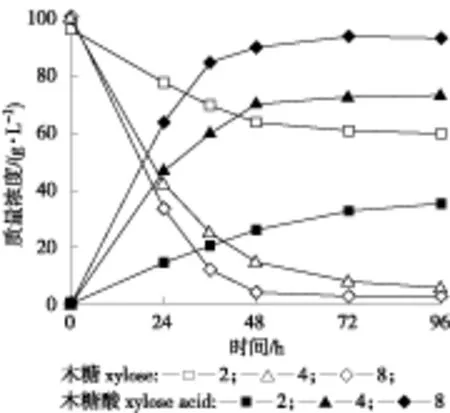
图1 不同细胞浓度对全细胞催化的影响
结果表明,当接种量为2、4和8 g/L时,催化反应96 h产生的木糖酸质量浓度分别为36.5、 73.3和94.9 g/L。相比于接种量为2 g/L,当接种量为4 和8 g/L时木糖酸的产量分别提高了约1倍和1.6倍。由数据可知随接种量的增大,木糖酸产生速率也随之加快,48 h接种量8 g/L时木糖酸得率85.7%,产生速率为1.98 g/(L ·h),相对于2和4 g/L接种量产生速率提高了约1.6倍与0.3倍。分析认为,菌体细胞本身对抑制物(如:醛类、酚类及芳香族化合物)具有一定吸附或氧化能力[16],因而通过提高G.oxydans菌体细胞接入量能够消减抑制物对菌体的毒性及提高细胞对钠盐的耐受性从而提高细胞的催化性能。
2.4 通氧加压对全细胞催化性能的影响
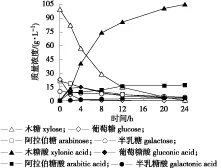
图2 通氧加压条件下,麦秆水解液全细胞催化反应历程
G.oxydans属于严格好氧菌,在全细胞催化过程中需要高通风量提供充足的氧以用于完成氧化反应,而木质纤维素水解液通常除了含有多种糖类,还含有许多胶质、有机氮源、脂质及木质素等复杂化合物,在通风条件下极易产生泡沫造成传氧阻力、料液逸罐和杂菌污染等问题,需要添加大量的消泡剂;另外,木糖转化为木糖酸时会迅速降低培养体系的pH值并最终抑制细胞的催化反应,因此在工业生产中必须建立实时在线的中和技术。为解决上述关键性障碍,徐勇等[17]提出一种通氧加压全细胞催化体系,即用高纯度的氧气加压的专利技术代替空气直接通入密封的全细胞反应体系,在此反应体系中,并采用CaCO3进行在线中和,首次实现了木质纤维水解液的特高浓度的高效转化[10],但是在反应过程中CaCO3中和木糖酸所生成的CO2仍然需要定期排放操作。利用该技术原理,以NaOH溶液替代 CaCO3作为木糖酸的中和剂,期望能够解决CO2的定期排放操作不便的问题。在3 L密封加氧的机械搅拌式反应器中,以含100 g/L木糖的麦秆稀酸水解液为原料接入8 g/LG.oxydans菌体,使用30% NaOH溶液在线调控pH值6.0得到的木糖酸全细胞催化反应历程如图2所示。结果表明:在一定的木糖浓度范围内,完全可以采用NaOH溶液替代 CaCO3作为木糖全细胞催化产木糖酸的中和剂,避免了CaCO3中和的CO2废气生成与排放问题,显著简化了生产操作。尽管麦秆水解液钠离子质量浓度超过20 g/L,由表2可看出只需反应24 h木糖利用率就可以接近100%。
表2给出了机械搅拌体系反应24 h的结果及其与摇瓶体系结果的对比,由表2可知,在机械搅拌体系中产生的木糖酸质量浓度为103.1 g/L,对应的产品得率达93.1%,产生速率达到4.29 g/(L ·h),同比为摇瓶反应体系的1.6倍。于此同时,G.oxydans细胞也能够同步催化氧化阿拉伯糖和半乳糖生成相应的糖酸(钠)。由此可见,与摇瓶体系相比,采用通氧加压反应体系可以大幅度提高溶解氧水平从而促进细胞呼吸作用及提高氧化酶的催化反应动力学,最终使G.oxydans细胞成功克服木质纤维水解液中复杂抑制效应,实现木质纤维原料稀酸水解液中包括木糖在内的阿拉伯糖、半乳糖等半纤维素糖类组成的糖酸转化。通过半纤维素糖类的全细胞共催化生产多糖酸产品,进而带动和实现原料中半纤维素的分类高效生物转化与利用,整体提升木质纤维资源生物炼制的原料全值化利用水平及经济效益。

表2 摇瓶及机械搅拌体系催化反应24 h结果对比
3 结 论
3.1 通过对不同初始浓度水解液G.oxydans催化性能的研究,表明未脱毒水解液对催化反应生产木糖酸具有抑制作用,且随浓度提高,抑制作用增强。
3.2 提高细胞接入量可以提高G.oxydans细胞对抑制物的拮抗效应及对钠盐的耐受性从而提高了细胞催化水平及木糖酸产量。采用8 g/L的G.oxydans直接催化含100 g/L木糖的麦秆稀酸水解浓缩液,48 h时木糖酸得率可达到85.7%,产生速率1.98 g/(L ·h)。
3.3 利用机械搅拌通氧加压与高细胞浓度相结合的全细胞催化技术可以进一步显著提高木糖酸的得率,并且可以实现NaOH在线中和技术以避免加入CaCO3中和而造成的CO2排放问题。采用8 g/L的G.oxydans细胞直接催化100 g/L麦秆水解液24 h的木糖酸得率为93.1%,产生速率达到4.29 g/(L ·h),为摇瓶体系的1.6倍。
[1]GALLEZOT P.Conversion of biomass to selected chemical products[J].Chemical Society Reviews,2012,41(4):1538-1558.
[2]STEEN E J,KANG Y,BOKINSKY G,et al.Microbial production of fatty-acid-derived fuels and chemicals from plant biomass[J].Nature,2010,463(7280):559-562.
[4]KNAUF M,MONIRUZZAMAN M.Lignocellulosic biomass processing:A perspective[J].International Sugar Journal,2004,106(1263):147-150.
[5]BUCHERT J,VIIKARI L.The role of xylonolactone in xylonic acid production byPseudomonasfragi[J].Applied Microbiology and Biotechnology,1988,27(4):333-336.
[6]GUPTA A,SINGH V K,QAZI G N,et al.Gluconobacteroxydans:Its biotechnological applications[J].Journal of Molecular Microbiology and Biotechnology,2001,3(3):445-456.
[7]BUCHERT J,PULS K,POUTANEN.Comparison ofPseudomonasfragiandGluconobacteroxydansfor production of xylonic acid from hemicellulose hydrolyzates[J].Applied Microbiology and Biotechnology,1988,28(4/5):367-372.
[8]WANG Xing,XU Yong,LIAN Zhi-la,et al.A one-step method for the simultaneous determination of five wood monosaccharides and the corresponding aldonic acids in fermentation broth using high-performance anion-exchange chromatography coupled with a pulsed amperometric detector[J].Journal of wood Chemistry and Technology,2014,34(1):67-76.
[9]陈尚钘,勇强,徐勇,等.玉米秸秆稀酸预处理的研究[J].林产化学与工业,2009,29(2):27-32.
[10]ZHOU Xin,LÜ Shan-shan,XU Yong,et al.Improving the performance of cell biocatalysis and the productivity of xylonic acid using a compressed oxygen supply[J].Biochemical Engineering Journal,2015,93(1):196-199.
[12]SANDERSON K.Lignocellulose:A chewy problem[J].Nature,2011,474(7352):12-14.
[13]姚嘉曼,姜岷,吴昊,等.稀酸水解玉米芯制备丁二酸[J].生物加工过程,2010,8(3):66-72.
[14]徐勇,王荥,朱均均,等.木糖高效生物转化的新出路[J].中国生物工程杂志,2012,32(5):113-119.
[15]ZHANG Min-hua,WEI Liu-jing,ZHOU Yi,et al.Genetic analysis of D-xylose metabolism pathways inGluconobacteroxydans621H[J].Journal of Industrial Microbiology and Biotechnology,2013,40(3):379-388.
[16]朱均均,杨金龙,张玲玲,等.稀酸蒸汽爆破玉米秸秆预水解液的脱毒及乙醇发酵[J].林产化学与工业,2014,34(5):60-66.
[17]徐勇,周鑫,李振荣,等.一种通氧加压的木糖全细胞催化生产木糖酸的方法:中国,201310167758.X[P].2013-07-24.
Production of Xylonic Acid from Dilute Sulfuric Acid Hydrolysates of Wheat Straw with Whole-cell Catalysis ofGlucobacteroxydans
MA Yi-cong1, ZHOU Xin1,2, MIAO Yuan-yuan1,2, XU Yong1,2, YONG Qiang1,2, YU Shi-yuan1,2
(1.College of Chemical Engineering,Nanjing Forestry University, Nanjing 210037, China; 2.Jiangsu Key Laboratory of Biomass-based Green Fuels and Chemicals,Nanjing Forestry University, Nanjing 210037, China)
The production of xylonic acid from hydrolysates of straw by whole-cell catalysis was investigated with long-term domesticatedGluconobacteroxydansas catalytic strain.The results showed that the catalytic reaction could be inhibited by hydrolysates without detoxication,and the inhibitory effect was more obvious with the increase of concentration.However,it could be counteracted by increasing inoculation quantity and dissolved oxygen.In the shake flask system,with the inoculation amount of 2 g/L and the xylose concentration of hydrolysates more than 100 g/L,the performance of cell catalysis was inhibited seriously,and the yield of xylonic acid and utilization rate of xylose were all lower than 50%.When the inoculation amount increased to 8 g/L,the yield of xylonic acid reached 85.7%.The method of compressed oxygen supply in the sealed aerated stirred tank reactor was investigated,and in 24 h the concentration and yield of xylonic acid reached 103.1 g/L and 93.1%,respectively.And the production rate increased 1.6 folds compared with that of the shaker system when xylose concentration of hydrolysates was 100 g/L and inoculation amount ofG.oxydanswas 8 g/L.
xylonic acid;xylose;whole cell catalysis;Glucobateroxydans;straw hydrolysates
10.3969/j.issn.1673-5854.2015.02.005
2015- 01- 16
国家自然科学基金资助项目(31370573);国家863计划资助(2012AA022304);江苏研究生创新课题(KYLX_0880) 作者简介:麻艺聪(1993—),陕西渭南人,本科生,研究方向:植物纤维资源生物炼制
TQ35
A
1673-5854(2015)02- 0021- 06
*通讯作者:徐 勇,教授,博士生导师,研究领域:植物纤维资源生物炼制;E-mail:xuyong@njfu.edu.cn。
