鲍曼不动杆菌耐药性诊断分析
2015-02-24张华,贾宁
鲍曼不动杆菌耐药性诊断分析
张华1,贾宁2
(1.首都医科大学大兴医院 检验科,北京102600;2.中国人民解放军总医院 感染管理与疾病控制科,北京100853)
不动杆菌是一种不发酵糖类、无法运动、其氧化酶为阴性的革兰阴性杆菌[1]。检测发现其在自然界以及医疗环境中分布广泛,最常见的为鲍曼不动杆菌(Acinctobactcr Baumanii),仅次于铜绿假单孢菌,其阳性检出率位于非发酵菌中的第二位[2]。由于鲍曼不动杆菌能够存活于大多数生态环境中,且易获得多重耐药,由其引起的院内感染呈逐年不断上升的趋势[3]。当免疫功能低下的病人获得鲍曼不动杆菌侵袭时,可造成肺炎、伤口及尿路感染、腹膜炎等严重甚至是致命性的感染[4]。本研究现回顾性分析我院检验科2012年3月-2014年6月分离的653株鲍曼不动杆菌的耐药性诊断结果,为我院预防鲍曼不动杆菌所致感染提供数据参考,现报道如下。
1资料和方法
1.1 菌株来源
抽选我院2012年3月-2014年6月送至检验室的各临床标本,分离653株鲍曼不动杆菌。标本主要为痰液、分泌物、胸腹水、全血、咽拭子、脓液及尿液等。
1.2 仪器和试剂
采用法国VITEK2 COMPACT全自动细菌分析仪,采用M—H细菌分离培养基。药敏纸片主要有阿米卡星、头孢他啶、环丙沙星、多黏菌素E、氨苄西林—舒巴坦、头孢吡肟、庆大霉素、亚胺及美罗培南、哌拉及替卡西林、替卡西林—克拉维酸、妥布霉素、复力新诺明、哌拉西林—他唑巴坦等。
1.3 细菌鉴定与药敏试验
1.3.1将标本接种于已经配置好的基础培养基上,放置在温度为35℃的普通孵箱和8%CO2孵箱中进行18-24 h的孵育,然后取出细菌鉴定。
1.3.2采用0.9%的生理盐水将纯菌落制成0.5麦氏单位的菌悬液,采用法国VITEK2 COMPACT全自动细菌分析仪鉴定菌种,再与革兰染色、菌落形态以及氧化酶等结果结合进行综合考虑,鉴定为鲍曼不动杆菌(Acinctobactcr Baumanii),铜绿假单胞菌ATCC27853和大肠埃希菌ATCC25922为质控菌株。
1.3.4采用无菌棉拭子蘸取上述已配置好的菌悬液,在试管壁上进行数次挤压,以便能够挤去多余菌液,然后将其涂布于整个M-H培养基的平板上,重复两次,注意每次涂布时将平板旋转60度,使平板能涂布均匀,最后涂布平板四周边缘。将涂有菌液的平板置于室温下进行3-5 min的干燥,等水分吸干后,然后夹取药敏纸片贴于平板表面,注意严格无菌操作,然后用镊尖轻压药敏纸片使其充分平贴于琼脂表面上,每张药敏纸片所使用的镊子在操作完成后要进行常规消毒灭菌,以防发生污染。每张药敏纸片的间距需≧24 mm,中心和平板边缘的距离应>15 mm,直径为90 mm的平板所贴药敏纸片不超过6张。反转已经贴好纸片的平板,然后放于35℃的普通孵箱进行18-24 h的孵育,最后量取每一个纸片的抑菌圈直径。药敏结果参照美国临床实验室标准化协会(CLSI)[5,6]的规定进行判断,耐药为(R)。
1.4 统计学方法
根据CLSI(2009年)版指南文件判读药敏试验结果,采用SPSS13.0软件统计分析,计量资料以n%表示,采用χ2检验,P<0.05,差异有统计学意义。
2结果
2.1 653株鲍曼不动杆菌的标本来源
从鲍曼不动杆菌的标本来源看,痰液及咽试子比例较高,详见表1。
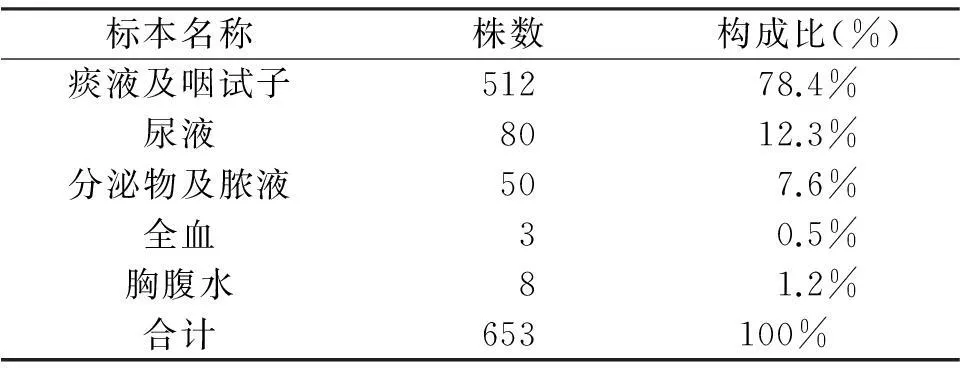
表1 鲍曼不动杆菌的标本来源[n(%)]
2.2 鲍曼不动杆菌的感染科室分布
从鲍曼不动杆菌的感染科室分布来看,以ICU和呼吸内科的检出较多,其他科室检出率各不同,详见表2。
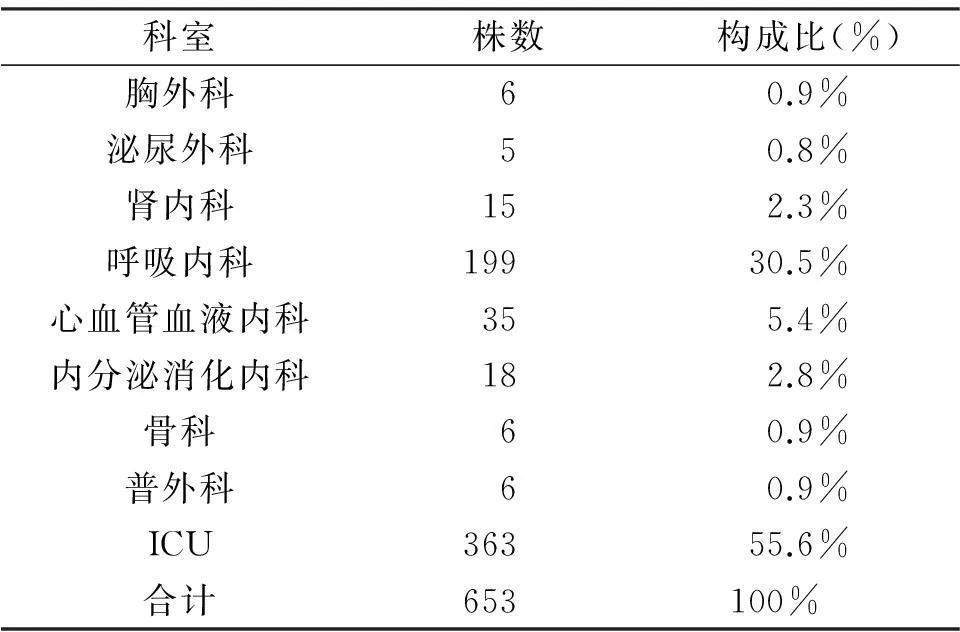
表2 鲍曼不动杆菌的感染科室分布[n(%)]
2.3 鲍曼不动杆菌的耐药性分析
鲍曼不动杆菌对多数抗菌药物呈现耐药趋势,对多黏菌素E较为敏感,详见表3。
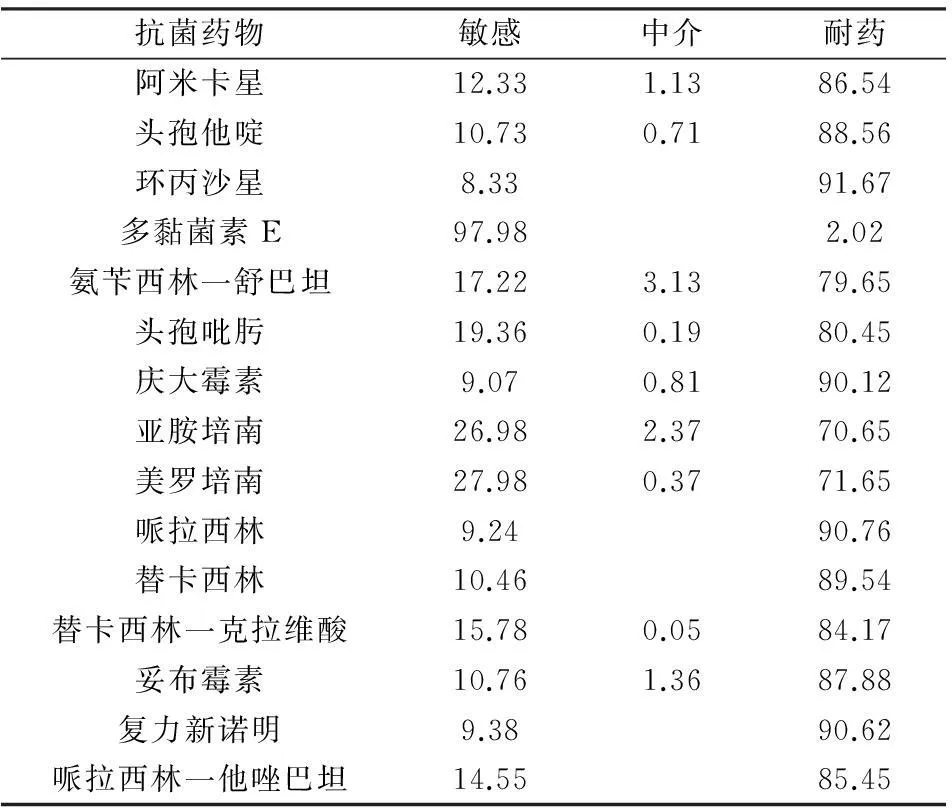
表3 鲍曼不动杆菌的耐药性分析[n(%)]
3讨论
鲍曼不动杆菌可引起患者全身多部位多系统感染。本研究检测结果显示,在分离出的653株鲍曼不动杆菌中,标本来源以痰液及咽拭子构成比最高(78.4%),提示该菌主要引起呼吸道感染,临床应加强环境消毒、呼吸系统感染的控制。本研究表2还显示,分离的653株鲍曼不动杆菌中,感染科室中,以ICU(55.6%)和呼吸内科(21.9%)为主,符合相关报道。原因可能与这些科室的病人大多数病情危重、免疫功能低下、侵袭性操作较多,再加上长时间的住院时间,各种抗菌药物的应用时间较长,大大增加了感染机会等有关。因此临床应规范及加强对这些病区的管理,实施有效的消毒隔离以控制本菌感染。
广谱抗菌药物在临床中的广泛使用易引起鲍曼不动杆菌产生耐药性。本研究回顾性调查显示,分离的653株鲍曼不动杆菌中,耐药率排前的为环丙沙星(91.67%)、哌拉西林(90.76%)、复力新诺明(90.62%)、庆大霉素(90.12%)。随着耐药性不断增高,亚胺及美罗培南(70.65%、71.65%)等碳青霉烯类的耐药性亦显著提升,其耐药机制可能与OXA酶、金属酶等产碳青霉烯酶有关,外膜孔蛋白降低及青霉素结合蛋白发生变化也是该菌耐亚胺及美罗培南等抗菌药物的重要机制。磺胺类复方新诺明(90.62%),氨基糖苷类庆大霉素(90.12%),头孢他啶(88.56%)、哌拉西林(90.76%)、头孢吡肟(80.45%)、替卡西林(89.54%)等β-内酰胺类以及喹诺酮类环丙沙星(91.67%)的耐药率超过80%。对β-内酰胺的耐药机制主要是因β-内酰胺酶的产生,此外外膜蛋白含量降低及青霉素结合蛋白发生改变而致通透性下降亦是其重要因素[7]。对氨基糖苷类耐药可能是因质粒或者是转座子编码的钝化酶导致抗菌素失去活性等机制有关。对喹诺酮类耐药是因细胞外膜蛋白F减少或者是因病原菌DNA螺旋酶A或B亚单位发生突变而产生的,也可能与该菌的药物主动外排增高病理机制等存在相关性[8]。对磺胺类耐药主要是由于细菌改变患者二氢蝶酸合成酶,抗菌药物作用被减弱,药物破坏失活,而使鲍曼不动杆菌对磺胺药物不敏感,导致磺胺类药物的耐药性[9,10]。总之,该菌己成为多重耐药菌株,本研究显示敏感性最高的为多黏菌素E(97.98%)。但由于多黏菌素E的肾脏及神经系统毒性较大,不推荐临床广泛使用。
综上所述,鲍曼不动杆菌存在不同程度的抗菌药物高度及多重耐药性,检验科在日常工作中应加强对其的临床耐药性监测,避免临床泛耐药菌株的传播流行,指导临床合理选用抗菌药。
参考文献:
[1]李海兰,张亚莉,王茵茵,等.4起耐药鲍曼小动杆菌医院感染聚集性病例调查[J].中国感染控制杂志,2011,10(5):341.
[2]任波,周丽娟,刘广彬,等.鲍曼不动杆菌耐药性研究[J].中国实验诊断学,2013,17(10):1886.
[3]邓丽华,施德仕,杨荣胜,等.鲍曼不动杆菌的耐药性及β-内酰胺酶耐药基因的研究[J].中国实验诊断学,2013,17(7):1180.
[4]黄晓洁,刘进.院内鲍曼不动杆菌性脑膜炎40例临床分析[J].中华传染病杂志,2012,30(7):425.
[5]凌保东.鲍曼不动杆菌抗生素多重耐药性:耐药机制与感染治疗对策[J].中国抗生素杂志,2010,35(4):241.
[6]王玮玮.多重耐药鲍曼不动杆菌耐药机制研究进展[J].国际检验医学杂志,2011,32(21):2487.
[7]Nageeb W,Kamel M,Zakaria S,et al.Phenotypic characterization of Acinetobacter baumannii isolates from intensive care units at a tertiary-care hospital in Egypt[J].East Mediterr Health J,2014,20(3):203.
[8]Enfield KB,Huq NN,Gosseling MF,et al.Control of Simultaneous Outbreaks of Carbapenemase-Producing Enterobacteriaceae and Extensively Drug-Resistant Acinetobacter baumannii Infection in an Intensive Care Unit Using Interventions Promoted in the Centers for Disease Control and Prevention 2012 Carbapenemase-Resistant Enterobacteriaceae Toolkit[J].Infect Control Hosp Epidemiol,2014,35(7):810.
[9]张正银,窦蓉,徐伟红.2006-2009年鲍曼不动杆菌耐药趋势分析[J].临床和实验医学杂志,2010,9(8):638.
[10]周月清,陆开来,糜祖煌,等.鲍曼不动杆菌TEM基因及氨基糖苷类修饰酶基因初步研究[J].中华检验医学杂志,2005,28(2):200.
收稿日期:(2014-08-10)
作者简介:张华(1973-),女,北京人,北京市首都医科大学大兴医院检验科主管检验师,研究方向:微生物。
文章编号:1007-4287(2015)01-0020-03
基金项目:国家自然科学基金(30972523)
