调控胆固醇吸收的分子通路
2015-02-23邵翅,杨林
邵 翅,杨 林
(哈尔滨工业大学化工学院,哈尔滨 150090)
调控胆固醇吸收的分子通路
邵翅,杨林*
(哈尔滨工业大学化工学院,哈尔滨 150090)
摘要:机体内的胆固醇失衡会引发多种疾病,如高胆固醇血症、心脑血管疾病等,而其平衡由胆固醇的合成、吸收、代谢和循环共同维持,其中胆固醇的吸收至关重要。胆固醇的吸收主要发生在小肠和近段空肠,受众多蛋白的调控。尼曼-匹克C1样蛋白1 (NPC1L1)负责胆固醇的摄取;ATP 结合盒转运蛋白(ABCG5/ABCG8)则抑制胆固醇的吸收,酰基辅酶A-胆固醇酰基转移酶(ACAT)催化胆固醇脂化提高胆固醇吸收;ATP 结合盒转运蛋白A1 (ABCA1)负责外周组织胆固醇的转运,而这些蛋白又受到其他调控因子的影响。解析胆固醇吸收的分子通路对胆固醇失衡相关疾病的预防及治疗具有重大指导意义。因此,本文就调控胆固醇吸收的分子通路进行综述。
关键词:胆固醇吸收;NPC1L1;ABCG5/G8;ACAT2;ABCA1
机体内的胆固醇主要来源于食物和生物合成,肝脏和肠粘膜是合成的主要场所。人体内70%~80%的胆固醇由肝脏合成,10%由小肠合成。小肠可吸收来自食物的胆固醇,也可吸收由胆汁酸转化来的胆固醇。肝脏胆固醇通过极低密度脂蛋白(Very low density lipoproteins, VLDL)分泌到血浆,胆固醇的代谢也在肝脏中,大部分的胆固醇转变为胆汁酸,随胆汁排出。在小肠下段,大部分的胆汁酸通过肠粘膜的重吸收回到肝脏,小部分经肠道排出。胆固醇的合成、吸收、代谢和循环维持机体内的胆固醇平衡[1,2]。胆固醇的失衡会对机体产生不良影响。肝脏胆固醇通过VLDL分泌到血浆,血浆胆固醇含量增高,在血管壁中堆积会引起动脉粥样硬化,还会引起其他病症如高胆固醇血症、胆固醇结石、心脑血管疾病、阿尔茨海默氏病及某些的癌症等。胆固醇吸收是维持体内胆固醇平衡的关键,因此,了解胆固醇吸收的分子通路对各种相关疾病的预防及治疗具有十分重要的意义。
1胆固醇吸收过程
膳食胆固醇进入肠腔后,穿过肠粘膜表面的扩散屏障,被位于肠上皮细胞刷状缘膜表面的尼曼-匹克C1样蛋白1 (Niemann-Pick C1 like 1, NPC1L1)摄取。游离胆固醇在肠上皮细胞被乙酰辅酶A:胆固醇转乙酰基酶(Acyl-coenzyme A (CoA): cholesterol acyltransferase, ACAT)催化酯化,与胆汁盐和脂肪酸形成乳糜微粒,经过淋巴系统进入血液循环(如图1)。部分未被酯化的胆固醇直接进入循环系统,形成高密度脂蛋白(High-density lipoprotein, HDL)。胆固醇被吸收时则从乳糜微粒中分离出来。而位于回肠的胆汁酸转运体则将胆汁酸运回至肝脏,形成的胆汁酸肠肝循环[3]。另外,肝外组织和巨噬细胞中的胆固醇会从细胞中流出,被新生HDL摄取后,在血浆中在卵磷脂胆固醇酰基转移酶(Lecithin cholesterol acyltransferase, LACT)的作用下发生形成胆固醇酯,并HDL内核转移,最终形成球状的成熟的HDL,最后将胆固醇运输至肝脏被摄取[4]。这是胆固醇逆向转运的过程,通过此过程将外周组织中衰老细胞膜中的胆固醇转运到肝脏并代谢排出体外。因此,胆固醇的逆向转运对胆固醇的吸收具有重要的影响。
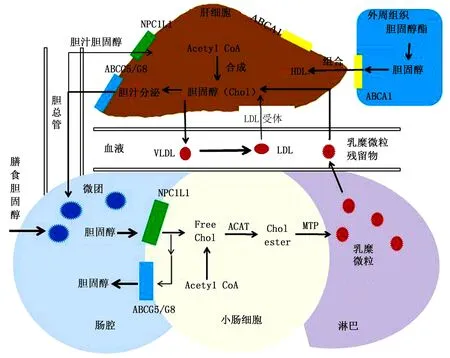
图1 胆固醇吸收模拟图Fig.1 Cholesterol simulation diagram
2胆固醇吸收的调控因子
2.1 NPC1L1
NPC1Ll广泛在许多人类组织中表达,但在肝脏和小肠中高度表达,尤其在近段空肠,具体位于肠细胞的刷状缘膜,并进行胆固醇吸收。研究已经表明,NPC1Ll是位于小肠上皮细胞刷状缘表面有重要作用的胆固醇摄取相关转运体[5]。NPC1L1与其同系物NPC1类似,也含有信号肽区域,其中包含13个跨膜区域和3个胞外区段(分设为A、B、C)。胞外区段A是NPC1L1的NH2端,NPC1L1通过其中存在的一个富含半胱氨酸的氨基结构域(N-terminal domain, NTD)结合胆固醇,若NPC1L1的NTD缺失则对胆固醇的吸收无促进作用;胞外区段B上存在胆固醇吸收抑制剂-依泽替米贝(Ezetimibe)的结合位点;胞外区段C中存在多个糖基化位点,经过糖基化修饰,NPC1L1稳定性增加不易被胆汁或小肠消化液酶分解,若其中的糖基化位点发生突变对NPC1L1的成熟和功能也会产生影响。另外NPC1L1分子中还有一个作为NPC1L1固醇感应结构域(Sterol sensing domain, SSD)的跨膜区域[6]。
胆固醇通过网格蛋白/衔接蛋白2(Adaptor protein complex 2, AP2)介导的内吞作用输送到细胞的NPC1L1,并被其摄取。研究表明,脂质筏蛋白质otillins可以与NPC1Ll结合形成NPC1L1-Flotillin-胆固醇(NFC)膜微结构,可以增加胆固醇的摄取效率[7]。并且研究者还建立了NPC1L1介导的胆固醇摄取模型:NPC1L1的N端识别游离胆固醇,并将其转移到细胞膜微结构区,当游离胆固醇浓度增加到一定程度时,胆固醇在跨膜转运过程中,直接与NPC1Ll蛋白的SSD区结合,引起该蛋白构象改变,经AP2介导进入网格蛋白装配的囊泡内,并触发细胞内吞,囊泡沿微丝移至核内区,NPC1L1和胆固醇则贮存于此。当细胞内胆固醇减少时,NPC1L1则通过微丝再返回至细胞膜,介导胆固醇的摄取[8]。需要更多的研究阐明该机制的细节。
Alrefai等的研究表明,NPC1L1的表达和启动子的胆固醇激活具有固醇调节元件结合蛋白2(SREBP-2)依赖性。实验中,胆固醇膳食和ACAT2缺失引起胞内胆固醇水平增加,原因被认为是SREBP-2 结合到NPC1L1启动子上的两个固醇调节元件上,从而导致NPC1L1表达量降低。Van Der Veen等的实验揭示血清HDL增加引起的过氧化物酶体增殖物激活受体δ(Peroxisome proliferator-activated receptor δ, PPARδ)[9]活化导致胆固醇吸收降低,可能与PPARδ降低了NPC1L1的表达量相关。Sui等人进行了人体NPC1L1的启动子分析,在其中发现了一个DR-4型的孕烷X受体(Pregnane X receptor, PXR)响应元件,并发现柠檬酸三丁酯(Tributyl citrate, TBC)能够促进PXR结合到NPC1L1启动子上。Valasek和Kumar等在研究非诺贝特(Fenofibrate)和姜黄素(Curcumin)降低小肠胆固醇吸收机制时发现,激活过氧化物酶体增殖物激活受体α(Peroxisome proliferator-activated receptor, PPARα)能够降低胆固醇吸收和NPC1L1 mRNA的表达。另外,研究发现,NPC1L1的基因中含有肝受体同系物1(Liver Receptor Homologue-1, LRH-1)反应元件,且固醇调节元件结合蛋白(Sterol regulatory element binding protein-2, SREBP-2)与LRH-1协同表达;肝细胞核因子-4α(Hepatocyte nuclear factor-4α, HNF-4α)对人类NPC1L1基因的表达具有重要的调控作用。还有一些实验结果表明,衔接蛋白Numb在人体肠和肝脏能够特异性的调控NPC1L1介导的胆固醇吸收过程[10]。还有其他一些因素也会对NPC1L1产生调控,例如含高甘油三酸酯的膳食和长链脂肪酸,以及糖尿病等,但是关于NPC1L1调节的精确机制尚不清晰。
2.2 ABCG5/G8
ATP结合盒转运蛋白G5/G8 (ATP-binding cassette transporters G5/G8, ABCG5/ G8)属于ATP结合盒转运蛋白(ABC)半转运体。ABC转运体家族在体内胆固醇的代谢中发挥重要作用。人类的ABCG5和ABCG8基因在2号染色体2p21上,以头对头的方式存在,二者均含有13个外显子和12个內显子。ABC转运体家族中的其他蛋白均含有2个跨膜域和2个核苷酸结合域(Nucleotide binding domain, NBD),而ABCG5和ABCG8却均只含有1个跨膜区域和1个NBD。因此,ABCG5和ABCG8需结合成异二聚体,组成完整的ABC转运体才能发挥转运的作用。异二聚体的主要功能是将被摄取进入小肠上皮细胞的胆固醇逆转运回肠腔。大部分ABCG5/ G8在肝细胞的小管膜和小肠上皮细胞刷状缘膜表达,参与胆固醇和植物固醇的代谢。Vrins等的实验结果证明人肾脏和胆囊上皮细胞ABCG5和ABCG8的过度表达促进胆固醇和植物固醇流出。 验证ABCG5和ABCG8能够抑制胆固醇的吸收实验中,Abcg5和Abcg8过度表达小鼠体内膳食胆固醇的吸收率降低约50%,而肝脏中胆固醇合成量增加2~4倍,胆汁胆固醇含量增加超过5倍,粪便内中性固醇排泄量增加3~6倍[11]。Abcg5和Abcg8的表达在不同种系小鼠间存在差异,小鼠胆固醇吸收率与其小肠Abcg5和Abcg8的mRNA表达水平呈负相关[12]。另外,研究表明,敲除NPC1L1的小鼠可通过ABCG5/G8通路排出少量胆固醇。上述结果均证明,ABCG5和ABCG8通过逆向转运小肠中的胆固醇降低胆固醇的吸收。
ABCG5和ABCG8的调控主要在转录水平。胆固醇膳食和LXR激动剂可以增加野生型小鼠小肠和肝脏中的ABCG5和ABCG8 mRNA的表达,但LXR基因敲除的小鼠则不会[13]。大豆蛋白异黄酮可以通过肝和肠中的LXRα或LXRβ增加Abcg5 和Abcg8的表达。实验者在ABCG5/ ABCG8基因间区域发现了LRH-1的结合位点,而这个基因间区域是ABCG5/ ABCG8基因启动子激活所必需的。电泳迁移率变动分析,结果揭示LRH-1特异性结合于ABCG5/ ABCG8基因间区域的LRH-1结合位点。在HepG2和CaCO2细胞中,突变ABCG5/ ABCG8基因间区域的LRH-1结合位点,ABCG5/ ABCG8基因启动子活性减低超过7倍。在CaCO2和 293细胞中过表达LRH-1,ABCG5/ ABCG8基因启动子活性则分别达到1.6倍和3倍[14]。另一些实验也发现HNF-4α对ABCG5/ ABCG8基因有相似的调控作用,且HNF-4α需要GATA4 和 GATA6因子的激活。解除叉头转录因子FoxO1抑制能够增加ABCG5和ABCG8的表达。学者在ABCG5/ ABCG8基因鉴定出两个LXREs,尤其在ECR20中,其对LXRα/RXRα,GATA4,HNF-4α和LRH-1的调控起重要作用[15]。实验还表明肝脏胰岛素,细菌内毒素和瘦素可以降低ABCG5/ ABCG8基因的转录水平。尤特普甘蓝(Euterpe oleracea Mart.)和甲状腺激素可以增加Abcg5 and Abcg8表达。但是关于以上因素调控ABCG5/ ABCG8基因转录的细节,还需要进一步研究。
2.3 ACAT2
胆固醇被NPC1L1摄取进入上皮细胞后,以游离形式存在,在 ACAT作用下发生酯化。ACAT广泛存在于肾上腺、皮脂腺、巨噬细胞、肝脏、肠细胞中,包括ACAT1 和 ACAT2 两种亚型。肠细胞和肝细胞中主要表达 ACAT2,生成的胆固醇酯与甘油三酯(Triglycerides, TG) 形成乳糜微粒或 VLDL,将胆固醇转运出肠细胞和肝细胞[16,17]。之前的研究已经证明ACAT2缺失对胆固醇饮食具有重要作用,深层机制可能是ACAT2的缺失降低胆固醇酯的合成量,从而改善胆固醇膳食对人体的影响。一些实验也揭示ACAT2在肝脏和肠中有很显著的催化作用及ACAT2功能的丧失会造成胆固醇不能发生脂化,与之前的实验结果一致。另外实验证据表明ACAT2启动子含有转录因子CDX2和HNF-1α的顺式元件,而ACAT2的表达需要两者的刺激。缺失ACAT2的脂化作用导致胆固醇吸收降低,但供给Acat2基因缺失鼠致石饲料时,与供给基础饲料正常鼠相比,其胆固醇净吸收量高出4倍以上[16]。说明除去ACAT2介导的胆固醇吸收途径,还存在另外的胆固醇吸收机制。到目前为止,认为此过程主要由ABCA1介导。
2.4 ABCA1
ABCA1与ABCG5/ G8一样,也属于ABC转运体家族,不同的是其主要参与外周组织中胆固醇的转运,与载脂蛋白A-1(Apolipoprotein A-l, ApoA1)及HDL的形成也有关联。实验中增加小鼠巨噬细胞line RAW264.7中ABCA1的表达,揭示ABCA1的表达水平限制胆固醇和磷脂流出量。2个研究小组先后报道过表达小鼠的ABCA1基因能够增加HDL胆固醇的量。另外的研究结果显示小肠胆固醇吸收率降低,ABCA1表达上调以及ABCA1的基因缺失对胆固醇吸收的影响作用较小,从而表明ABCA1对胆固醇转运作用较小。但关于ABCA1基因调控胆固醇吸收的其他实验结果显示,同时敲除小鼠ABCA1基因和ACAT2基因,胆固醇吸收明显降低,且肝脏和胆汁酸水平下降;敲除ACAT2时,胆固醇吸收并无明显变化,但ABCA1的mRNA水平提高3倍;敲除ABCA1基因时,胆固醇吸收变化不明显[18]。综合以上结果,认为ABCA1介导另一条胆固醇排出途径,参与摄取未酯化的胆固醇直接转运到血液系统形成HDL,但其影响远小于ACAT2。一些研究发现巨噬细胞中ABCA1的表达受cAMP (Adenosine 3’, 5’-cyclic monophosphate)、胆固醇水平、LXR及RXR的调控。LXR和RXR作为一个非特异性的异源二聚体介导巨噬细胞中ABCA1表达和胆固醇流出,并且在人类ABCA1基因中发现了推测的RXR/ LXR结合基序[19]。有些研究发现,microRNAs对Abca1的表达具有抑制作用。
另外,也有一些关于ABCG1、SR-BI(Scavenger receptor BI)介导胆固醇流出的相关报道,但具体机制尚未清晰,也有实验结果显示LDLR基因及蛋白表达量增加可增加胆固醇逆转运[20]。
3结束语
胆固醇的吸收是由小肠上皮细胞完成。其分子通路概括如下:位于小肠上皮细胞刷状缘膜上的NPC1L1将胆固醇分子摄入细胞,而肝细胞及上皮细胞中的ABCG5/G8则将已摄入的胆固醇分子转出细胞。被摄取的游离胆固醇在ACAT2的作用下发生酯化,进而形成乳糜微粒进入血液循环,未脂化的胆固醇则在ABCAl的作用下直接进入血液循环形成HDL。在此过程受多种因素及多种调控因子的调节,但具体机制还需深入的探索。因此,关于调控胆固醇吸收的分子通路还需要广泛深入的研究。随着心脑血管疾病患病率的不断增高,精确解析各分子对胆固醇吸收的调控作用及其影响因素已逐渐成为研究的热点,以发现抑制胆固醇吸收的新研究方向,为预防与治疗动脉粥样硬化、高胆固醇血症、胆固醇结石、心血管疾病、阿尔茨海默氏病及某些的癌症等与胆固醇相关的疾病提供新的理论基础,以便新药物的开发。
参考文献
[1]YANG L,HAN G,LIU QH,et al.Rice protein exerts a hypocholesterolemic effect through regulating cholesterol metabolism-related gene expression and enzyme activity in adult rats fed a cholesterol-enriched diet[J].International Journal of Food Sciences and Nutrition,2013,64(7):836-842.
[2]叶健强,蒋立,王继文.微粒体甘油三脂转运蛋白 MTP 的结构和功能研究概况[J].生物信息学,2005,3(3):140-143.
YE Jianqiang, JIANG Li,WANG Jiwen.Recent advance on microsomal triglyceride transfer protein[J].China Journal of Bioinformatics,2005,3(3):140-143.
[3]LI T, CHIANG J Y.Regulation of bile acid and cholesterol metabolism by PPARs[J].PPAR Research, 2009(2008):501739-501739.
[4]FIELDING C J,FIELDING P E.Molecular physiology of reverse cholesterol transport[J].Journal of Lipid Research,1995,36(2):211-228.
[5]ALTMANN S W,DAVIS H R,ZHU L,et al. Niemann-Pick C1 Like 1 protein is critical for intestinal cholesterol absorption[J].Science,2004,303(5661):1201-1204.
[6]袁敏, 徐东刚. 小肠胆固醇吸收相关蛋白的研究进展[J].军事医学 ISTIC,2015,(6):472-475.
YUAN Min, XU Donggang. Several proteins involved in absorption of cholesterol in small intestine[J].Military Medical Sciences ISTIC, 2015,(6):472-475.
[7]GE L,QI W,WANG L J,et al.Flotillins play an essential role in Niemann-Pick C1-like 1-mediated cholesterol uptake[J].Proceedings of the National Academy of Sciences,2011,108(2):551-556.
[8]BETTERS J L,YU L.NPC1L1 and cholesterol transport [J].FEBS Letters, 2010, 584(13): 2740-2747.
[9]许恒勇, 王继文, 蒋立.PPAR 基因在脊椎动物发育过程中的功能研究[J].生物信息学, 2004,2(1):41-45.
XU Hengyong,WANG Jiwen,JIANG Li.PPAR expression and function during vertebrate development[J].China Journal of Bioinformatics,2004(1): 41-45.
[10]WEI,FU Z Y,LI P S,et al.The Clathrin Adaptor Proteins ARH,Dab2,and Numb Play Distinct Roles in Niemann-Pick C1-Like 1 Versus Low Density Lipoprotein Receptor-mediated Cholesterol Uptake[J].Journal of Biological Chemistry,2014,289(48):33689-33700.
[11]VRINS C,VINK E,VANDENBERGHE K E, et al.The sterol transporting heterodimer ABCG5/ABCG8 requires bile salts to mediate cholesterol efflux[J].FEBS letters,2007,581(24):4616-4620.
[12]YU L,LI H J,HAMMER R E, et al. Overexpression of ABCG5 and ABCG8 promotes biliary cholesterol secretion and reduces fractional absorption of dietary cholesterol[J].Journal of Clinical Investigation, 2002, 110(5):671-680.
[13]REPA J J,BERGE K E, POMAJZLC,et al.Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the liver X receptors α and β[J].Journal of Biological Chemistry,2002,277(21):18793-18800.
[14]FREEMAN L A, KENNEDY A, WU J,et al.The orphan nuclear receptor LRH-1 activates the ABCG5/ABCG8 intergenic promoter[J].Journal of Lipid Research,2004,45(7):1197-1206.
[15]BACK S S,CHOI D H,CHOI S Y.Cooperative transcriptional activation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 genes by nuclear receptors including Liver-X-Receptor[J].Biochemistry and Molecurar Biology Reports,2013,46(6): 322-327.
[16]REPA J J,BUHMAN K K,FARESE R V,et al.ACAT2 deficiency limits cholesterol absorption in the cholesterol-fed mouse:Impact on hepatic cholesterol homeostasis[J].Hepatology,2004,40(5):1088-1097.
[17]刘志国, 江会峰, 屈伸. VLDL-受体的配体结合结构域结构分析[J].生物信息学,2003,1(1): 20-24.
LIU Zhiguo,JIANG Huifeng,QU Shen.The structure analysis of VLDL receptor’s ligand-binding domain[J].China Journal of Bioinformatics,2003,1(1): 20-24.
[18]TEMEL R E,LEE R G,KELLEY K L,et al.Intestinal cholesterol absorption is substantially reduced in mice deficient in both ABCA1 and ACAT2[J].Journal of lipid research,2005,46(11):2423-2431.
[19]COSTET P,LUO Y,WANG N,et al.Sterol-dependent transactivation of the ABC1 promoter by the liver X receptor/retinoid X receptor[J].Journal of Biological Chemistry,2000,275(36):28240-28245.
[20]彭雪,杨林,刘巧红, 等.大米蛋白调控成熟期大鼠 LDLR 基因及蛋白表达[J]. 生物信息学,2013,11(2):120-123.
PENG Xue,YANG Lin,LIU Qiaohong. Rice protein affects gene and protein expressions of LDLR in adult rats[J].China Journal of Bioinformatics,2013,11(2):120-123.
Molecular pathways of cholesterol absorption regulation
SHAO Chi,YANG Lin*
(SchoolofChemicalEngineering,HarbinInstituteofTechnology,Harbin150090,China)
Abstract:Cholesterol imbalance can cause a variety of diseases,such as high cholesterol,cardiovascular disease, while the cholesterol balance in body is maintained by synthesis,absorption,metabolism and circulation of cholesterol,and the absorption of cholesterol is a crucial step. Cholesterol absorption occurs mainly in the small intestine and proximal jejunum, and it is regulated by a number of proteins. Niemann-Pick C1-like 1 protein(NPC1L1) is responsible for the cholesterol uptake.ATP-binding cassette(ABC) G5/G8 inhibits the absorption of cholesterol. Acyl-coenzyme A(CoA):cholesterol acyltransferase(ACAT) catalyzes the cholesterol esterified reaction for raising cholesterol absorption.ATP-binding cassette transporters A1(ABCA1) transports cholesterol in peripheral tissues and these proteins are also affected by other regulatory factors.Parsing cholesterol absorption of molecular pathways has major directive significance the prevention and treatment of diseases related with cholesterol imbalance.Therefore, the molecular pathways of cholesterol absorption regulation were reviewed in this paper.
Keywords:Cholesterol absorption;NPC1L1;ABCG5/G8;ACAT2;ABCA1
中图分类号:
文献标志码:A
文章编号:1672-5565(2015)04-239-05
doi:10.3969/j.issn.1672-5565.2015.04.06
作者简介:邵翅,女,硕士研究生,研究方向:功能性食品; E-mail:1883692772@qq.com.*通信作者:杨林,女,教授,博士生导师,研究方向:功能性食品; E-mail:ly6617@hit.edu.cn.
基金项目:国家自然科学基金(No.31371755)。
收稿日期:2015-10-09;修回日期:2015-11-19.
