乙型肝炎患者抗病毒治疗过程中肝组织HBV cccDNA与血清学标志物变化的动态变化研究
2015-02-23王春颖刘成永周冬青杨青松
王春颖, 刘成永, 周冬青, 王 骥, 杨青松
(江苏省徐州市传染病医院, 1. 传染科; 2. 检验科, 徐州, 江苏, 221004)
乙型肝炎患者抗病毒治疗过程中肝组织HBV cccDNA与血清学标志物变化的动态变化研究
王春颖1, 刘成永2, 周冬青2, 王骥1, 杨青松1
(江苏省徐州市传染病医院, 1. 传染科; 2. 检验科, 徐州, 江苏, 221004)
摘要:目的探讨慢性乙型病毒性肝炎患者抗病毒治疗过程中肝组织乙型肝炎病毒(HBV)共价闭合环状DNA(cccDNA)与相关血清学标志物变化。方法88例乙型肝炎e抗原(HBeAg)阳性的慢性乙型病毒性肝炎患者给予恩替卡韦抗病毒治疗96周。分别于0、24周、48周、96周检测肝组织中和血清HBV cccDNA、血清HBV DNA、乙型肝炎表面抗原(HBsAg)、HBeAg定量,并分析肝组织HBV cccDNA与血清学标志物变化的关系。结果与基线比较,治疗后24周时患者肝组织HBV cccDNA, 血清HBV cccDNA, 血清HBV DNA和HBsAg均显著降低(P<0.05或P<0.01); 治疗后24周和48周比较:肝组织HBV cccDNA, 血清HBV cccDNA, 血清HBV DNA差异有统计学意义(P<0.01); 48周与96周检测指标相比:肝组织HBV cccDNA定量差异无统计学意义(P>0.05); 血清HBV DNA定量和血清HBV cccDNA定量差异有统计学意义(P<0.01)。血清HBsAg和HBeAg差异无统计学意义(P>0.05)。结论血清HBV DNA定量和血清HBV cccDNA定量同步下降幅度大于肝组织cccDNA定量和HBsAg、HBeAg定量,肝组织HBV cccDNA定量、HBsAg、HBeAg定量在48周后逐步趋于稳定。血清HBsAg、HBeAg定量与肝组织HBV cccDNA 具有较高的一致性,血清HBsAg、HBeAg定量检测能更准确、方便、快捷指导临床诊断。
关键词:肝炎; 乙型肝炎病毒;HBV cccDNA; HBV DNA; 乙型肝炎表面抗原; 乙型肝炎e抗原
肝细胞内持续乙型肝炎病毒(HBV)感染是以HBV核内共价闭合环状DNA(cccDNA)的存在为特征, HBV cccDNA 作为乙肝病毒基因组的复制中间体, mRNA和前基因组RNA的模板,是乙肝病毒持续感染的关键因素[1-2]。肝组织中HBV cccDNA的检测是最直接反映体内HBV感染与复制情况的证据,是评估乙肝患者病情疗效的“金标准”[3-4]。但肝组织HBV cccDNA检测因取材困难、操作繁琐,且具有创伤性,不能被患者所接受,不适宜普遍开展[5]。本研究旨在通过动态检测乙型肝炎e抗原(HBeAg)阳性的慢性乙型病毒性肝炎(CHB)患者抗病毒治疗前后肝组织中HBV cccDNA、血清HBV cccDNA、HBV DNA及HBsAg、HBeAg定量,分析肝组织HBV cccDNA与血清学标志物变化的相关性,以期通过无创手段,利用血清学指标更准确、方便、快捷指导临床诊断,为评价抗病毒疗效提供可靠依据。
1资料与方法
1.1 一般资料
选取2010年1月—2011年6月在徐州市传染病医院就诊HBeAg阳性的慢性乙型肝炎患者88例为研究对象,其中男51例,女37例,年龄24~60岁,平均(38.9±10.1)岁,均符合中华医学会《慢性乙型肝炎防治指南(2010版)》的诊断标准[6]。患者均经血清免疫学检查确诊,无合并甲、丙、丁、戊型病毒性肝炎。且均签署知情同意,愿意在2年内接受4次肝穿刺活检并坚持检查治疗。排除标准: ① 酒精性肝病、非酒精性脂肪肝,自身免疫性肝病以及肝硬化失代偿期患者; ② 入组前6个月接受抗病毒治疗或免疫调节治疗,有肝穿刺禁忌证或恩替卡韦用药禁忌证。
1.2 方法
1.2.1样本采集:所有患者采用恩替卡韦(江苏正大天晴制药有限公司,国药准字:H20120038)治疗。治疗前患者抽空腹静脉血5 mL, 低温冰箱保存,用于检测肝功能、HBV标志物、HBV DNA定量等。肝组织活检采用1秒钟快速穿刺法,送检肝组织长度均在15 mm以上。部分10%甲醛固定、石蜡包埋、连续切片后行HE染色、网状纤维染色及HBcAg免疫组织化学染色。其余肝组织立即放入-70 ℃冰箱保存备用。治疗后24、48、96周行上述检查。
1.2.2HBV cccDNA水平检测: HBV cccDNA核酸定量检测试剂盒购于广州蓝星生物科技开发有限公司, 采用德国罗氏公司LightCycler 定量PCR仪检测,操作严格按说明书进行,检测范围是2.50×103~2.5×109拷贝/mL; 取检测结果对数值进行统计学分析。
1.2.3HBV血清标志物和病毒载量检测:HBV血清标志物检测采用酶联免疫吸附试验(ELISA),试剂购自北京万泰公司;生化检测采用OLYMPAS AU-400全自动生化分析仪; HBsAg定量采用罗氏Elecsys HBsAg Ⅱ定量检测方法,HBeAg检测采用罗氏通过PEIU标准品,制作标准曲线,然后实现定量检测血清HBeAg水平。HBV DNA定量试剂盒购于深圳匹基生物工程有限公司,操作严格按说明书进行。
1.3 观察指标
观察患者基线时、治疗后24、48和96周时肝组织HBV cccDNA、血清HBV cccDNA、HBV DNA、HBsAg、HBeAg和丙氨酸氨基转移酶(ALT)的变化。
2结果
与基线比较,治疗后24周时患者肝组织HBV cccDNA, 血清HBV cccDNA, 血清HBV DNA和HBsAg均显著降低(P<0.05或P<0.01)。治疗后24周和48周比较:肝组织HBV cccDNA, 血清HBV cccDNA, 血清HBV DNA差异有统计学意义(P<0.01)。治疗后48周与96周比较:血清HBV DNA定量和血清HBV cccDNA定量差异有统计学意义(P<0.01)。肝组织HBV cccDNA定量、HBsAg定量和HBeAg差异无统计学意义(P>0.05)。见表1。
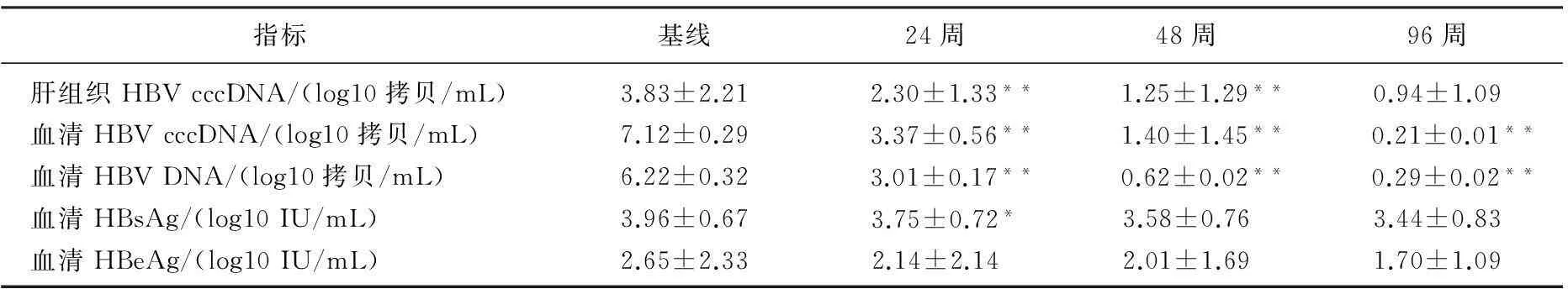
表1 患者肝组织HBV cccDNA和血清相关标志物水平
与前一观察点比较, *P<0.05, **P<0.01
3讨论
肝脏组织中HBV cccDNA存在与慢性阴性肝炎发生发展密切相关。本研究结果显示,治疗后24周和48周,除血清HBeAg定量,肝组织HBV cccDNA、血清HBV DNA和HBsAg定量均较前一观测点下降(P<0.05或P<0.01); 治疗后48周和96周时比较,血清HBV DNA定量和血清HBV cccDNA有显著差异,而肝组织HBV cccDNA定量、血清HBsAg定量和HBeAg定量差异无统计学意义,提示血清HBV DNA和血清cccDNA同步下降幅度可能大于肝组织HBV cccDNA和血清HBsAg、HBeAg下降幅度。
肝细胞HBV cccDNA与血清HBV cccDNA、血清HBV DNA定量消长不完全同步。Singh等[7]研究发现,10例乙肝患者肝组织中HBV cccDNA呈阳性,但只有6例在血清中检测到HBV cccDNA。陈嵬等[8]研究慢性HBV感染者肝组织中HBV cccDNA含量与血清病毒标志物、HBV DNA的关系分析表明:肝组织cccDNA定量与血清中的HBV DNA含量无显著相关性。本研究中,治疗后48周,肝细胞内HBV cccDNA尚维持一定水平,但血清中HBV cccDNA及HBV DNA下降显著,考虑可能有以下几种原因: ① 嗜肝病毒的特殊复制形式保护HBV cccDNA不被终止链的多聚酶抑制物直接清除,并且病毒处于低复制状态时成熟的病毒体优先用于补充HBV cccDNA池,上述因素共同作用使抗病毒药物对HBV cccDNA无直接抑制作用,抗病毒药物只通过长期的病毒抑制和激发的免疫反应逐渐消耗细胞内HBV cccDNA, HBV cccDNA很难被彻底清除,故HBV cccDNA能持续存在于肝细胞内[9-10]; ② 血清HBV cccDNA、HBV DNA有可能是伴随着患者病情活动、肝细胞破坏而出现的。患者机体内存在免疫反应,肝细胞易受到宿主免疫攻击,溶解破坏,导致肝细胞内容物释放。因此,存在肝细胞核的HBV cccDNA释放入血,从而能够被检测;给予患者持续抗病毒治疗,病情逐渐稳定,肝细胞修复,肝细胞内容物释放减少,故血清中HBV cccDNA、HBV DNA随之减少。
肝组织cccDNA水平与HBsAg、HBeAg水平呈同步下降,且有一定的相关性。有研究提示,血清HBsAg水平与肝细胞内cccDNA数量相关[11]。Wursthorn等[12]发现26例HBeAg阳性慢性乙型肝炎患者抗病毒治疗过程中肝内cccDNA水平与血清HBsAg呈同步下降。Maynard等[1]也报告拉米夫定联合阿德福韦抗病毒治疗后患者血清HBsAg的阴转伴随着肝组织HBV cccDNA的显著下降[13]。另一项聚乙二醇干扰素α-2b治疗30例HBeAg阳性患者48周临床试验中显示, 10例发生HBeAg血清转换率患者,在治疗期间其血清HBsAg、HBeAg及HBV DNA滴度持续下降;基线与治疗后降低的血清HBsAg、HBeAg滴度与肝内总HBV DNA、cccDNA的相关性良好[14]。考虑肝组织HBV cccDNA与HBsAg、HBeAg下降较慢的原因可能是核苷(酸)类药物是HBV的反转录抑制剂而非直接作用于cccDNA, HBsAg的转录和合成并没有受影响; HBeAg合成与病毒复制途径虽然是分离的, 即抑制病毒复制不直接影响HBeAg合成,但可减少前基因组RNA 的转录,因此可能间接影响HBeAg合成[15]。故肝组织cccDNA与HBsAg、HBeAg下降水平基本一致。
参考文献
[1]Malmstrom S, Larsson S B, Hannoun C, et al. Hepatitis B viral DNA decline at loss of HBeAg is mainly explained by reduced cccDNA load-down-regulated transcription of PgRNA has limited impact[J]. PloS one, 2012, 7(7): e36349.
[2]Wang M, Qiu N, Lu S, et al. Serum hepatitis B surface antigen is correlated with intrahepatic total HBV DNA and cccDNA in treatment-naive patients with chronic hepatitis B but not in patients with HBV related hepatocellular carcinoma[J]. J Med Virol, 2013, 85(2): 219.
[3]朱锦宏, 吴晓蔓. 乙型肝炎病毒大蛋白对于判定HBV复制情况的意义[J]. 广东医学, 2012, 32(18): 2395.
[4]张永乐, 徐岱, 朱国献, 等. 乙肝患者肝组织中HBVccc DNA与血清中HBV DNA, HBeAg的关系[J]. 医学研究杂志, 2008, 37(3): 60.
[5]刘成, 慕永平, 杨宗国, 等. 乙型肝炎病毒核心相关抗原的监测及临床意义[J]. 临床肝胆病杂志, 2012, 28(10): 793.
[6]中华医学会肝病学分会, 中华医学会感染病学会. 慢性乙型肝炎防治指南 (2010 年版)[J]. 临床肝胆病杂志, 2011, 27(1): 113.
[7]Singh M, Dicaire A, Wakil A E, et al. Quantitation of hepatitis B virus (HBV) covalently closed circular DNA (cccDNA) in the liver of HBV-infected patients by LightCycler real-time PCR[J]. J Virol Methods, 2004, 118(2): 159.
[8]陈嵬, 吴峰, 窦晓光, 等. 慢性HBV感染者肝脏HBV cccDNA含量相关因素分析[J]. 临床肝胆病杂志, 2013 (6): 434.
[9]Levrero M, Pollicino T, Petersen J, et al. Control of cccDNA function in hepatitis B virus infection[J]. J Hepatol, 2009, 51(3): 581.
[10]Lok A S F, Lai C L, Leung N, et al. Long-term safety of lamivudine treatment in patients with chronic hepatitis B[J]. Gastroenterology, 2003, 125(6): 1714.
[11]Brunetto M R. A new role for an old marker, HBsAg[J]. J Hepatol, 2010, 52(4): 475.
[12]Wursthorn K, Lutgehetmann M, Dandri M, et al. Peginterferon alpha-2b plus adefovir induce strong cccDNA decline and HBsAg reduction in patients with chronic hepatitis B[J]. Hepatology, 2006, 44(3): 675.
[13]Maynard M, Parvaz P, Durantel S, et al. Sustained HBs seroconversion during lamivudine and adefovir dipivoxil combination therapy for lamivudine failure[J]. J Hepatol, 2005, 42(2): 279.
[14]Tangkijvanich P, Komolmit P, Mahachai V, et al. Comparison between quantitative hepatitis B surface antigen, hepatitis B e-antigen and hepatitis B virus DNA levels for predicting virological response to pegylated interferon-α-2b therapy in hepatitis B e-antigen-positive chronic hepatitis B[J]. Hepatol Res, 2010, 40(3): 269.
[15]林沪, 李元元, 王福生. 血清HBsAg和HBeAg水平变化与CHB患者抗病毒疗效预测[J]. 实用肝脏病杂志, 2013, 16(1): 82.
Dynamic observation on hepatitis B virus cccDNA in liver tissue and serological markers changes in the process of antiviral therapy
WANG Chunying1, LIU Chengyong2, ZHOU Dongqing2, WANG Ji1, YANG Qingsong1
(1.DepartmentofInfectiousDisease; 2.DepartmentofLaboratory,XuzhouInfectious
DiseaseHospital,Xuzhou,Jiangsu, 221004)
ABSTRACT:ObjectiveTo explore hepatitis B virus (HPV) covalently closed circular DNA (cccDNA) of liver tissue and levels of relative serological markers, including serum HBV cccDNA and serum HBV DNA and epatitis B surface antigen (HBsAg) quantitative and hepatitis B Antigen(HBeAg) quantitative in chronic hepatitis B (CHB) patients after antiviral treatment. MethodsEighty-eight HBeAg positive CHB viral hepatitis patients received entecavir antiviral treatment for 96 weeks. Their HBV cccDNA in liver tissue and serum HBV cccDNA, serum HBV DNA and HBsAg and HBeAg quantitative were detected respectively in 0, 24, 48 and 96 weeks. The relationship between liver tissue HBV cccDNA and serological markers was evaluated dynamically. ResultsCompared with the baseline, levels of HBV cccDNA in liver tissue,serum HBV cccDNA, HBV DNA and HbsAg decreased significantly at 24 weeks after treatment (P<0.05 or P<0.01). Levels of HBV cccDNA in liver tissue,serum HBV cccDNA and HBV DNA kept declined at 48 weeks (P<0.01).There was no significant difference in HBV cccDNA of liver tissue between 48 weeks and 96 weeks (P>0.05). Compared with those at 48 weeks, the serum HBV DNA and serum HBV cccDNA quantitative reduced significantly at 96 weeks (P<0.01). There were no significant differences in serum HBsAg and HBeAg quantitative between 48 weeks and 96 weeks (P>0.05).ConclusionThe findings indicate a higher synchronous declined in serum HBV DNA and serum HBV cccDNA quantitative than HBV cccDNA of liver tissue, serum HBsAg and HBeAg quantitative. Changes in HBV cccDNA of liver tissue, serum HBsAg and HBeAg quantitative are stabilized since 48 weeks after treatment, which may reveal a consistency between them. Quantitative detection of serum HBsAg and HBeAg may be more accurate, convenient and fast for guiding the clinical diagnosis.
KEYWORDS:hepatitis; hepatitis b virus; HBV cccDNA; HBV DNA; HBsAg; HBeAg
通信作者:刘成永, E-mail: crblt@126.com
基金项目:中国高校医学期刊临床专项资金(11520201)
收稿日期:2014-12-21
中图分类号:R 512.6
文献标志码:A
文章编号:1672-2353(2015)07-044-03DOI: 10.7619/jcmp.201507012
