NaCl胁迫对狗牙根生理生化特性的影响
2015-02-23王太亮韩兆胜庞妙甜董宽虎朱慧森
王太亮,韩兆胜,庞妙甜,董宽虎,朱慧森)
(山西农业大学 动物科技学院,山西 太谷 030801)
NaCl胁迫对狗牙根生理生化特性的影响
王太亮,韩兆胜,庞妙甜,董宽虎,朱慧森)
(山西农业大学 动物科技学院,山西 太谷 030801)
试验采用不同浓度NaCl(0、100、200、300、400、500 mmol/L)对山西野生狗牙根进行盐胁迫处理,15 d后取样测定叶绿素含量、相对含水量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)、脯氨酸、可溶性糖和可溶性蛋白等指标。结果表明:随着NaCl浓度的升高,叶绿素含量、相对含水量显著降低(P<0.05);脯氨酸、可溶性糖和可溶性蛋白含量增加;SOD和POD活性呈先升高后降低的趋势。综合分析可知,山西野生狗牙根对NaCl溶液的耐受上限为400 mmol/L,且不同部位对NaCl的敏感性不同,依次表现为叶>茎>根。
盐胁迫;野生狗牙根;生理特性
土壤盐渍化是威胁生态安全和人类生存的重要环境问题之一,也是影响农业开发和可持续发展的重大限制条件和障碍因素[1]。目前,我国盐渍土约占国土面积的1/3,选育和培育耐盐品种以适应盐渍土的环境,并最终达到改善和利用盐渍土已成为研究的焦点[2]。当植物遭受盐胁迫时表现为发育迟缓,植物组织和器官的生长和分化受到抑制,植物的发育进程提前,植物也产生了一系列生理生化的改变以调节水分及离子平衡,来维持正常的生理机能。
狗牙根(Cynodondactylon)是暖季型多年生禾草,广泛分布于温暖湿润的热带和亚热带地区,在我国主要分布在黄河以南地区,在新疆,河北等地也有野生狗牙根分布[3,4]。狗牙根适应性强、耐干旱[5]、耐践踏[6]、繁殖能力及再生能力强[7],被广泛应用于公路、庭院、足球场、高尔夫球场等场合,同时因其质地柔软、味淡、茎微甜、叶量丰富,亦可作为一种优质牧草[8],近几年,狗牙根还被开发用作生物燃料,同时也具有一定药用价值[9,10]。
目前,国内外对盐胁迫下不同品种狗牙根的形态特征、生理特性均有研究[11-14],但从狗牙根不同组织器官对盐胁迫响应的角度揭示其耐盐机制的报道较少。不同浓度NaCl处理山西野生狗牙根,比较其抗氧化酶活性,脯氨酸和丙二醛的变化,旨在为狗牙根耐盐机理的研究提供科学依据,为其作为盐碱地草坪建植材料提供理论支持。
1 材料和方法
1.1 试验地概况
试验地在山西省晋中太谷县山西农业大学动物科技学院草坪草标本区,地理位置N 37°25′,E 112°23′,海拔799 m。光、热资源比较丰富,无霜期160~175 d,属暖温带气候,土壤类型为淡褐土,pH 7.5。
1.2 供试材料
试验材料为2012年6月采自山西运城盐湖区(N 34°94′,E 110°96′,海拔325 m)的山西野生狗牙根,2013年5月,将狗牙根三节茎段扦插于沙子与珍珠岩体积比为1∶1、直径为25 cm、高为20 cm的塑料盆进行培养,昼夜温度25℃/17℃,相对湿度为65%~80%,每周用1/2 Hongland营养液进行浇灌,其余时间采用称重法补充丢失水分。30 d后,分别采用0、100、200、300、400、500 mmol/L的NaCl溶液对其进行胁迫处理,各处理3次重复。
1.3 测定指标及方法
在胁迫处理15 d后,取样并分离叶片,茎和根,除叶片的部分样品用于叶绿素及相对含水量的测定外,其余样品置于-80 ℃超低温冰箱贮存备用,用于测定POD活性(愈创木酚法),SOD活性(氮蓝四唑NBT法),SOD活性单位以抑制NBT光化学还原50%作为一个酶活性单位(U),丙二醛(硫代巴比妥酸法),脯氨酸(磺基水杨酸提取法),可溶性糖(蒽酮法)和可溶性蛋白(考马斯亮蓝法)[15]等指标。
1.4 数据处理
采用Excel 2003软件对原始数据进行处理,SAS统计软件进行方差分析。
2 结果与分析
2.1 NaCl胁迫对野生狗牙根叶绿素及相对含水量的影响
盐胁迫处理后,狗牙根叶绿素含量随着NaCl浓度的增高呈下降趋势(表1),当NaCl浓度为400,500 mmol/L时,叶绿素含量显著低于对照(P<0.05)。狗牙根地上部、地下部相对含水量均随着NaCl浓度的增高呈下降趋势,500 mmol/L NaCl处理的狗牙根地上部相对含水量显著低于其余各处理,同时地下部相对含水量最低,且与对照及100 mmol/L NaCl处理差异显著(P<0.05)。
2.2 NaCl胁迫对野生狗牙根POD、SOD活性的影响
随着NaCl浓度的增加,狗牙根不同部位的POD活性均呈现出先增加后降低的趋势(表2)。叶片中POD活性在NaCl浓度为300 mmol/L时达到最大,与对照差异显著(P<0.05),当NaCl浓度为200 mmol/L时,茎中POD活性达到最大,但与其余各处理间均无显著性差异(P>0.05);根中POD活性以400 mmol/L NaCl处理最高,显著高于对照(P<0.05)。

表1 NaCl胁迫下野生狗牙根不同部位叶绿素含量及相对含水量Table1 Chlorophyll contents and RWC in above/underground parts of wild bermudagrass under NaCl stress
注:同列不同小写字母表示差异显著(P<0.05),下同
狗牙根叶中SOD活性在500 mmol/L NaCl处理时显著高于对照及100 mmol/L NaCl处理,与其余各处理间差异不显著。根、茎中SOD活性随着NaCl浓度的增加均呈先升高后降低的趋势,在300 mmol/L时达到最大值,与对照差异显著(P<0.05)。茎中SOD活性500 mmol/L NaCl处理时最低。

表2 NaCl胁迫下野生狗牙根的POD和SOD活性Table2 POD and SOD activities in above/underground parts of wild bermudagrass under NaCl stress
2.3 NaCl胁迫对野生狗牙根MDA含量的影响
狗牙根叶和茎中的MDA含量随NaCl浓度的升高呈先增加后降低的变化趋势(表3)。当NaCl浓度为400 mmol/L时,叶中MDA含量高于其余各处理,且各处理间差异不显著(P>0.05)。茎中丙二醛含量以300 mmol/L胁迫时最高,与除200 mmol/L外的其余各处理差异均显著。根中丙二醛含量则随着NaCl浓度的升高呈现先降低再升高的趋势,500 mmol/L处理时MDA最高。
2.4 NaCl胁迫对野生狗牙根Pro含量的影响
随着NaCl浓度的升高,狗牙根各器官中的脯氨酸含量呈增加趋势(表4)。500 mmol/L NaCl胁迫处理时,根、茎、叶中的脯氨酸含量均达到最高,且与对照及中低浓度胁迫处理组间存在显著差异(P<0.05)。
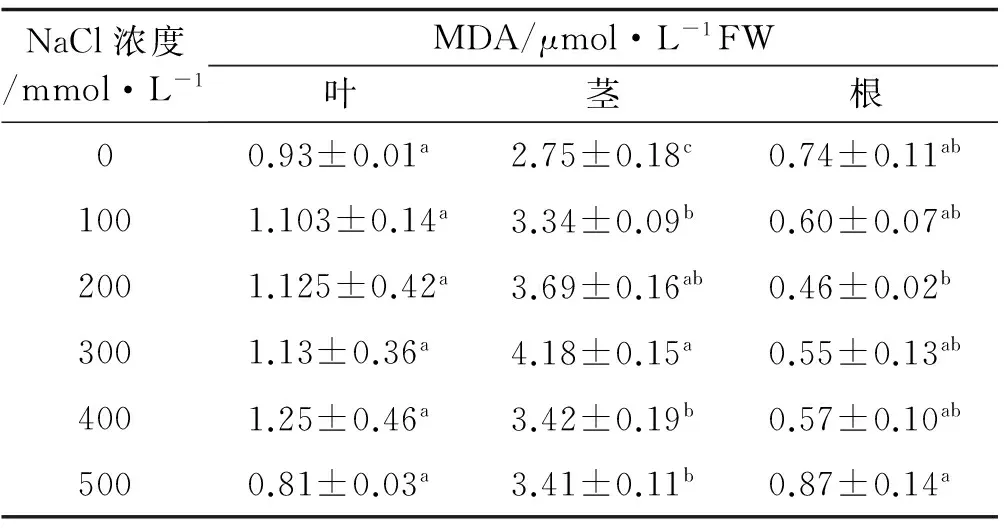
表3 NaCl胁迫下野生狗牙根丙二醛含量变化Table3 MDA contents in above/underground parts of wild bermudagrass under NaCl stress
2.5 NaCl胁迫对野生狗牙根可溶性糖和可溶性蛋白含量的影响
NaCl胁迫下狗牙根不同器官的可溶性糖含量呈现先升高再降低的趋势(表5)。当NaCl浓度为400 mmol/L时,狗牙根叶和茎中的可溶性糖含量达到最大值,与对照相比,分别增加了38.9%和71.8%。植株根部的可溶性糖含量在300 mmol/L时最大,与对照组差异显著(表5)。

表4 NaCl胁迫下野生狗牙根脯氨酸含量Table4 Proline contents in above/underground parts of wild bermudagrass under NaCl stress
叶中可溶性蛋白含量在400 mmol/L处理时显著高于其余各处理,根和茎中的可溶性糖含量则以500 mmol/L处理时最高。

表5 NaCl胁迫下野生狗牙根的可溶性糖和可溶性蛋白Table5 Soluble sugar and soluble protein contents in above/underground parts of wild bermudagrass under NaCl stress mg/g FW
3 讨论与结论
植物组织的含水量是植物生理状态的一个重要指标。在植物体内不被胶体微粒所固着的自由水参与各种代谢作用,其含量高时,代谢活动强,但抗性降低,因此,植物体内束缚水和自由水含量及其比值常与植物的抗性密切相关[16]。试验中野生狗牙根地上部和地下部相对含水量随着NaCl浓度的升高逐渐降低,500 mmol/L处理较对照分别下降23.9%和21.9%,表明高浓度盐分会促进植物细胞失水,地上部较地下部受胁迫影响大,这与Chakraborty K等[17]对不同基因型甘蓝型油菜的研究结果一致。盐胁迫下叶绿素降解,叶绿体的超微结构破坏,在抗逆生理研究中,叶绿素含量常作为反应逆境对植物造成伤害程度的生理指标之一[18]。试验中,随着NaCl浓度的升高,野生狗牙根叶绿素含量显著降低,当盐浓度达500 mmol/L时,叶绿素含量较对照下降30.1%,原因是盐胁迫提高了叶绿素酶活性,促进了叶绿素降解[19],这与秦景等[20]对沙棘幼苗的研究和周万海等[21]对甘肃红豆草的研究结果一致。
活性氧是指由氧形成、化学性质活泼、氧化能力强的几种含氧物质的总称,正常条件下,植物体内活性氧处于不断产生和清除的动态平衡之中,而一旦遭受盐、干旱、低温等逆境胁迫,这种平衡就会被破坏,活性氧水平上升。在盐胁迫下,植物体内活性氧的积累,能够破坏膜结构和功能稳定性,是引起伤害的原因之一,POD、SOD等是植物体内的保护酶系统,它们之间相互协调,共同协作,清除膜脂过氧化过程中产生的活性氧[22,23]。试验中,野生狗牙根不同部位的POD和SOD活性的变化随着NaCl浓度的增加大体呈先升高后降低的趋势,在300~400 mmol/L时达到最大值,之后开始下降,这可能是因为高盐度对狗牙根产生了离子毒害,狗牙根通过自身调节抵抗盐胁迫的能力降低,这与田晓艳等[24]对景天三七保护酶的研究和杜利霞等[25]对赖草盐胁迫的研究结果一致。
植物器官在逆境下受到伤害,通常发生膜脂过氧化作用,产生脂类过氧化物、丙二醛等,其中丙二醛是膜脂过氧化最重要的产物之一,其含量的高低反映了细胞膜脂过氧化水平[26,27]。试验中狗牙根根中的丙二醛含量随着盐浓度的升高呈现上升趋势,而叶和茎中的丙二醛升高后会略有下降,可能高盐胁迫下,地上部分膜脂氧化作用加大,部分细胞受到损伤,这与陶晶等[28]的研究结果一致。
脯氨酸是植物体内重要的有机渗透调节物质,当植物受到环境胁迫时,在体内大量积累脯氨酸,由此植物体内脯氨酸含量在一定程度上反映了植物的抗逆性[29]。试验中,野生狗牙根不同部位脯氨酸随着盐胁迫浓度的升高而增加,与董秋丽等[30]对芨芨草苗期脯氨酸的测定结果相似,说明狗牙根通过自身合成脯氨酸等渗透调节物质以适应盐渍条件。
可溶性糖和可溶性蛋白是植物在盐胁迫下重要的渗透调节物质[31]。Hameed和Ashraf[32]对不同抗盐性的两个生态型狗牙根盐胁迫的结果表明,总可溶性蛋白和可溶性糖均随着盐胁迫浓度的增加而增加。该试验中500 mmol/L NaCl处理下狗牙根根、茎、叶各组织中可溶性蛋白和可溶性糖含量均高于对照。同一胁迫浓度下,叶和茎中可溶性糖以及可溶性蛋白含量都较根中高,说明地上部分渗透调节物质在盐胁迫下相比根较为敏感。
综合各项指标测定结果分析得出,低浓度的NaCl对狗牙根各器官的生理特性没有显著影响,但随着NaCl浓度的增加,叶绿素含量、相对含水量显著降低,而渗透调节物质以及抗氧化酶活性升高,从而降低膜脂氧化程度,缓解胁迫效应。综合分析,山西野生狗牙根在NaCl浓度为400mmol/L以内时可以正常生长,各器官对NaCl的敏感程度为叶片>茎>根。
[1] 买买提·阿扎提,艾力克木·卡德尔,吐尔逊·哈斯木.土壤盐渍化及其治理措施研究综述[J].环境科学与管理,2008,33(5):29-33.
[2] 王遵亲,祝寿泉,俞仁培,等.中国盐渍土[M].北京:科学出版社,1993:2-6.
[3] Taliaferro C M.Diversity and vulnerability of bermuda turfgrass species [J].Crop Science,1995,35:327-331.
[4] 黄春琼,张永发,刘国道.狗牙根种质资源研究与改良进展[J].草地学报,2011,19(3):531-538.
[5] 王玉刚,阿不来提,齐曼.两狗芽根品种对干旱胁迫反应的差异[J].草业学报,2006(4):58-64.
[6] 戴其根,周兰胜,陈后天,等.践踏强度对不同坪床结构狗芽根地上部生长的影响[J].扬州大学学报(农业与生命科学版),2006,27(2):86-90.
[7] 叶少萍,曾秀华,辛国荣,等.不同磷水平下丛枝菌根真菌(AMF)对狗牙根生长与再生的影响[J].草业学报,2013,22(1):46-52.
[8] 林凤栖,李冠一.植物耐盐性研究进展[J].生物工程进展,2000,20(2):20-25.
[9] Xu J L,Wang Z Y,Cheng J J.Bermuda grass as feedstock for biofuel production[J].Bioresource Technology,2011,102:7613-7620.
[10] Désirée Larenas-Linnemann,Alfredo Arias Cruz,Isabel Rojo Gutierrez,etal.European and Mexican vs US diagnostic extracts of Bermuda grass and cat in skin testing[J].Annals of Allergy,Asthma & Immunology,2011,5(5):421-428.
[11] 陈静波,阎君,张婷婷,等.四种暖季型草坪草对长期盐胁迫的生长反应[J].草业学报,2008,17(5):30-36.
[12] Reza Manuchehri,Hassan Salehi.Physiological and biochemical changes of common bermudagrass (Cynodondactylon[L.] Pers.) under combined salinity and deficit irrigation stresses [J].South African Journal of Botany,2014,92:83-88.
[13] Chen J B,Yan J,Qian Y L,etal.Growth responses and ion regulation of four warm season turfgrasses to long-term salinity stress[J].Scientia Horticulturae,2009,122(4):620-625.
[14] Bauer B K,Poulter R E,Troughton A D,etal.Salinity tolerance of twelve hybrid bermudagrass[Cynodondactylon(L.) Pers.XC.transvaalensisBurtt Davy] genotypes[J].International Turfgrass Society Research Journal,2009,11:313-326.
[15] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,1999.
[16] Neto A D,Priseo J T,Filho-Eneas J,etal.Effect of salt stress on antioxidative enzymes and lipid peroxideation in leave and roots of salt-tolerant and salt-sentive maize genotypes[J].Environment and Experimental Botany,2006,56:87-94.
[17] Chakraborty K,Raj K,Sairam,etal.Differential expression of salt overly sensitive pathway genes determines salinity stress tolerance in Brassica genotypes[J].Plant Physiology and Biochemistry,2012,51(2):90-101.
[18] Xun Z,Zhang E H,Ervin A J,etal.Metabolic defense responses of seeded Bermudagrass during acclimation to freezing stress[J].Crop Science,2006,46:2598-2605
[19] 张其德.盐胁迫对植物及其光合作用的影响[J].植物杂志,2000(1):28-29.
[20] 秦景,董雯怡,贺康宁,等.盐胁迫对沙棘幼苗生长与光合生理特征的影响[J].生态环境学报,2009,18(3):1031-1036.
[21] 周万海,师尚礼,周娟娟.NaCl胁迫对甘肃红豆草生理特性的影响[J].草原与草坪,2012,32(3):1-5.
[22] 冯建灿,张玉洁,杨天柱.低温胁迫对喜树幼苗POD活性、MDA活性和脯氨酸含量的影响[J].林业科学研究,2002,15(2):197-202.
[23] 孙国荣,关炀,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J].草地学报,2001,9(1):34-38.
[24] 田晓艳,刘延吉,张蕾,等.盐胁迫对景天三七保护酶系统、MDA、Pro及可溶性糖的影响[J].草原与草坪,2009,29(6):11-14.
[25] 杜利霞,董宽虎,乔志宏,等.NaCl胁迫对赖草幼苗生理特性的影响[J].草原与草坪,2013,33(1):1-4.
[26] 汤章成.逆境条件植物脯氨酸的积累及可能的意义[J].植物生理学通讯,1984(1):15-21.
[27] Akihiro Ueda,Yuko Yamamoto-Yamane.Salt stress enhances proline utilization in the apical region of barley roots [J].Biochemical and Biophysical Research Communications,2007,3(1):61-66.
[28] Mittler R.Oxidative stress,antioxidants and stress tolerance[J].Trends Plant Science,2002(7):405-410.
[29] 陶晶,陈士刚,秦彩云,等.盐碱胁迫对杨树各品种丙二醛及保护酶活性的影响[J].东北林业大学学报,2005,33(3):13-15.
[30] 董秋丽,夏方山,董宽虎.NaCl胁迫对芨芨草苗期脯氨酸代谢的影响[J].草业学报,2010,10(5):71-76.
[31] 刘祖祺,张石城.植物抗性生理学[M].北京:农业出版社,1994:371-372.
[32] Hameed M,Ashraf M.Physiological and biochemical adaptations ofCynodon(L.) Per.(Pakistan) to salinity stress[J].Flora,2008,203:683-694.
Effect of NaCl stress on physiological characteristics of bermudagrass
WANG Tai-liang,HAN Zhao-sheng,PANG Miao-tian,DONG Kuan-hu,ZHU Hui-sen
(CollegeofAnimalScienceandTechnology,ShanxiAgriculturalUniversity,Taigu030801,China)
The wild bermudagrass originated from Shanxi Province was selected as the test materials,and treated by different concentrations of NaCl (0,100,200,300,400,500 mmol/L).After treated for 15 days,the contents of chlorophyll,relative water,soluble sugar,soluble protein,proline,MDA and enzyme activities of SOD and POD were tested.Results showed that with the NaCl concentration increasing,relative water and chlorophyll contents decreased significantly (P<0.05),contents of proline,soluble sugar and soluble protein increased obviously,SOD and POD activities presented a tendency of elevated first and then decreased.It suggested that wild bermudagrass could grow normally under NaCl stress at concentration of 400 mmol/L.The order of sensitiveness to salt stress was leaf >stem>root.
salt stress;wild bermudagrass;physiological characteristics
2014-11-10;
2015-01-04
中国博士后科学基金项目(124434);山西省科技攻关项目(20120311015-3)资助
王太亮(1988-),男,山东海阳人,在读硕士。 E-mail:wangtailiang0714@163.com 朱慧森为通讯作者。
Q 945.78
A
1009-5500(2015)01-0063-05
