转化生长因子-β1抗体对人翼状胬肉成纤维细胞增殖及 TGF-β1-Smad4信号转导通路的影响
2015-02-23薛雨顺石一宁
石 蕊,杨 乐,薛雨顺,石一宁
(陕西省人民医院眼科,陕西西安 710068)
◇基础研究◇
转化生长因子-β1抗体对人翼状胬肉成纤维细胞增殖及 TGF-β1-Smad4信号转导通路的影响
石 蕊,杨 乐,薛雨顺,石一宁
(陕西省人民医院眼科,陕西西安 710068)
目的 探讨转化生长因子-β1(TGF-β1)抗体对体外培养的翼状胬肉成纤维细胞增殖的抑制作用及对TGF-β1-Smad4信号转导通路的影响,评估其在翼状胬肉发病机制中的作用。方法 人翼状胬肉切除后,体外培养其成纤维细胞并传至4~6代时,分别用6.25、12.5、25、50 mg/mL TGF-β1抗体处理24、48、72 h,采用MTT法检测成纤维细胞的生长抑制率,RT-PCR检测TGF-β1mRNA表达,Western blot检测Smad4蛋白的表达。所得数据采用SPSS19.0统计软件处理。结果 TGF-β1抗体可不同程度抑制成纤维细胞的增殖;TGF-β1抗体处理组TGF-β1mRNA的表达明显低于对照组,且不同浓度组间差异有统计学意义(P<0.05),随着浓度增大和作用时间延长,TGF-β1抗体处理组TGF-β1mRNA的表达量呈逐渐降低趋势。不同浓度的TGF-β1抗体对Smad4的蛋白表达具有明显增强作用,且各组间差异有统计学意义(P<0.05)。结论 TGF-β1抗体对人翼状胬肉体外培养的成纤维细胞生长具有明显抑制作用,其可能通过调节TGF-β1和Smad4的表达而实现。
翼状胬肉;成纤维细胞;体外培养;TGF-β1抗体;TGF-β1;Smad4
1 材料与方法
1.1 一般资料 收集2013年1月至2月于陕西省人民医院眼科手术切除的鼻侧原发性翼状胬肉10例,年龄 40~70岁,男性5例,女性5例。
1.2 标本制作及细胞培养 取手术切除翼状胬肉并分离出结膜下组织,置入加有庆大霉素的取样管中备用。采用组织块贴壁法进行培养。将组织剪切成1 mm3左右的碎块,2.5 g/L胰蛋白酶消化、终止消化、离心,间距约0.5 cm均匀地接种于培养皿中,加培养液,37 ℃、50 mL/L CO2细胞培养箱中培养,48~72 h之后,可见细胞爬出,换液,此后每3~4 d换液,约1周左右细胞融合成片,铺满瓶底,用2.5 g/L胰蛋白酶消化传代,利用细胞消化排除法及差速贴壁法,纯化PFB,实验所用为4~6代细胞。倒置相差显微镜观察记录不同时期细胞的生长特点及形态,SP 法行人波形蛋白单克隆抗体检测及细胞鉴定。
1.3 细胞分组 取对数生长期PFB,调整细胞密度为1×105个/mL,每孔加入200 μL细胞悬液,接种于96孔板中培养24 h,共设4组,实验组加入TGF-β1抗体使各组药物终末质量浓度分别为6.25、12.5、25、50 mg/mL,同时设阴性对照组(培养液+细胞)及空白对照(培养液)。
1.4 细胞增殖观察 分别培养24、48、72 h,每孔加入5 mg/mL的MTT溶液20 μL,CO2培养箱中继续孵育4 h,终止培养,小心吸去上清,每孔加入150 μL的DMSO,置摇床上低速震荡10 min,结晶物质充分溶解后,自动酶标仪490 nm处测定吸光度(A)值。实验重复3次,并计算抑制率(IR),计算公式为IR(%)=(对照组A值-实验组A值)/对照组A值×100%。并绘制量效时效关系曲线。
1.5 检测TGF-β1mRNA水平 各组细胞分别干预24、48、72 h后,用Trizol试剂盒提取PFB细胞总RNA,紫外分光光度仪测定并计算样品总RNA浓度。按照逆转录反应试剂盒建立20 μL反应体系进行PCR扩增,TGF-β1引物序列上游为5′-CTGCTTCAGCTCCACAGAGAAGA-3′,下游为5′-AAGTTGGCGTGGTAGCCCTT-3′,引物片段长度为111 bp,反应完成后取10 μL PCR反应液,经10 g/L琼脂糖凝胶电泳,用PCR Marker作相对分子质量标准。以Gel Doc 1000凝胶分析仪分析扫描各条带,以β-actin基因作内参照,测定各处理组和对照组mRNA的相对表达量。
1.6 Western blot检测Smad4蛋白的表达 各组细胞分别干预48、72 h后,提取总蛋白并以考马斯亮蓝法测定样品蛋白浓度(按试剂盒说明操作)。用样品缓冲液调整样品质量浓度为1 g/L,水浴箱中变性5 min,每孔20 μL样品进行稳压电泳。转膜、抗体孵育,Smad4与β-actin均1∶1 000稀释。常规显影定影,拍照图像用灰度扫描软件取得目的条带灰度值,分析相对灰度值。
1.7 统计学分析 采用SPSS 19.0软件处理数据,数据以均数±标准差表示,各组间数据比较采用t检验和单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 倒置相差显微镜下观察体外培养的PFB 组织接种2 h后组织块开始贴壁,24 h后逐渐向周围生长,细胞呈圆形、三角形(图1A),48 h后逐渐向周围生长,表现为长梭形(图1B),3 d后细胞生长加快,数量增多,细胞完全融合后排列紧密,呈螺旋状、放射状排列,在显微镜下从形态上初步认定为PFB。免疫荧光染色示波形蛋白表达阳性,结合细胞生长形态及特征,鉴定为PFB(图1C)。
2.2 MTT比色法检测细胞增殖抑制情况 6.25、12.5、25、50 mg/mL TGF-β1抗体组随浓度增加,TGF-β1抗体对细胞的抑制率增强,随着时间(24、48、72 h)的延长,相同浓度的TGF-β1抗体对细胞的抑制率也增强;各实验组与阴性对照组比较,差异有统计学意义(P<0.05,表1、图2)。
2.3 不同浓度TGF-β1抗体对TGF-β1mRNA及Smad4蛋白表达的影响 TGF-β1抗体处理组TGF-β1mRNA的表达明显低于阴性对照组,随着浓度的增加同一时间点TGF-β1mRNA的表达量逐渐降低,差异有统计学意义(P<0.05,图3);TGF-β1抗体处理组Smad4的表达量明显高于阴性对照组,且随着浓度增加,表达逐渐增高,差异具有统计学意义(P<0.05,图4)。
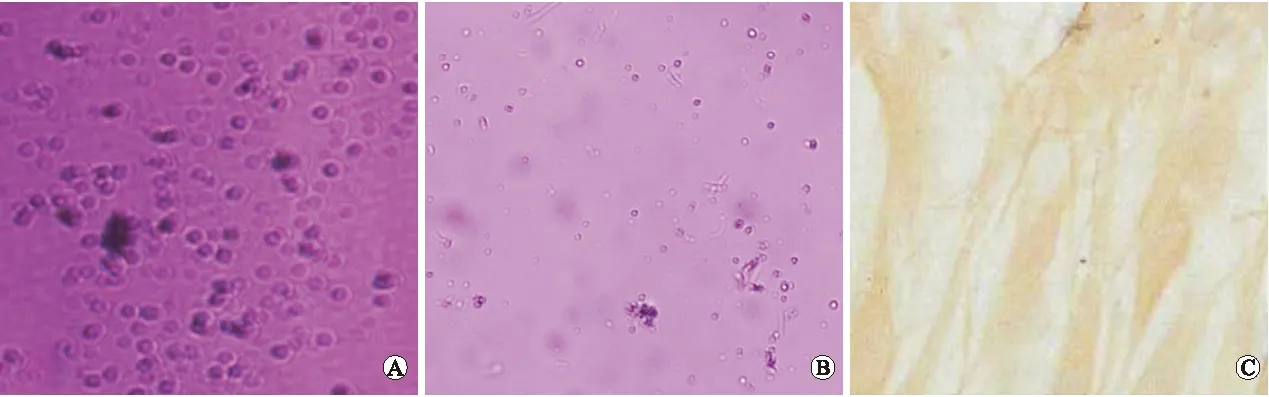
图1 不同时间点倒置显微镜下PFB形态及免疫组化鉴定结果
Fig.1 The morphology and immunohistochemical identification of PFB under inverted microscope at different time points
A、B:倒置显微镜下(×200),接种后24 h(A)、48 h(B);C:免疫组化鉴定波形蛋白表达阳性(×400)。
表1 MTT比色法观察TGF-β1抗体对PFB的抑制作用(吸光度和抑制率)
Tab.1 The inhibitory effects of TGF-β1antibody on pterygium fibroblasts detected with MTT
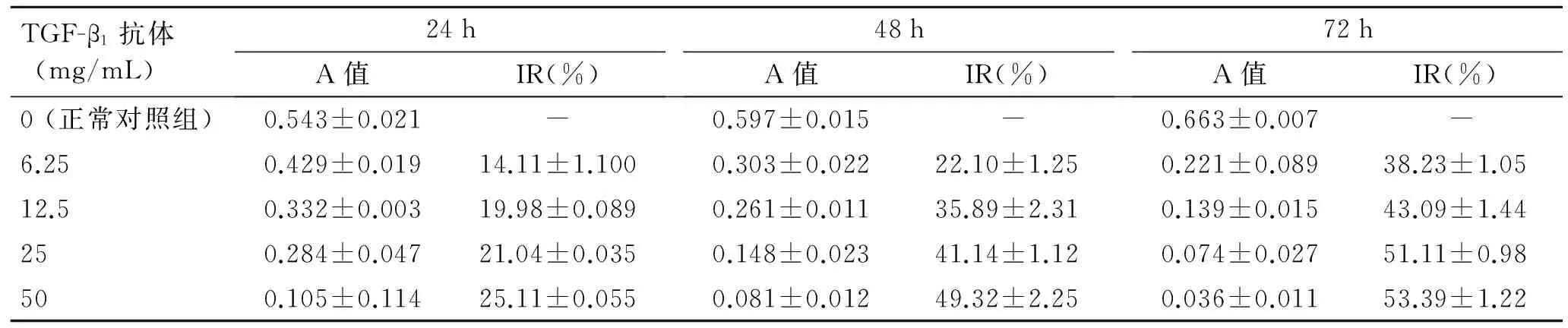
TGF-β1抗体(mg/mL)24hA值IR(%)48hA值IR(%)72hA值IR(%)0(正常对照组)0.543±0.021-0.597±0.015-0.663±0.007-6.250.429±0.01914.11±1.1000.303±0.02222.10±1.250.221±0.08938.23±1.0512.50.332±0.00319.98±0.0890.261±0.01135.89±2.310.139±0.01543.09±1.44250.284±0.04721.04±0.0350.148±0.02341.14±1.120.074±0.02751.11±0.98500.105±0.11425.11±0.0550.081±0.01249.32±2.250.036±0.01153.39±1.22
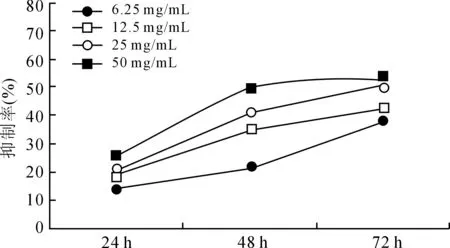
图2 不同浓度TGF-β1抗体在不同时间对PFB抑制作用的量效时效关系曲线
Fig.2 Dose-time-effect relationship of TGF-β1antibody in inhibiting pterygium fibroblasts at different time point and dose
3 讨 论
翼状胬肉的病理学特征为组织的过度增殖,主要由增生的PFB及大量新生血管组织组成[3],目前的发病机制尚不清楚。近年研究表明:翼状胬肉的发生发展可能与多种细胞因子(cytokines, CKs)的异常表达有关,其中TGF-β1及信号转导的经典通路——TGF-β-Smad信号通路在翼状胬肉的发生机制中备受关注[4-5]。TGF-β1的功能主要包括调节细胞生长、分化,诱导凋亡,抑制生长,其在生物体内大部分以前体形式存在,以无活性或潜活性形式分泌,必须结合相应受体后才能发挥相应的生物学作用,而其后的信号传递由受体后信号分子Smad4蛋白完成。不同浓度的TGF-β1对细胞增殖具有双重调节作用,其下游信号转导蛋白Smad4的缺失在肿瘤发展中可解除TGF-β1信号途径的生长抑制效应,而翼状胬肉的生长同样与TGF-β-TGF-βR-Smad信号通路表达紊乱密切相关[1]。
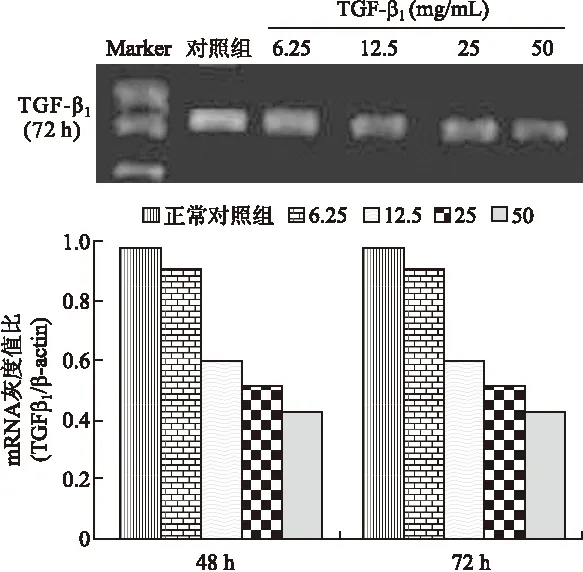
图3 RT-PCR检测 TGF-β1mRNA在不同浓度TGF-β1抗体干预组中的表达情况
Fig.3 The expression of TGF-β1mRNA in different TGF-β1treatment groups detected with RT-PCR
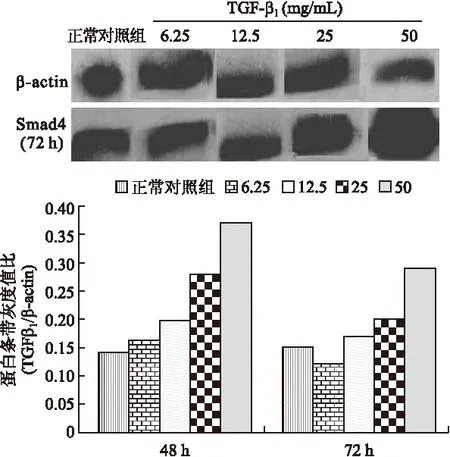
图4 Western blot 检测Smad4蛋白在不同浓度TGF-β1抗体干预组中的表达情况
Fig.4 The expression ofSmad4 protein in different TGF-β1treatment groups detected with Western blot
我们前期研究发现,TGF-β1在翼状胬肉组织中大量表达,而Smad4蛋白低表达[6];另外高浓度的TGF-β1还可不断刺激PFB生长,导致细胞基质的过度沉积[7-8]。翼状胬肉目前治疗主要以手术切除为主[9-10],同时联合使用多种抗增殖药物[11-12],但均存在一定的复发率且不能早期抑制其生长而避免手术,增加了患者痛苦。因此,探讨抑制增殖并对正常组织没有明显毒性的药物具有较大的临床意义[13-14]。本研究用TGF-β1抗体阻断TGF-β1表达,观察PFB的生长抑制情况,结果提示:实验组较对照组PFB生长明显受到抑制,且浓度越高,抑制率越高;同时显示PFB在TGF-β1抗体干预后TGF-β1mRNA的表达明显降低,且随着作用时间延长和作用浓度增加,TGF-β1mRNA变化越明显,不同干预组间表达差异有统计学意义;另一方面,随着TGF-β1抗体浓度的增加,在抑制TGF-β1表达的同时,上调了Smad4 的表达。该结果进一步验证我们前期的研究:翼状胬肉的产生与TGF-β-TGF-βR-Smad通路的功能紊乱密切相关,其中可能存在下游通路Smad4蛋白表达的减少或缺失,提示TGF-β1抗体可有效抑制PFB生长,通过下调TGF-β1的表达或补充Smad4可能重建TGF-β-TGF-βR-Smad信号转导通路,可作为临床治疗药物的靶向指标之一。但是,由于PFB为离体培养,故暂不能完全模拟翼状胬肉生长的病理状态,且对于TGF-β-TGF-βR-Smad的通路下游信号的表达情况还需进一步深入研究。
[1] TURAN-VURAL E, TORUN-ACAR B, KIVANE SA, et al. The effect of topical 0.05% cyclosporine on recurrence following pterygium surgery[J]. Clin Ophthalmol, 2011, 5(6):881-885.
[2] 石一宁,张纯涛. TGF-β1、TGF-βⅡR及Smad4蛋白在原发性翼状胬肉中的表达[J]. 眼科新进展,2010, 30(5):430-437.
[3] LIVEZEANU C, CRITOIU MM, MNESCU R, et al. Angiogenesis in the athogenesis of pterygium[J]. Rom J Morphol Embryol, 2011, 52(3):837-44.
[4] 孙重,柯敏. MMP、TGF-β1在翼状胬肉中的表达及其意义[J]. 武汉大学学报:医学版, 2007, 28(1):44-46.
[5] 罗丽娟,周辉. 翼状胬肉中MMP-2,TIMP-2和TGF-β1的表达意义[J]. 国际眼科杂志, 2008, 8(7):1350-1352.
[6] 王守立,杨光华,步宏,等. 转化生长因子β1及其受体和Smad2、Smad4蛋白在横纹肌肉瘤中的表达[J]. 中华病理学杂志, 2004, 33(2):160-161.
[7] 陈伟,付小兵,葛世丽,等. 增生性瘢痕形成和成熟过程中TGF-β1、TGF-β3及其受体的基因表达[J]. 中华整形外科杂志, 2004, 7(20):308-309.
[8] SHRESTHA A, BHANDARI S, MAHARJAN N, et al. Inferior conjunctival autografting for pterygium surgery: an alternative way of preserving the glaucoma filtration site in far western Nepal[J]. Clin ophthalmol (Auckland, NZ), 2011, 6(2):315-319.
[9] KAWANO H, KAWANO K, SAKAMOTO T. Separate limbal-conjunctival autograft transplantation using the inferior conjunctiva for primary pterygium[J]. Oman J ophthalmol, 2011, 4(3):120.
[10] CELEVA MARKOVSKA V, STANKOVIC BABIC G, ZDRAVKOVSKA JANKULOSKA M. Comparative study of pterygium surgery[J]. Section of Biological and Medical Sciences, 2011, 32(2):273-287.
[11] THAKUR SK, KHAINI KR, PANDA A. Role of low dose mitomycin C in pterygium surgery[J]. Nepal J Ophthalmol, 2012, 4(7):203-205.
[12] BEKIBELE CO, ASHAYE A, OLUSANYA B, et al. 5-Fluorouracil versus mitomycin C as adjuncts to conjunctival autograft in preventing pterygium recurrence[J]. Int ophthalmol, 2012, 32(1):3-8.
[13] 于静,张明昌. 丁酸钠对翼状胬肉成纤维细胞增殖的抑制作用[J]. 眼视光学杂志, 2007, 9(4):235-239.
[14] 王嘉宁,郭宁.细胞凋亡的检测技术与方法[J]. 中国药理学与毒理学杂志, 2005, 12, 19(6):477-470.
(编辑 国 荣)
Effects of TGF-β1antibody on human pterygium fibroblasts proliferation and TGF-β1-Smad4 signaling pathway
SHI Rui, YANG Le, XUE Yu-shun, SHI Yi-ning
(Department of Ophthalmology, Shaanxi Provincial People’s Hospital, Xi’an 710068, China)
Objective To investigate the effects of transforming growth factor-β1(TGF-β1) antibody on pterygium fibroblasts proliferationinvitroand TGF-β1-Smad4 signaling pathway to assess the related mechanisms. Methods Pterygium was culturedinvitroafter cut from the eyes, and the fibroblasts were subcultured continuously for 4-6 passages, which were then handled by different concentrations of TGF-β1antibody for 24, 48 and 72 h, respectively. The inhibition rate of TGF-β1antibody on pterygium fibroblasts was observed with MTT, and the expression of TGF-β1mRNA was observed with RT-PCR. Western blot was used to detect the expression of Smad4 protein. The data were processed with SPSS 19.0 software. Results Different concentrations of TGF-β1antibody had a different inhibitory effect on the proliferation of pterygium fibroblasts. The expression of TGF-β1mRNA was significantly lower in treatment groups than that in control group, and it differed significantly found among all the treatment groups (P<0.05). The higher the dose and the longer the time, the lower expression of TGF-β1mRNA became. Different dose of the antibody could increase the expression of Smad4 protein, and there were significant differences among the treatment groups (P<0.05). Conclusion TGF-β1antibody has significantly inhibitory effects on the proliferation of pterygium fibroblastsinvitro. The effects may be partially related to regulating the expressions of TGF-β1and Smad4.
pterygium; fibroblast;invitroculture; transforming growth factor-β1(TGF-β1) antibody; TGF-β1; Smad4翼状胬肉(pterygium)为临床常见的眼表疾病之一,治疗后复发率高是其主要临床特点。据文献报道,角膜表面及结膜下翼状胬肉组织的残留是术后复发的基础[1],而残留组织细胞学检测以成纤维细胞为主。因此,抑制翼状胬肉成纤维细胞(pterygium fibroblasts, PFB)的增殖对预防翼状胬肉的发生具有十分重要的意义。前期研究发现,PFB中表达的转化生长因子-β1(transforming growth factor-β1, TGF-β1)介导的细胞转导经典通路TGF-β-Smad4可能在翼状胬肉的生长中发挥着重要作用[2]。本研究通过体外培养人PFB,并以不同浓度的TGF-β1抗体阻断该信号转导通路的表达,以正常结膜培养的成纤维细胞为对照,观察PFB的增殖、TGF-β1mRNA及Smad4蛋白表达情况,以明确翼状胬肉发生机制并为药物治疗翼状胬肉及减少术后复发提供新的治疗思路。
2013-12-19
2014-03-06
陕西省科技厅社会发展攻关计划项目资助(2013k12-17-02) Supported by the Social Development Research Project of Department of Science and Technology of Shaanxi Province (2013k12-17-02)
石蕊. E-mail: vivianlio@163.com
R751
A
10.7652/jdyxb201501018
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.0921.011.html(2014-11-19)
