大鼠弥漫性轴索损伤后大脑皮层rab10的表达及意义
2015-02-23赵永林宋锦宁马旭东张斌飞张明李丹东庞宏刚
赵永林,宋锦宁,马旭东,张斌飞,张明,李丹东,庞宏刚
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
◇专题研究◇
大鼠弥漫性轴索损伤后大脑皮层rab10的表达及意义
赵永林,宋锦宁,马旭东,张斌飞,张明,李丹东,庞宏刚
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
目的 研究大鼠弥漫性轴索损伤(diffuse axonal injury, DAI)后小G蛋白rab10在大脑皮层的表达变化规律,探讨DAI后rab10在神经修复中的作用及意义。方法 采用头颅瞬间旋转损伤装置建立大鼠DAI模型,随机分为1 d、3 d、7 d组及对照组。采用Gless嗜银染色和TUNEL染色分别观察DAI后神经轴索形态和凋亡变化;采用Western blot、免疫组化等方法检测大鼠大脑皮层rab10的分布及表达,并采用免疫荧光双标染色分析大脑皮层神经元内rab10的表达变化。结果 嗜银染色显示DAI后1 d神经轴索形态损伤最严重,3~7 d时损伤逐渐减轻;TUNEL染色显示DAI后1 d凋亡细胞数开始升高,3~7 d时凋亡数量更高,呈迟发性改变。Western blot及免疫组化结果均提示DAI后1 d大脑皮层rab10的表达显著增加,3 d后稍降低,7 d后明显降低,但仍高于正常(P<0.05);免疫荧光双标染色提示正常神经元内几乎不表达rab10,DAI后神经元内rab10表达在1~3 d较高,7 d时较前降低。结论 大鼠DAI后大脑皮层rab10表达水平先增加,随后降低;神经元内rab10的表达变化可能与DAI后神经轴索修复有关。
弥漫性轴索损伤;rab10;神经元;皮层;大鼠;颅脑损伤;细胞凋亡
脑损伤后神经修复和结构的重塑,一直是神经科学和康复科学研究的热点和难点。弥漫性轴索损伤后受损轴索的修复和再生是保证患者预后良好的关键,但内源性修复的机制仍不明确。Rab家族是小G蛋白家族的一个亚族,与其他分子结合后一起参与调控囊泡运输和笼形蛋白的形成,在囊泡介导的内吞及合成蛋白质的运输过程中有重要作用。Rab10是Rab家族的一员,在神经元发育过程中参与调控轴突生长及神经元的极化。神经元内膜性囊泡沿着有极性的微管调控轴浆运输,DAI后微管丢失导致轴浆膜性囊泡快速运输障碍,从而加剧特征性轴索肿胀。Rab10作为细胞内囊泡转运的调控者,其在DAI后的表达变化及意义尚不明确,本研究采用头颅瞬间旋转损伤建立大鼠DAI模型,观察DAI后神经轴索形态变化及细胞凋亡情况,并检测DAI后大脑皮层rab10的变化趋势,探讨DAI后rab10表达变化的意义,进一步揭示DAI的病理机制。
1 材料与方法
1.1 实验动物及主要试剂和仪器 相同遗传背景的健康成年雄性SD大鼠120只,体质量250~300 g,由西安交通大学医学院实验动物中心提供,该实验伦理经西安交通大学医学院生物医学伦理委员会批准。蛋白提取试剂盒(中杉金桥,中国);rab10兔多克隆抗体(博奥森,中国);neuN小鼠单克隆抗体(Millipore,美国);辣根过氧化物酶标记的IgG二抗(Santa Cruz,美国);FITC、CY3标记的羊抗兔/小鼠荧光二抗(博奥森,中国);PVDF膜(Millipore,美国);凝胶成像系统(JS-380A,中国);图像采集与分析系统(Leica-Q550CW,德国);荧光显微镜(OLYMPUS,日本);SPSS16.0统计软件(美国)。
1.2 实验动物分组 选取健康成年雄性SD大鼠,随机分为假手术组和模型组,假手术组30只,模型组又分为伤后1 d、3 d、7 d亚组,每亚组30只。
1.3 大鼠DAI模型的建立
研制的大鼠头颅瞬间旋转损伤装置制备大鼠DAI模型:各组大鼠经100 g/L水合氯醛麻醉(0.2~0.3 mL/100 g)后,固定于旋转装置上。模型组大鼠苏醒后出现较剧烈挣扎,在挣扎间歇期,按动扳机,致其头颅瞬间旋转90°,重复8次。假手术组大鼠苏醒后即从装置上卸下。模型组在预定时间、假手术组在观察6 h后,用100 g/L水合氯醛腹腔麻醉,快速开胸,左心室插管至主动脉,灌注9 g/L生理盐水至流出液清亮后,换40 g/L多聚甲醛溶液灌注,灌注完成后迅速取脑。
1.4 Gless嗜银染色 各组大鼠于预定时间点灌注生理盐水及40 g/L多聚甲醛后取脑,标本置于多聚甲醛溶液中继续固定48 h。常规石蜡包埋,切片厚10 μm,常规脱蜡、梯度乙醇水化。蒸馏水浸泡,5 min×3次,37 ℃ 200 g/L硝酸银溶液避光浸染3 h,蒸馏水清洗;100 mL/L甲醛溶液还原,5 min×2次后蒸馏水浸泡,擦干水分,置于银氨溶液内避光浸染37 ℃,4 min。100 mL/L甲醛溶液还原如前,蒸馏水清洗,50 g/L硫代硫酸钠固定5 min,常规乙醇脱水、二甲苯透明、中性树胶封片。于Leica-Q550CW图像采集与分析系统上采集、分析图片。
1.5 TUNEL染色 各组大鼠于预定时间点灌注取脑,方法如前。常规石蜡包埋,切片厚4 μm,常规脱蜡、梯度乙醇水化。按照TUNEL凋亡试剂盒提供步骤进行TUNEL染色。于Leica-Q550CW图像采集与分析系统上采集、分析图片,每张切片随机选取6个高倍视野(×400),计算TUNEL阳性神经元。
1.6 免疫组织化学法检测rab10表达 取石蜡切片,厚4 μm,脱蜡水化如前,高压修复抗原。山羊血清室温封闭30 min后,滴加兔多克隆抗rab10抗体(1∶100),4 ℃过夜。生物素化二抗37 ℃孵育30 min后,辣根酶标记链霉卵白素37 ℃孵育30 min。DAB显色、苏木素溶液复染,脱水、封片。光镜下观察,Leica-Q550CW图像分析系统采集图像。每张切片随机选取6个视野(×200),Image-Pro Plus 6.0对rab10进行免疫组化半定量分析。
1.7 免疫荧光双标染色检测rab10的表达 生理盐水灌注大鼠,取完整脑组织,置于液氮表面,迅速冰结成块,保存于-80 ℃冰箱,OCT包埋,切片。切片置于冰丙酮中10 min固定,PBS清洗,5 min×3次,滴加兔多克隆抗rab10(1∶200),小鼠单克隆抗NeuN(1∶200),4 ℃过夜,PBS洗片,5 min×5次。滴加FITC、CY3标记的抗兔/鼠荧光二抗(1∶200),室温避光孵育2 h,PBS洗片,5 min×3次。DAPI复染10 min,自来水冲洗。甘油缓冲液封片,于荧光显微镜下观察结果并拍照。用Photoshop CS5对荧光照片merge。
1.8 Western blot检测蛋白表达 各组大鼠于预定时间点灌注取脑,取皮层,加入裂解液制成组织匀浆,用Bio-Rad试剂盒测定蛋白含量,蛋白煮沸变性后取50 μg蛋白样品,用SDS-PAGE电泳半干法转移至PVDF膜,将膜放入50 g/L脱脂牛奶中,37 ℃封闭2 h,加入rab10(1∶500),β-actin(1∶1 000),4 ℃孵育过夜,TBST缓冲液洗膜,将膜与辣根过氧化物酶标记的抗兔IgG(1∶5 000)和抗鼠IgG(1∶5 000)室温孵育1 h,洗膜3次,用增强化学发光法观察显影,凝胶成像系统拍照,Quantity One 4.6软件作定量分析。
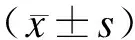
2 结 果
2.1 Gless嗜银染色结果 假手术组和DAI组比较,脑组织结构清晰,神经纤维排列整齐,表面光滑。DAI后1 d,皮层内轴索扭曲、肿胀,呈串珠状、波浪状改变,并可见轴索断裂后形成的轴索收缩球,3 d时肿胀的轴索数目较前减少,轴索直径减小,仍可见轴索球,7 d时神经纤维结构较前清晰,仍有少量神经轴索肿胀(图1)。
2.2 DAI后细胞凋亡(TUNEL染色)情况 光镜下可见非凋亡细胞的核呈蓝色;凋亡细胞明显固缩,核致密,深染为棕黄色,核周多有棕黄色多叶状或新月状颗粒;假手术组有少许细胞核被深染为棕黄色,单个高倍视野凋亡细胞数(1.23±0.57)个。DAI后1 d
开始出现大量TUNEL染色阳性细胞,单个高倍视野有阳性标记细胞(15.2±2.7)个,3 d时达到(29.3±2.9)个,7 d时仍然存在大量阳性细胞(27.46±2.39)个。DAI组的凋亡细胞数明显多于假手术组,方差分析显示各组凋亡细胞数比较差异有统计学意义(F=96.52,P=0.002,图2)。
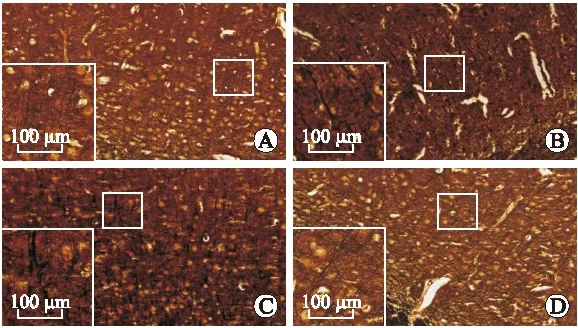
图1 假手术组与DAI组大脑皮层Gless嗜银染色
Fig.1 Photomicrographs by Gless’ silver impregnation technique in cerebral cortex of control rats and rats subjected to DAI
A:假手术组皮层;B~D:分别为DAI后1 d、3 d、7 d皮层。
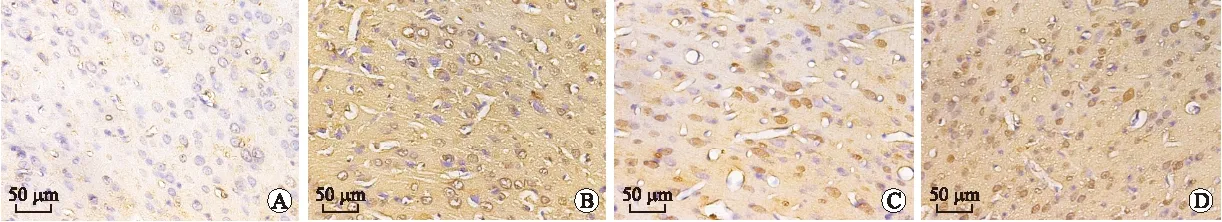
图2 假手术组与DAI组大脑皮层TUNEL染色
Fig.2 Photomicrographs by TUNEL staining in cerebral cortex of control rats and rats subjected to DAI
A:假手术组皮层;B~D:分别为DAI后1 d、3 d、7 d皮层。
2.3 Western blot检测DAI后大鼠大脑皮层rab10的动态表达结果 DAI后1 d组rab10蛋白的表达明显高于假手术组,随着时间的延长,rab10蛋白的表达逐渐减少,7 d时仍高于正常(P<0.05)。方差分析显示rab10的表达在各组间比较差异有统计学意义(F=56.45,P=0.002,图3)。
2.4 免疫组化法检测DAI后大鼠大脑皮层rab10的分布与表达 假手术组的皮层内有少量表达rab10表达,且染色浅淡。DAI后皮层内rab10表达升高,胞质内染色深,范围广。DAI后1 d rab10的表达高于假手术组(P<0.05),DAI后3 d 较1 d稍降低(P<0.05),到了伤后7 d,rab10的表达较前明显降低,但仍高于假手术组(P<0.05)。方差分析显示rab10的表达在各组间比较差异有统计学意义(F=148.34,P=0.001,图4)。
图3 DAI后不同时间点rab10的表达及灰度分析
Fig.3 The expression and gray value of rab10 in cerebral cortex of control rats and rats subjected to DAI
DAI组与假手术组比较,*P<0.05。
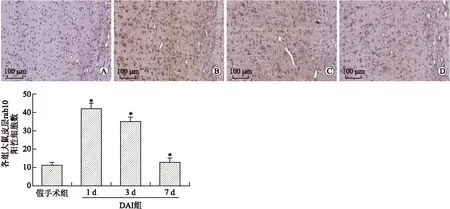
图4 DAI后大脑皮层中rab10的表达
Fig.4 The expression of rab10 in cerebral cortex of control rats and rats subjected to DAI
A:假手术组皮层;B~D:分别为DAI后1d、3d、7d皮层。DAI组与假手术组比较,*P<0.05。
2.5 DAI后大鼠皮层rab10与neuN的免疫荧光双标染色 假手术组大鼠大脑皮层的rab10表达较少,DAI组rab10表达先升高,随后降低。NeuN为神经元的标记物,假手术组神经元内几乎不表达rab10,DAI后神经元内rab10的表达(黄色)呈先升高后降低的趋势(图5)。
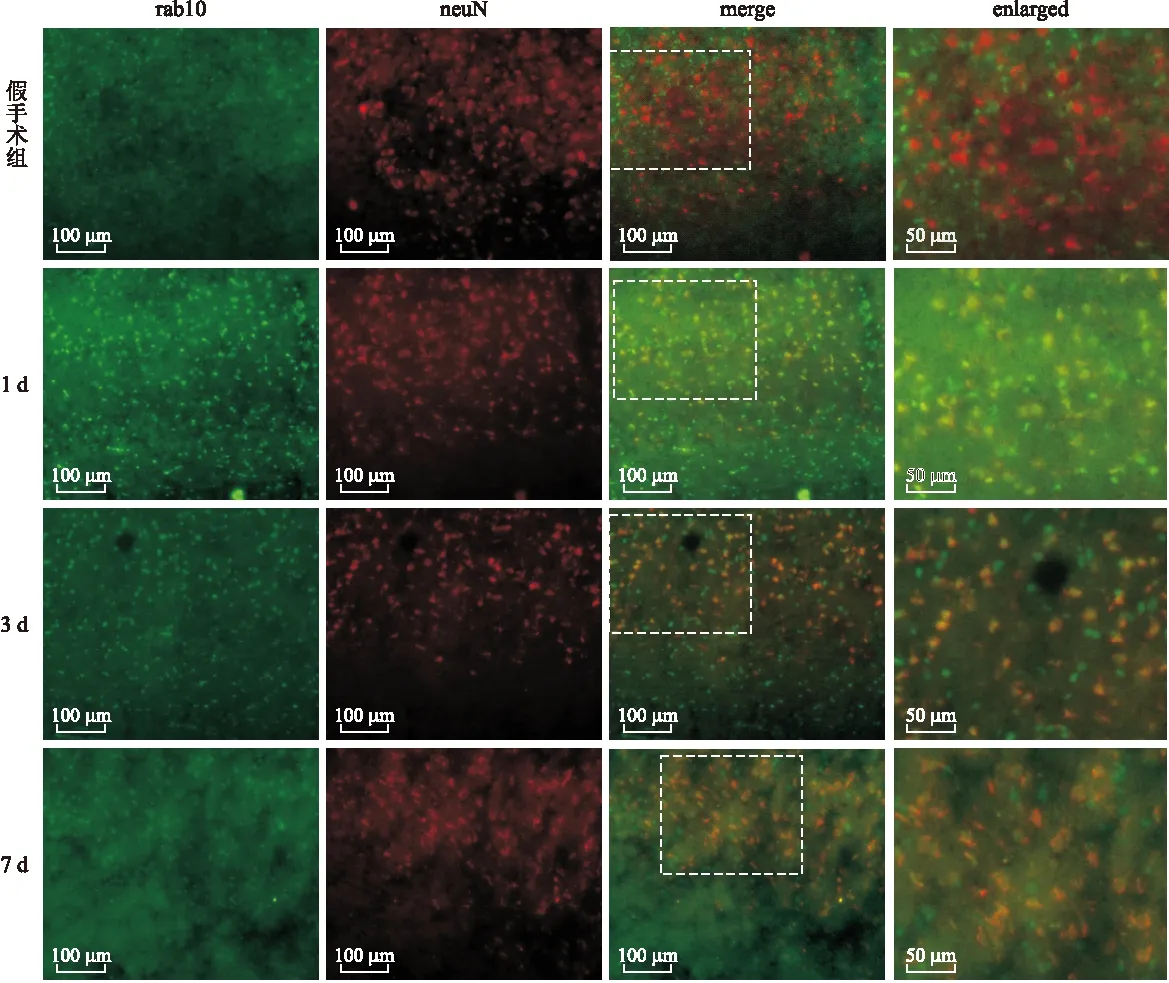
图5 大鼠弥漫性轴索损伤后不同时间点rab10和neuN的免疫荧光双标染色
Fig.5 The expression and co-localization of rab10 and neuN in rats after DAI were evaluated by immun of luorescence staining at different time
绿色荧光代表rab10,红色荧光代表neuN,二者merge后重叠部分为黄色。
3 讨 论
弥漫性轴索损伤病理过程呈进行性发展变化,由最初轴索膜局部通透性增大和轴索内超微结构异常逐渐进展为轴索迟发性断裂,形态学上表现为神经轴索扭曲、肿胀,呈串珠状、波浪状改变,随后轴索断裂、轴索收缩球形成,轴索的形态及分子病理学改变能够逆行引起神经元胞体的变化,此变化可能是以细胞凋亡为主,损伤最初不明显,随着轴突受损后细胞内异常的生物活动瀑布样爆发,呈迟发性改变[2]。本实验利用Gless 嗜银染色发现大鼠DAI后皮层神经轴索扭曲、肿胀、轴索断裂、轴索收缩球形成在伤后1 d严重,随后逐渐恢复。TUNEL染色显示DAI后随着时间延长,皮层凋亡细胞数逐渐增加,呈迟发性改变。嗜银染色及TUNEL染色结果与既往研究结果一致[3]。
小G蛋白家族是一个GTP结合的蛋白家族,rab是其亚家族之一,以单体形式普遍存在于真核细胞中。新合成的蛋白质从内质网运输到高尔基复合体及分泌性囊泡都需要载运囊泡的参与,而rab家族参与了囊泡的形成、转运、锚定和融合等过程[4-5]。研究发现脂肪细胞受到胰岛素刺激后,rab10和Myosin-Va相互作用,参与葡萄糖转运蛋白4(glucose transporter 4, GLUT4)存储囊泡的转运和在细胞膜上的锚定,并且rab10的效应器GDI(guanine-nucleotide-dissociation inhibitor)-1和GDI-2在胰岛素刺激后GLUT4转位过程中也起重要作用,rab10具有维持脂肪细胞对胰岛素反应的作用[6-9]。内毒素刺激巨噬细胞后,rab10调控TLR4受体从高尔基体运输补充至细胞膜上,rab10是巨噬细胞活化所必须的[10]。
本研究通过多种实验方法显示DAI后大鼠大脑皮层内的rab10的表达明显增加,以伤后1 d最显著,随着受伤时间延长,rab10表达逐渐下降。免疫荧光双标染色显示皮层神经元内rab10也有相似的变化规律。皮层神经元内rab10的变化趋势与细胞凋亡的趋势似乎并不相关,rab10表达较高时,凋亡细胞数目最少,并且既往也未见rab10参与凋亡过程的报道;相反,rab10的表达变化趋势与神经轴索形态变化一致,在神经轴索损伤严重的时间点(DAI后1~3 d),rab10的表达明显升高,随着时间延长,损伤的轴索经过内源性修复后形态恢复至良好(DAI后7 d),rab10的表达降低,但仍较正常高,这种时相的一致性提示rab10可能参与了神经轴索的修复过程,并且既往研究发现,rab10在轴突形成和神经元极化过程中起核心作用,rab10在抑癌蛋白Lgl1的作用下与胞质中的GDI解离,与Myosin Vb相互作用或与kinesin-1/JIP1形成复合体,调控质膜前体囊泡的转运,介导轴突的生长和神经元极化[11-13]。此外,神经轴索修复的过程中需要合成、运输大量的蛋白质和脂质,rab10参与内质网在细胞质中延展和重塑,介导蛋白质合成的过程,并影响合成的脂质和蛋白质在细胞内的运输[14-16]。因此,DAI后rab10的表达变化可能与神经轴索的内源性修复有关,并且rab10很可能通过调控内质网的形态功能和介导囊泡转运参与轴突的修复和再生。
综上,DAI后大鼠大脑皮层rab10的表达升高后逐渐降低,神经元内rab10有类似的变化规律。Rab10的表达变化可能与DAI后神经轴索形态修复的过程有关。进一步阐明rab10在DAI后神经轴索内源性修复中的具体机制可能揭示DAI后新的病理生理过程,并为DAI的治疗提供新的思路。
[1] 刘晓斌,宋锦宁,陈景宇,等. 脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学学报:医学版, 2008, 29(5):595-598.
[2] 宋锦宁,刘守勋,戈治理,等. 脑弥漫性轴索损伤的特点及临床诊断[J]. 中国神经精神疾病杂志, 1997, 23(3):141-144.
[3] LI Y, SONG J, LIU X, et al. High expression of STIM1 in the early stages of diffuse axonal injury[J]. Brain Res, 2013, 1495:95-102.
[4] SCHUCK S, GERL MJ, ANG A, et al. Rab10 is involved in basolateral transport in polarized Madin-Darby canine kidney cells[J]. Traffic, 2007, 8 (1):47-60.
[5] LERNER DW, MCCOY D, ISABELLA AJ, et al. A Rab10-dependent mechanism for polarized basement membrane secretion during organ morphogenesis[J]. Dev Cell, 2013, 24(2):159-168.
[6] CHEN Y, DENG Y, ZHANG J, et al. GDI-1 preferably interacts with Rab10 in insulin-stimulated GLUT4 translocation[J]. Biochem J, 2009, 422(2):229-235.
[7] CHEN Y, LIPPINCOTT-SCHWARTZ J. Insulin triggers surface-directed trafficking of sequestered GLUT4 storage vesicles marked by Rab10[J]. Small GTPases, 2013, 4(3):193-197.
[8] CHEN Y, WANG Y, ZHANG J, et al. Rab10 and myosin-Va mediate insulin-stimulated GLUT4 storage vesicle translocation in adipocytes[J]. J Cell Biol, 2012, 198(4):545-560.
[9] CHEN Y, LIPPINCOTT-SCHWARTZ J. Rab10 delivers GLUT4 storage vesicles to the plasma membrane[J]. Commun Integr Biol, 2013, 6(3):e23779.
[10] WANG D, LOU J, OUYANG C, et al. Ras-related protein Rab10 facilitates TLR4 signaling by promoting replenishment of TLR4 onto the plasma membrane[J]. Proc Natl Acad Sci U S A, 2010, 107(31):13806-13811.[11] WANG T, LIU Y, XU XH, et al. Lgl1 activation of rab10 promotes axonal membrane trafficking underlying neuronal polarization[J]. Dev Cell, 2011, 21 (3):431-444.
[12] LIU Y, XU XH, CHEN Q, et al. Myosin Vb controls biogenesis of post-Golgi Rab10 carriers during axon development[J]. Nat Commun, 2013, 4:2005.
[13] DENG CY, LEI WL, XU XH, et al. JIP1 mediates anterograde transport of Rab10 cargos during neuronal polarization[J]. J Neurosci, 2014, 34(5):1710-1723.
[14] CHANG J, BLACKSTONE C. Rab10 joins the ER social network[J]. Nat Cell Biol, 2013, 15(2):135-136.
[15] ENGLISH AR, VOELTZ GK. Rab10 GTPase regulates ER dynamics and morphology[J]. Nat Cell Biol, 2013, 15(2):169-178.
[16] SCHULDT A.Membrane dynamics: ER trailblazing by RAB10[J]. Nat Rev Mol Cell Biol, 2013, 14(2):63-64.
(编辑 国 荣)
Expression and significance of rab10 in the cerebral cortex of rats after diffuse axonal injury
ZHAO Yong-lin, SONG Jin-ning, MA Xu-dong, ZHANG Bin-fei, ZHANG Ming, LI Dan-dong, PANG Hong-gang
(Department of Neurosurgery, the First Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To explore the dynamic expression of rab10 in rat cerebral cortex after diffuse axonal injury (DAI) and its role in DAI. Methods Rat DAI models were established by a facility developed to let the rats’ heads spin 90 degrees at the moment to cause shearing injury. Rats were randomly divided into 4 subgroups (sham-operation group and 1, 3 and 7 d groups). The morphological changes of neural and axonal injury were observed under microscopy by Gless’ silver impregnation technique. Apoptosis of neurons was observed by TUNEL. Western blot and immunohistochemistry staining were used to determine the expression of rab10 in cerebral cortex after DAI. The expression and co-localization of rab10 and neuN in rats after DAI were evaluated by double-labeling immunofluorescence staining at different time points. Results The morphological damage was most obvious at 1 d after DAI, and the damage gradually lessened from 3 d to 7 d. TUNEL staining showed that the number of apoptotic cells began to rise at 1 d after DAI, and the number of apoptosis was higher at 3 d and 7 d. The expression of rab10 increased significantly at 1 d after DAI, declined slightly after 3 d, and declined significantly at 7 d (P<0.05). The co-localization of rab10 and neuN revealed that rab10 in neurons increased during 1 and 3 d after DAI and then gradually decreased. Conclusion Rab10 expression significantly increases and then gradually deceases in cerebral cortex of rats after DAI. Changes of rab10 expression in neurons might be related to the repair of axonal morphology after DAI.
diffuse axonal injury; rab10; neuron; cerebral cortex; rat; brain injury; cell apopotosis
2014-07-17
2014-10-10
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁. E-mail: jinnings@126.com
R651.1+5
A
10.7652/jdyxb201501002
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.0845.002.html(2014-11-19)
