不同来源白芍中芍药苷含量比较※
2015-02-23郭结晓林钰文
● 郭结晓 林钰文
不同来源白芍中芍药苷含量比较※
● 郭结晓1林钰文2
目的:比较不同来源白芍中芍药苷含量,为其药材质量控制提供一定的参考依据。方法:采用HPLC法测定不同产地、规格白芍药材和饮片中芍药苷含量,从化学成分上评价其质量差异。结果:白芍药材中野生品中芍药苷含量明显高于栽培品,以安徽亳州芍药中芍药苷含量最高,栽培品为3.82%,野生品为4.91%,经炮制加工后,白芍饮片中芍药苷流失较严重,其平均含量约为2.5%,但符合2010年《中国药典》白芍含量测定项下大于1.2%要求。结论:生长环境和炮制加工方法是影响白芍中芍药苷含量的主要因素。
白芍 芍药苷 含量测定 HPLC
芍药为我国常用传统中药材,以其干燥根为主要来源的中药饮片有赤芍与白芍二种[1]。从植物来源上,白芍和赤芍均来源于毛茛科芍药属植物,仅是加工方法有所差异,赤芍干燥即可,而白芍需要水煮去皮后才能入药。白芍主产于安徽亳州、浙江杭州和山东菏泽,主要为栽培品,偶有野生品[2],属于补虚药,长于补血平抑肝阳[3]。现代研究表明,白芍含有芍药苷、芍药内酯苷、苯甲酰芍药苷等单萜苷类和苯甲酸、没食子酸等酸类成分[3,4]。除了前述安徽亳州、浙江杭州和山东菏泽三个主要产区外,白芍在其他地区分布也较为广泛,产地众多,研究表明不同产地白芍中芍药苷含量有一定的差异[5],而栽培品和野生品含量是否有一定的差异,相关的文献报道较少,本文化学成分上探索药材产地、生长环境(野生与家种)对白芍有效成分的影响,为其药材质量控制提供一定的参考依据。
1 材料
Agilent-1100高效液相色谱仪,包括DAD检测器、自动进样器、在线脱气、四元泵(美国安捷伦科技有限公司);BS210S型电子天平(北京赛多利斯仪器系统有限公司)。乙腈为色谱纯,甲醇、磷酸等试剂均为分析纯,水为超纯水。芍药苷对照品(批号:0900-201109) 购于中国药品生物制品检定所(纯度≥98.0%);白芍采集与浙江、安徽、四川、山东等地,经广州中医药大学中药鉴定教研室鉴定为毛茛科植物芍药(Paeonia lactiflora Pall.)干燥根。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent Extend C18 (250 mm × 4.6 mm 5 μm) ;流动相:乙腈-0.1%磷酸溶液(14∶86);流速:1.0 mL·min-1;柱温:25 ℃;检测波长:230 nm;进样量为10 μL。
2.2 对照品溶液的制备 精密称取芍药苷对照品适量,置于50 mL量瓶中,加甲醇稀释至刻度,摇匀,制得60μg·mL-1对照品溶液,过0.45 μm微孔滤膜,即得。
2.3 供试品溶液制备[1]取样品粉末0.1g,精密称定,置500mL量瓶中,加稀乙醇35mL,超声处理(功率240W,频率45kHz)30分钟,放冷,加稀乙醇至刻度,摇匀,滤过,取续滤液,即得。
2.4 标准曲线的制备 精密量取对照品溶液0.1、0.2、.0.4、0.6、0.8、1.0mL,分别置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,然后按照“2.1”项下色谱条件进样10μL,测定芍药苷的峰面积,以峰面积Y为纵坐标,进样量(μg)为横坐标绘制标准曲线,得到回归方程分别为:Y=864.474X-5.678(R2=0.9996)。
2.5 精密度试验 精密吸取芍药苷对照品溶液10 μL,按上述色谱条件重复进样5次,照上述色谱条件测定峰面积积分值。结果芍药苷峰面积积分值的RSD=1.17%(n=5),表明仪器精密度良好。
2.6 稳定性试验 取同一份供试品溶液,按“2.3”项下方法制备供试品溶液,照上述色谱条件,在0、12、24、36、48 h进样测定。结果芍药苷峰面积的RSD=1.66%(n=5),表明供试品溶液在48 h内稳定。
2.7 重复性试验 取同一批白芍样品5份,按“2.3”项下方法制备供试品溶液,照上述色谱条件分别进样10 μL。结果芍药苷峰面积的RSD=2.37%(n=5),表明方法重复性良好。
2.8 加样回收率试验 精密称取白芍样品0.05 g,加入适量芍药苷的对照品,按“2.3”项下方法制备供试品溶液,照上述色谱条件测定,计算加样回收率。结果芍药苷的平均回收率为98.4%,RSD=2.33%(n=5)。
2.9 含量测定 按照上述含量测定方法,测定不同白芍样品中芍药苷的含量。结果表明,白芍药材中野生品中芍药苷含量明显高于栽培品,按产地比较,安徽亳州芍药中芍药苷含量最高,栽培品为3.82%,野生品为4.91%,药材经炮制加工后,饮片中芍药苷含量明显降低,白芍饮片中芍药苷流失较严重,其平均含量为2.5%,但符合2010年《中国药典》白芍含量测定项下大于1.2%要求。见图1、表1、表2。
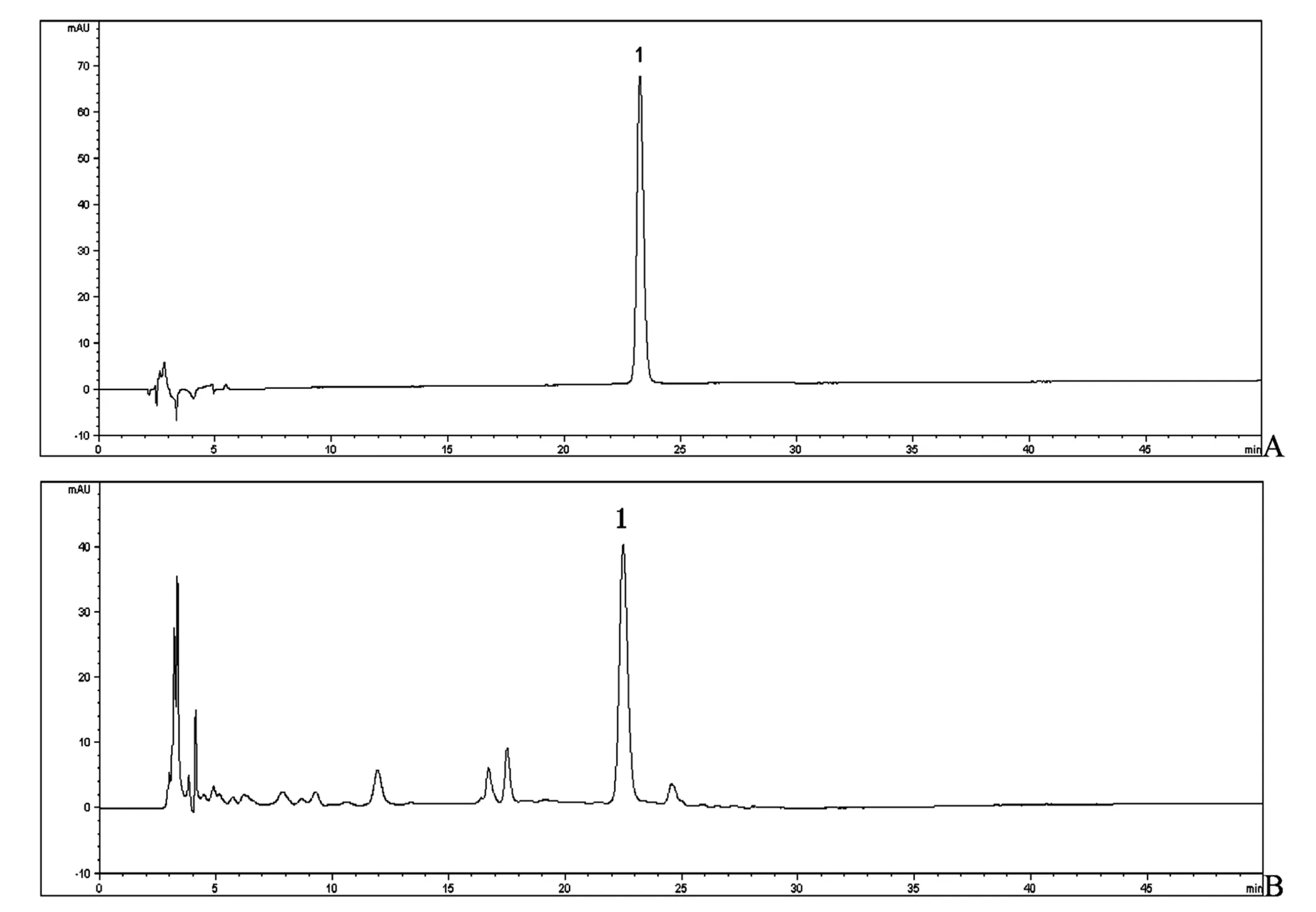
A.对照品;B.白芍药材;1. 芍药苷
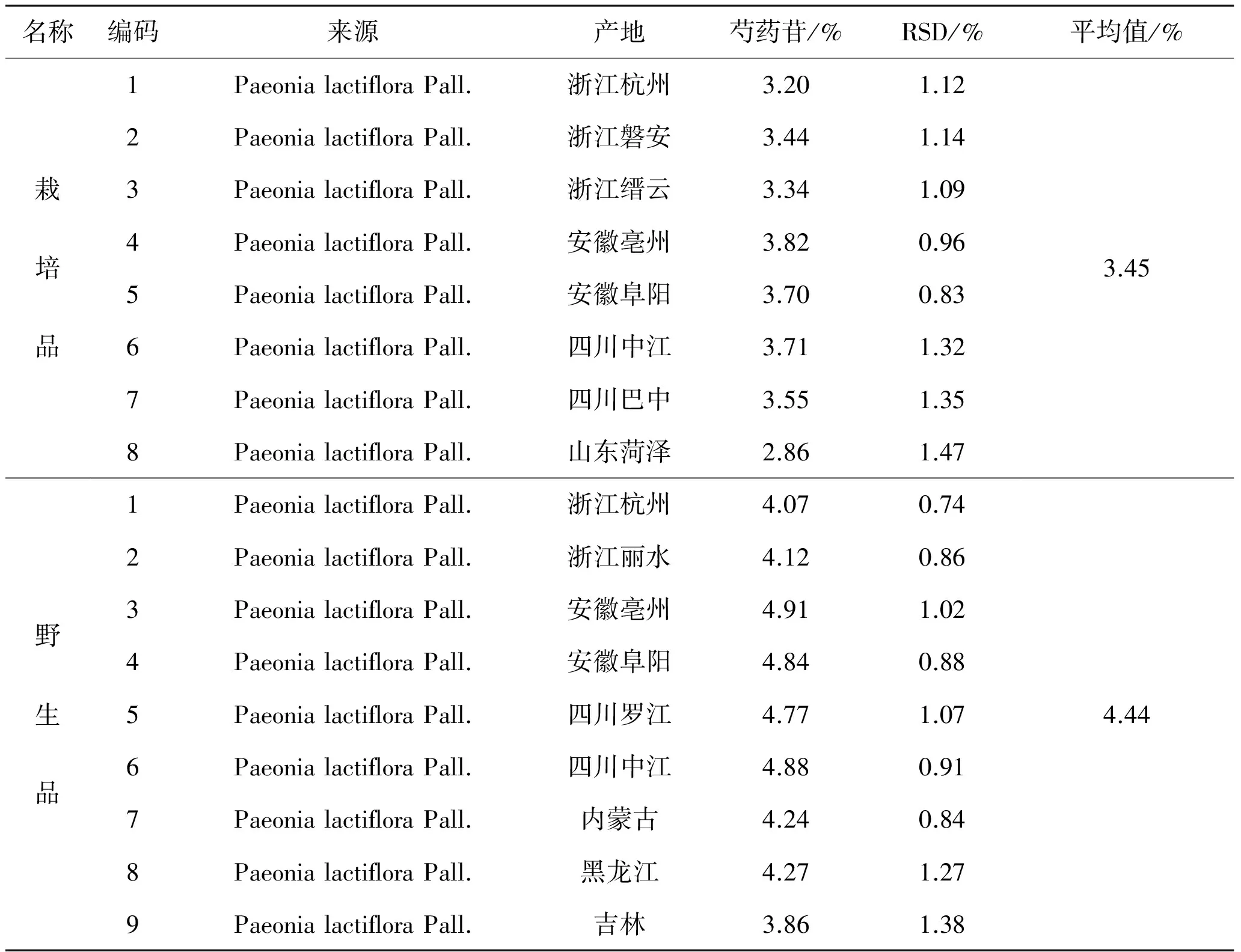
名称编码来源产地芍药苷/%RSD/%平均值/%栽培品野生品1PaeonialactifloraPall.浙江杭州3.201.122PaeonialactifloraPall.浙江磐安3.441.143PaeonialactifloraPall.浙江缙云3.341.094PaeonialactifloraPall.安徽亳州3.820.965PaeonialactifloraPall.安徽阜阳3.700.836PaeonialactifloraPall.四川中江3.711.327PaeonialactifloraPall.四川巴中3.551.358PaeonialactifloraPall.山东菏泽2.861.471PaeonialactifloraPall.浙江杭州4.070.742PaeonialactifloraPall.浙江丽水4.120.863PaeonialactifloraPall.安徽亳州4.911.024PaeonialactifloraPall.安徽阜阳4.840.885PaeonialactifloraPall.四川罗江4.771.076PaeonialactifloraPall.四川中江4.880.917PaeonialactifloraPall.内蒙古4.240.848PaeonialactifloraPall.黑龙江4.271.279PaeonialactifloraPall.吉林3.861.383.454.44
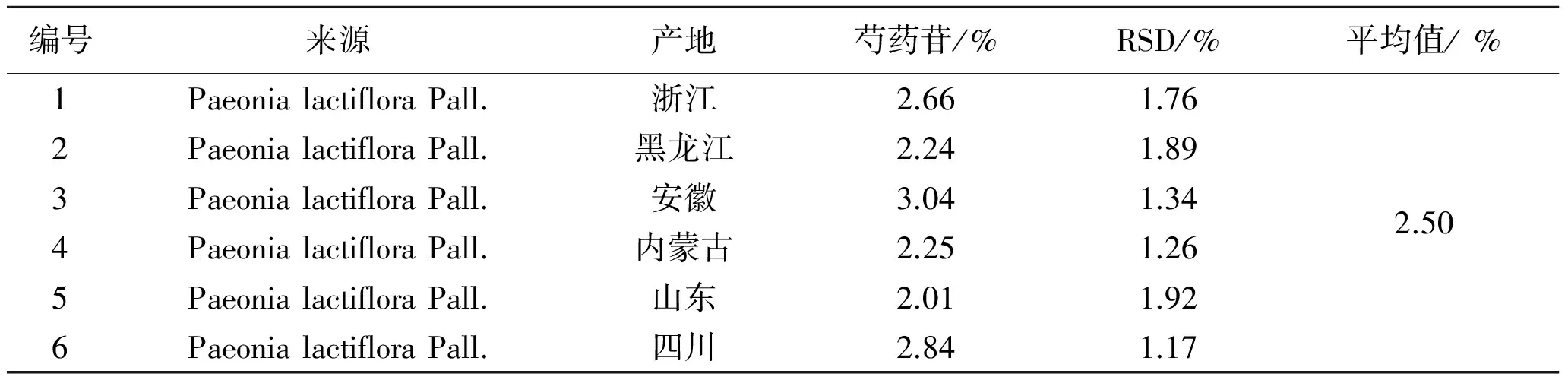
表2 不同产地白芍饮片中芍药苷含量的比较(n=5)
3 讨论
白芍来源于芍药,一般以栽培品入药,野生品经加工炮制后可做赤芍入药。本研究表明,由于生长环境不同,栽培品和野生品中芍药苷含量差异较大,野生品含量明显偏高。白芍经过水煮去皮等环节处理后,芍药苷流失严重,而赤芍省去了水煮和去皮等环节,其含量必定高于白芍。因此,如果白芍中以芍药苷为质量评价的指标,白芍加工炮制中水煮和去皮等环节是否有必要?而且赤芍与白芍同时来源芍药,因加工不同,而产生两种不同的药材饮片,虽然两种饮片中成分大致一致,而其临床应用却有所区别,因此白芍和赤芍化学成分的区别与其临床疗效的是否有一定相关性,有必要进一步进行研究。
[1]国家药典委员会.中国药典2010年版(一部)[S].北京:化学工业出版社,2010:96-97,147-147.
[2]冯耀南.中药材商品规格质量鉴别[M].广东广州:暨南大学出版社,1995:96.
[3]周红涛,骆亦奇,胡世林,等.赤芍与白芍的化学成分含量比较研究[J].中国药学杂志,2003,38(9):654-657.
[4]杨 柳,许舜军,吴金雄,等.白芍、赤芍的比较研究概况[J].中药新药与临床药理,2011,22(5):577-580.
[5]李 军,孟祥松,李 飞,等.不同产地白芍中芍药苷含量的比较研究[J].医药前沿,2013,9:104-105.
广东省中医院朝阳人才专项项目:《广东省中医院中药饮片验收标准》的编制
1.广东省中医院药学部(510120);2.广州市医药职业学校(510430)
