运动发酵单胞菌的筛选与鉴定
2015-02-22龚国利史政豪魏选明
龚国利, 史政豪, 张 甜, 魏选明
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
运动发酵单胞菌的筛选与鉴定
龚国利, 史政豪, 张甜, 魏选明
(陕西科技大学 食品与生物工程学院, 陕西 西安710021)
摘要:经过筛选,从土壤中获得一株可利用葡萄糖产乙醇的菌株(ZM607),通过对该菌的形态特征观察以及16SrDNA序列比对分析发现,将该菌初步鉴定为运动发酵单胞菌,并对该菌发酵葡萄糖产乙醇的发酵条件进行优化.结果表明:在静置、初始pH 6.5、发酵温度30 ℃、接种量5%等条件下,发酵48 h乙醇的产量达到45.12 g/L,乙醇得率是其理论值的73.01%.
关键词:运动发酵单胞菌; 乙醇; 16srDNA; 发酵
0引言
随着社会的不断发展,对化石燃料的需求量越来越大,化石燃料是不可再生资源,进而导致其储存量不断的减少,同时也加重了环境污染问题.所以,开发可再生资源来替代传统能源变得愈发紧迫.乙醇作为燃料能源,是传统的发酵产品,具有很多的优点,是化石燃料的理想替代品,发展潜力巨大[1-3].工业上生产乙醇一般就是通过化学合成法
和发酵法,化学合成法的原料是乙烯,由于石油的量不断减少使得乙烯价格也在不断的上涨,这就使得发酵法成为生产乙醇的主要方式[4].
运动发酵单胞菌是通过Enter-Doudoroff途径利用葡萄糖和果糖来发酵产生乙醇的,在发酵的过程中,丙酮酸脱羧酶、乙醇脱氢酶与该独特的糖酵解途径相偶联,进而大大提高了生产乙醇的效率.与酿酒酵母相比,它在发酵生产乙醇方面有着很独特的优点,如高耐乙醇能力、高耐糖能力、低生物量、糖吸收率高、发酵周期短、利于基因操作等,其在乙醇发酵中具有很广阔的前景[5,6].但目前大部分研究运动发酵单胞菌发酵的文献,菌株的来源都是从研究所购买,也有少数自己分离的都是从液体啤酒发酵液中分离而得,本文给出了一种从土壤中分离获得运动发酵单胞菌的方法,并对筛选到的菌株进行初步的发酵条件优化.
1材料与方法
1.1 材料
1.1.1土样
土壤样品取自陕西科技大学啤酒发酵中心周围土壤.
1.1.2培养基
(1)柠檬酸铁铵培养基:葡萄糖20 g,酵母膏5 g,放线菌酮3 mg,硫代硫酸钠1 g,柠檬酸铁铵1 g,磷酸二氢钾1 g,硫酸镁0.5 g,硫酸铵1 g,琼脂20 g,水1 000 mL.
(2)发酵培养基:葡萄糖120 g,酵母膏5 g,磷酸二氢钾1 g,硫酸镁0.5 g,硫酸铵1 g,水1 000 mL.
(3)基础培养基:葡萄糖100 g,酵母膏5 g,磷酸二氢钾1 g,硫酸镁0.5 g,硫酸铵1 g,琼脂20 g,水1 000 mL.
(4)TTC上层培养基:TTC 0.05 g,葡萄糖0.5 g,琼脂1.5 g,水100 mL.
(5)TTC下层培养基:葡萄糖10 g,酵母膏1.5 g,磷酸二氢钾1 g,硫酸铵1 g,硫酸镁0.5 g,柠檬酸0.3 g,琼脂20 g,水1 000 mL.
1.2 菌种分离
(1)富集培养:取土样1 g置于含100 mL无菌水的三角瓶中,200 r/min摇床振荡30 min,吸取悬浊液10 mL接种到含100 mL增殖培养基的三角瓶中,30 ℃,静置培养24 h.
(2)柠檬酸铁铵培养基初筛:吸取富集培养液50μL涂布于柠檬酸铁铵培养基上,30 ℃下恒温培养.待其长出彼此独立的菌落,挑取生长迅速、颜色为黑色的菌落进行平板划线,30 ℃培养2 d.反复几次,直至菌落纯化后,将其接入斜面培养备用[7].
(3)TTC平板筛选:将斜面培养的菌株接入TTC下层培养基上,在30 ℃下,倒置培养2 d,菌落长出后,倒入一薄层TTC上层培养基覆盖菌落,在30 ℃下避光保存4 h,挑取红色较深的菌落,斜面保存并编号,备用.
(4)摇瓶复筛:将经TTC平板复筛得到的菌株分别接入装有200 mL发酵培养基的三角瓶中,在30 ℃条件下静置进行发酵,48 h后测定几组发酵液中是否有乙醇产生,将有乙醇产生的菌株做进一步的鉴定.
1.3 菌种鉴定
提取待测菌株的DNA,对提取的DNA进行PCR扩增16SrDNA,用的引物是通用引物.PCR反应体系为25μL(DNA模板2μL、上游引物1μL、下游引物1μL、2.5 mmol/L dNTPs 2μL、2×GC buffer 10μL、5U/μL rTaq 0.2μL、ddH2O补至25μL).反应条件:95 ℃预变性3 min,95 ℃变性1 min,54 ℃退火1 min,72 ℃延伸30 s,循环30次,最后72 ℃延伸5 min.
将PCR产物的目的片段送至测序公司纯化并测序,将测序得到的基因序列在NCBI上进行BLAST比对,获得同源性较高的序列与菌株,再用MEGA5.1软件,使用N-J方法,构建系统发育树.
1.4 菌株生长曲线的绘制
细菌在对数生长期的比生长速度是最大的,同时具有很多有利于发酵的优点,如新陈代谢旺盛、生理特性稳定、酶活性高等,常接种对数生长期的菌液用于发酵研究,故了解所筛菌株的生长情况是非常重要的.
菌株生长曲线的绘制:(1)挑取几环待测菌落于100 mL液体培养基中,在30 ℃下的恒温培养箱内静置活化培养24 h.(2)按5%(体积比)的接种量把已活化好的菌液接种到含200 mL发酵液的三角瓶中,30 ℃下静置培养,每3 h取一次样,利用紫外-可见分光光度计测定OD600的值.(3)根据光密度值绘制该菌株的生长曲线.
1.5 发酵条件的优化
首先,对温度、初始pH、接种量等单因素对发酵液中乙醇产量的影响进行分析,温度的取值为25 ℃、30 ℃、35 ℃、40 ℃;初始pH分别为3.5、4.5、5.5、6.5、7.5;接种量分别为5%、10%、15%.将活化培养20 h的菌液接种到发酵培养基中,静置发酵48 h[8,9],测定发酵液中乙醇的含量,确定适宜的发酵条件.
根据上述单因素实验的结果,再对初始pH、发酵温度、接种量、发酵时间等采用四因素三水平的L9(34)正交表做正交试验(如表1所示),以确定最佳发酵条件.

表1 发酵条件优化正交试验设计
2结果与讨论
2.1 运动发酵单胞菌的筛选
从土壤中筛选到一株可以利用葡萄糖产乙醇能力较强的菌株,编号为ZM607.
2.2 ZM607的形态特征
ZM607在基础培养基上培养3~5 d后,形成圆形规则,边缘较整齐,凸起状,不透明,白色的菌落,如图1所示.在光学显微镜下观察,细胞呈直杆状,约为1.5~2.0μm×4.0~5.0μm,如图2所示.

图1 菌株ZM607的菌落形态

图2 ZM607的菌体形态(×40)
2.3 ZM607的鉴定
用一对通用引物对菌株ZM607的基因进行扩增,获得了约1 500 bp的扩增片段,与PCR预期结果一样,其电泳图如图3所示,其中四个条带均为ZM607基因的扩增产物的条带.将测得的序列在NCBI中进行序列同源性对比,得到与菌株ZM607同源性高的菌株,绘制出它的系统发育树,如图4所示.菌株ZM607与2株16SrDNA登录号为AB680510.1(Zymomonas mobilis NBRC 13756)和NR_028793.1(Zymomonas mobilis Barker Ⅰ)的亲缘关系最近,同源性为99%.因此,初步判断ZM607为运动发酵单胞菌(Zymomonas mobilis).

图3 菌株ZM607 16SrDNA PCR扩增结果
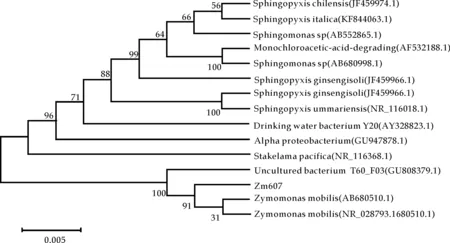
图4 菌株ZM607的系统进化树
2.4 菌株的生长曲线
由图5可知,接种后9 h,菌株进入对数生长期;18 h后,进入稳定生长期;所以,要获得对数生长期的菌液,需要对菌株活化18~20 h.
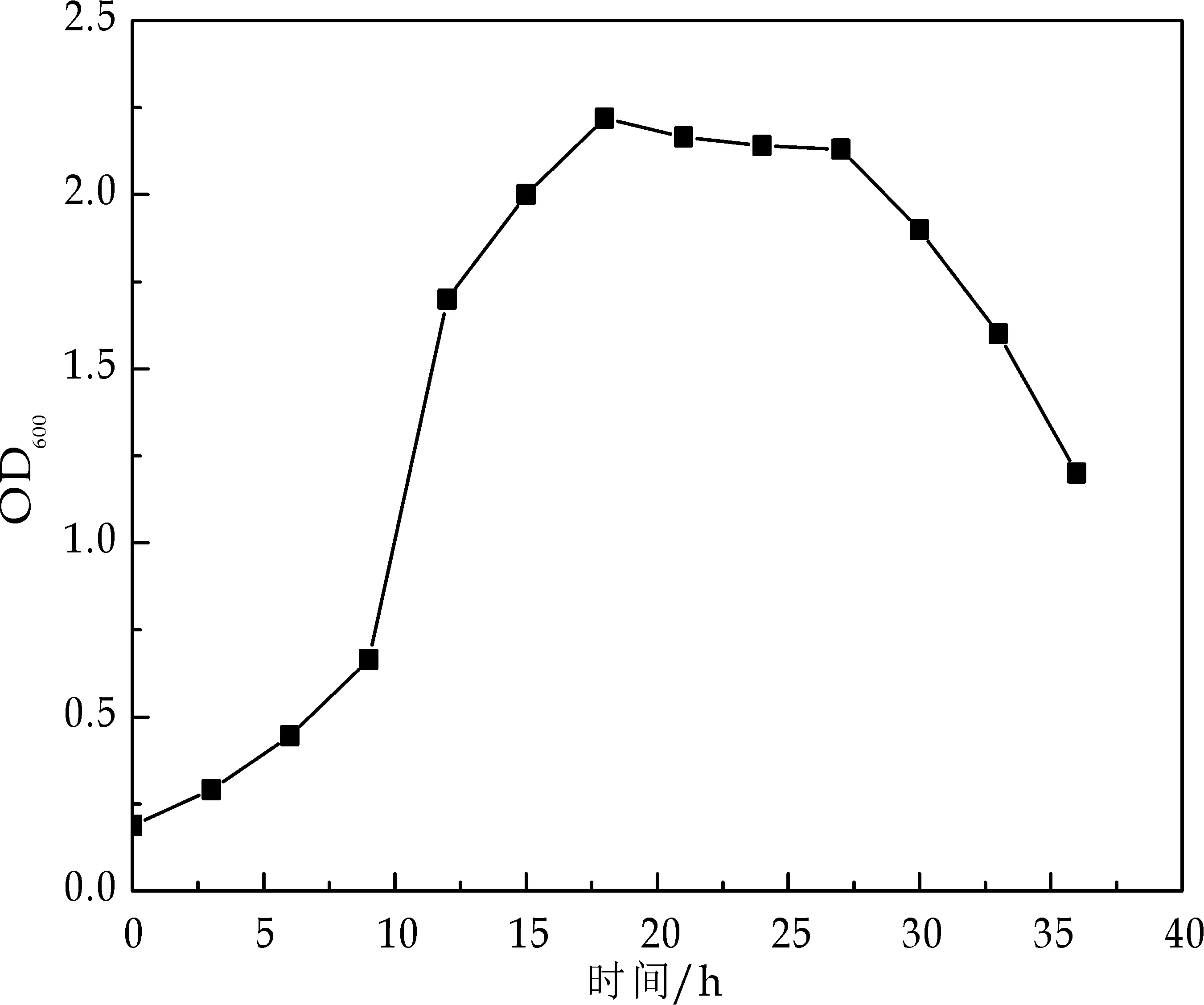
图5 菌株ZM607的生长曲线
2.5 最佳发酵条件
2.5.1适宜初始pH
由图6可知,当pH很低时,乙醇的产量较少.随着pH的上升,发酵液中乙醇的产量也随之增加.当pH=6.5时,乙醇产量最高,为40.22g/L.可见,运动发酵单胞菌ZM607发酵产乙醇的适宜pH在6.5左右.
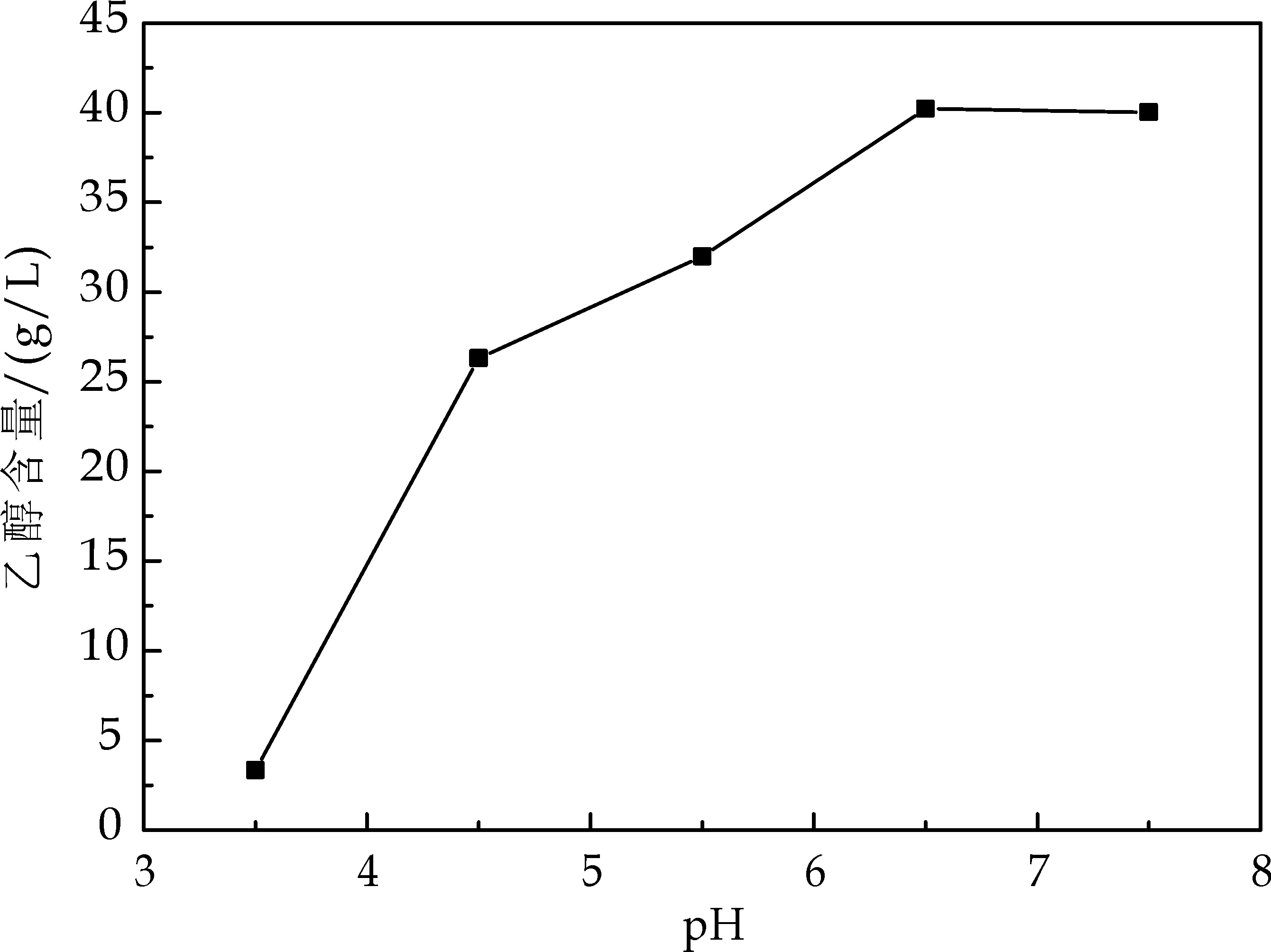
图6 pH对乙醇含量的影响
2.5.2适宜温度
由图7可知,发酵温度为30 ℃、35 ℃时,ZM607的乙醇产量最高,分别为43.25 g/L和44.1 g/L.当温度继续上升,乙醇的产量反而降低,可能是由于高温使细胞酶的活性降低,进而使菌体的发酵能力下降.所以,ZM607发酵产乙醇的适宜温度为30 ℃~35 ℃.
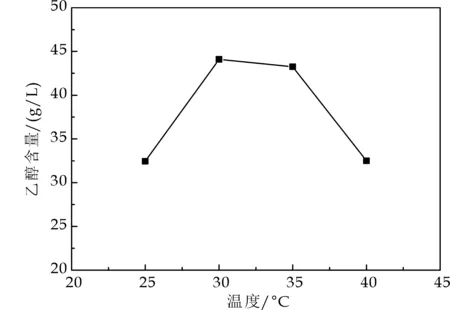
图7 温度对乙醇含量的影响
2.5.3适宜的接种量
当接种量为5%时,乙醇的量为36.12 g/L;当接种量为10%时,乙醇的产量为35.45 g/L;当接种量为15%时,乙醇的产量为28.76 g/L.可以看出,接种量对发酵液中乙醇产量的影响不是很大.综合考虑发酵周期和菌种利用率,ZM607发酵产乙醇的适宜接种量选择为5%左右.
2.5.4最佳发酵条件
由表2可以看出,发酵条件的最优组合是A2B2C1D2,即最佳发酵条件为:初始pH6.5,温度30 ℃,接种量5%,发酵时间48 h.
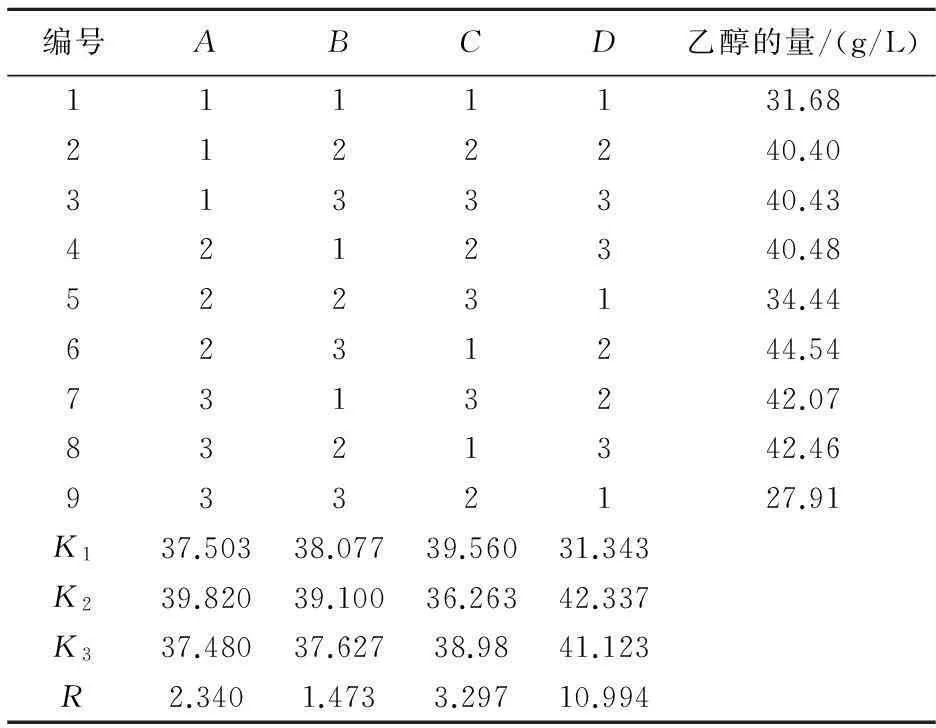
表2 发酵条件的正交试验结果
2.5.5验证实验
在上述所得到的最优发酵条件下进行三角瓶发酵,即初始pH6.5,温度30 ℃,接种量5%,发酵时间48 h.发酵结束后,测得乙醇的含量为45.12 g/L,乙醇得率较高,是理论值的73.01%.
3结论
本文主要提供了一种从土壤中筛选运动发酵单胞菌的方法,并对其产乙醇的发酵条件进行了优化,获得了最佳发酵条件.
从土壤中筛选得到一株产乙醇能力较强的细菌ZM607,并被初步鉴定为运动发酵单胞菌.在筛选过程中,选用TTC平板显色法筛选菌株的原理为:TTC本身是一种显色剂,它可以接受氢使自己呈现红色,红色的深浅与脱氢酶的有无或多或少有关.所以,高发酵效率的菌株,脱氢酶含量就越多,发酵过程中释放的氢就越多,TTC接受的氢也就会越多,红色越深,相反则红色越浅[10,11].TTC平板显色法筛选菌株简单方便,缩短了筛选的时间,进而提高筛选的效率.
菌株ZM607发酵产乙醇的最佳发酵条件为初始pH6.5,温度30 ℃,接种量5%,发酵时间48 h,发酵液中乙醇的产量为45.12 g/L.目前,运动发酵单胞菌还没有取代酵母菌用于大规模乙醇生产,主要的原因有:其碳源利用范围窄、发酵过程中有副产物产生、产生胞外果聚糖等[12].为解决这些问题,对运动发酵单胞菌进行遗传改造将成为科研工作者今后的研究方向.
参考文献
[1] Rogers P L,Jeon Y J,Lee K J,et al.Zymomonas mobilis for fuel ethanol and higher value products[J].Adv Biochem Eng Biotechnol,2007,108:263-288.
[2] Barbel H H,Torbhorn L,Thomas S,et al.Ethanolic of fermentation pentoses in lignocellulose hydrolysates[J].Applied Biochemistry and Biotechnology,1991,28(1):131-144.
[3] 贺应龙,胡秋龙,苏小军,等.一株可发酵木糖产乙醇细菌的筛选[J].湖南农业大学学报,2011,37(4):455-460.
[4] 谌井冈,张宝善.利用运动发酵单胞菌发酵生产酒精的研究进展[J].酿酒科技,2009(4):91-95.
[5] 何明雄,吴波,谭芙蓉,等.运动发酵单胞菌在生物炼制中的研究进展[J].生物技术进展,2014,4(5):331-339.
[6] 张向东,杨谦,张炳照,等.运动发酵单胞菌乙醇发酵条件的优化[J].现代化工,2009,29(10):129-131.
[7] 徐岩,张丽苹,顾国贤.啤酒酿造中腐败细菌的研究[J].酿酒,2000(6):68-72.
[8] 车勇平.运动发酵单胞菌产乙醇的研究[D].厦门:厦门大学,2008.
[9] 张炳照.运动发酵单胞菌发酵条件优化及其 PDC基因的原核表达[D].哈尔滨:哈尔滨工业大学,2008.
[10] 黄海霞,赵芸晨,李建龙.发酵木糖产乙醇酵母菌的选育及其发酵特性[J].城市环境与城市生态,2008,21(5):13-17.
[11] Gunasekaranand K,Chandra R.Ethanol fermentation technology[J].Current Science,1999,77:56-68.
[12] 蔺玉萍,张木清,陈柏铨.产乙醇运动发酵单胞菌的研究进展[J].微生物学报,2005,45(3):472-477.
Isolation and identification of zymomonas mobilis strain
GONG Guo-li, SHI Zheng-hao, ZHANG Tian, WEI Xuan-ming
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:By isolating,a strain (ZM607) which can convert glucose to ethanol was isolated from soil.The strain was identified as zymomonas mobilis by observation of morphological characteristics of bacteria and 16SrDNA analysis.The process for converting glucose to ethanol was optimized.The yield of ethanol was 45.12 g/L which accounted for 73.01% of the yield predicted theoretically when fermented in microaerophilic condition at 30 ℃, 5% inoculation, with initial pH 6.5 for 48 h.
Key words:zymomonas mobilis; ethanol; 16SrDNA; fermentation
作者简介:龚国利(1976-),男,内蒙古丰镇人,教授,博士,研究方向:微生物发酵
基金项目:国家自然科学基金项目(20906058); 陕西科技大学学术骨干培育计划项目(XSG2010009)
*收稿日期:2015-09-29
中图分类号:Q939
文献标志码:A
*文章编号:1000-5811(2015)06-0138-04
