青蒿素二聚体的合成及生物活性研究进展
2015-02-20陈娇
陈娇
(重庆西南大学化学化工学院 重庆 400715)
青蒿素是屠呦呦等中国科学家从植物青蒿中发现的一类新型抗疟药物,具有速效、高效和低毒的特点,尤为突出的是它对抗药性的恶性疟有特效、且能治愈抗氯喹的疟疾,但是它在水及油中的溶解度很低且生物利用度不高。双氢青蒿素(DHA)是青蒿素的最重要衍生物,它不但提高了青蒿素的溶解性、生物活性和生物利用度,而且引入了一个半缩醛的羟基,为保留青蒿素母体结构并进一步衍生提供了反应位点。从DHA 出发,中国科学家们成功合成了蒿甲醚、蒿乙醚及青蒿琥酯等双氢青蒿素衍生物,实现了青蒿素的简易衍生。更为可喜的是,脂溶性的蒿甲醚和水溶性的青蒿琥酯比DHA 具有更加优良的药学性质,顺利成为重要的抗疟一线治疗药物,目前是青蒿素联合疗法(ACT)的重要部分[1]。
近年来,众多DHA 新型衍生物被合成出来并显示更强的抗疟活性,硫代DHA 衍生物、DHA 脲类衍生物、DHA 琥珀酸酯衍生物等。生物活性扩展研究发现,DHA及其第一代衍生物对卵巢癌、肝癌、胰腺癌及白血病等表现出良好的抑制活性;大量新型DHA 衍生物的抗癌活性独具特色[2],其中部分已用于乳腺癌、结直肠癌、非小细胞肺癌等的临床试验中[3]。特别值得一提的是,青蒿素二聚体类衍生物的抗肿瘤效果尤为突出。
早在1980s, 研究人员便合成出了DHA 分子间脱水产物1 和2, 发现其抗疟活性较强[4]. 但是当时未测定其抗肿瘤活性. 之后, Woerdenbag 等也合成出了以上这两种二聚体, 并用MTT 法检测了它们对肿瘤细胞的药物活性, 结果发现以α 型和β 型相连的化合物1 的抗肿瘤活性最好, 细胞毒性是青蒿素的22 倍, 是DHA 的60 倍.
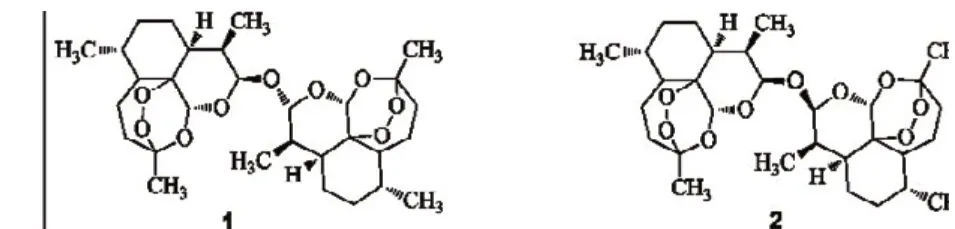
图1 最早被合成的DHA 二聚体

图2 具有抗癌活性的DHA 二聚体
Ahmed 等合成了用二元醇为连接链段的青蒿素醚类二聚体. 这类双分子化合物的抗疟活性一般高于青蒿素本身, 同时表现出一定的抗癌活性, 但很少超过蒿甲醚. 李英等[5]在专利中报道了含氮原子的DHA 二聚体3 的合成及其抗肿瘤活性研究, 其中的Linker 包含常见的脂肪二胺、氨基醇类、芳香二胺及酰胺类物质, 合成方法简便; 最终活性结果显示, 该类型化合物对子宫内膜癌、卵巢癌等癌细胞有较强的抑制作用. 2012 年李英[6]专利中还报道一个DHA 二聚体 (化合物3 中X = NH, Y 和Z同时为(CH2)2能够很好的抑制白血病细胞的增殖, 阻滞肿瘤细胞周期, 诱导肿瘤细胞凋亡.
从 1999 年开始, Posner 小组对青蒿素二聚体衍生物作了较全面的研究, 他们合成出的12 位碳—碳二聚体4很好的解决了稳定性的问题, 而且显示出较高的抗疟、抗癌活性. 最初, 他们合成了以苯环为主体链连接的二聚体, 其中化合物4a、4b、4c 对多种人癌细胞株比较敏感[7]. 之后, 他们对上述结构进行改造, 得到了具有较好抗疟、抗风湿和抗癌活性的新型二聚体衍生物4d 和4e.

图3 具有多种生物活性的DHA 二聚体
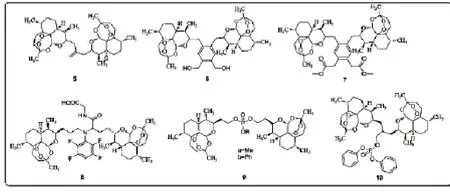
图4 其他类型的DHA 二聚体
Posner 等改进了方法, 仅用两步便合成出了一个更加稳定的C-苷二聚体5, 将其进行简单转化得到了另一种类型的12 位碳—碳键相接的二聚体. 2006 年, 他们又合成了以四碳链连接的二聚体, 其中化合物6 具有高于青蒿素10 倍的抗疟活性, 化合物7 则对多种人肿瘤细胞株有很好的增殖抑制作用[8].
Tomikazu[9]通过Ugi 反应合成具有复杂结构Linker的DHA 二聚体, 其中8 的抗乳腺癌BT474 的IC50值低至12 nM, 活性远强于青蒿琥酯. O’Neill 等[10]以磷酸酯为Linker, 合成了含有磷酸酯的DHA 二聚体, 活性测定结果表明9a、9b 的抗癌活性较多柔比星更强, 抗虐活性也强于DHA;其后他们又合成了系列该类型化合物, 多数表现出较强的抗疟和抗癌活性. Posner 等将磷酸酯结构引入5, 进一步衍生合成了10, 根据其分子量命名为838, 该化合物表现出良好的抗巨细胞病毒和抗白血病活性.
青蒿素为我国科学家研制的抗疟疾植物性药物,具有不良反应少,机体耐受性好等优点。近年来, 越来越多的DHA 二聚体被合成, 尽管二聚体的分子量普遍较大,但是总体具有较单体更强同时具有广泛的生物活性,对DHA 二聚体进行合成和生物活性研究,有望发现抗肿瘤或抗疟疾新药。
[1]Mutabingwa, T. K. Acta Trop. 2005, 95, 305.
[2]Lai, H. C.; Singh, N. P.; Sasaki, T. Invest. New Drugs 2013, 31, 230.
[3]Ghantous, A.; Gali-Muhtasib, H.; Vuorela, H.; Saliba, N. A.; Darwiche, N. Drug Dis.Today 2010, 15, 668.
[4]Galal A. M., Ahmad M. S., El-Feraly F. S. Preparation and characterization of a new artemisinin- derived dimmer [J]. J. Nat. Prod., 1996, 59(10): 917-920.
[5]李英.朱焰等. 含氮原子的青蒿素二聚体、其制备方法及用途[P]. CN 102153564 A.
[6]糜坚青, 李英等. 一种青蒿素衍生物及其药用盐的应用[P]. CN 102614168 A.
[7]Posner G. H.Antimalarial, antipro1iferative and antitumor activities of artemisinin-derived, chemically robust, trioxane dimmers [J]. J. Med. Chem. 1999, 42(21): 4275-4280.
[8]Paik I. H. Second generation, orally active, antimalarial, artemisinin-derived trioxane dimers with high stability, efficacy, and anticancer activity [J]. J. Med. Chem. 2006, 49(9): 2731-2734.
[9]Wang S.Sasaki T. Synthesis of artemisinin dimers using the Ugi reaction and their in vitro efficacy on breast cancer cells [J]. Bioorg. Med. Chem. Lett., 2013, 23(15): 2731-2734.
[10]Chadwick J. Synthesis and biological evaluation of extraordinarily potent C-10 carba artemisinin dimers against P. falciparum malaria parasites and HL-60 cancer cells [J]. Bioorg. Med. Chem., 2009, 17(3): 1325-1338.
